Синтетические фосфонаты являются основой многих ксенобиотиков и широко распространены среди химических веществ антропогенного происхождения, среди которых: отравляющие вещества, создаваемые в качестве химического оружия – VX, зарин и зоман; гербицид глифосат (фосфонометилглицин); производные этил- и фенилфосфонатов, используемые как инсектициды; алафосфалин и фосфономицин (бисфосфонаты) – антибиотики; циклические эфиры ароматических бисфосфонатов – полимерные добавки; фирол 76 – пламягаситель, полиаминополифосфоновые кислоты – ингибиторы коррозии [1–3].
Однако наиболее широко используемым в мире фосфонатом является гербицид системного действия глифосат, который служит основой более трех десятков препаратов, выпускаемых под разными фирменными названиями и потребляемых в больших количествах (только в США ежегодно применяется около – 22000 т этого гербицида, производимого известными фирмами «Монсанто», «Дау Агро Сайэнс» и др., в Украине – 1500 т) [цит. по 4]. Использование биологических методов утилизации токсичных фосфонатов, к которым относится и глифосат, отходов их производства и продуктов разложения, рассматривается российскими и зарубежными специалистами в качестве главной альтернативы физическим и химическим методам защиты окружающей среды от токсикантов этого типа [1, 2].
В этом плане актуальными являются исследования, проводимые вятскими биотехнологами и микробиологами (ВятГУ и ВГСА) и по созданию биологических консорциумов на основе штаммов-биодеструкторов, разработке новых биотехнологических подходов комплексного использования их для уничтожения ксенобиотиков, в том числе фосфонатов, в природных и искусственных средах [5–7].
Практический интерес представляет использование глифосатустойчивых изолятов протеобактерий, выделенных из почвы в местах интенсивного использования глифосата, в биотехнологии деградации фосфонометилглицина.
Целью настоящей работы являлась сравнительная оценка эффективности разложения глифосата почвенными изолятами протеобактерий.
Материалы и методы исследования
Для тестирования чувствительности псевдомонад к глифосату использовали препарат Раундап («Монсанто», США), содержащий 36 % глифосата.
Изоляты микроорганизмов. В работе использованы вновь выделенные изоляты протеобактерий Proteus vulgaris, Pseudomonas alcaligenes и ранее выделенный изолят P. fluorescens с типичными родовыми и видовыми свойствами, в качестве контролей – ранее описанные изоляты бактерий, выделенные сотрудниками ВятГУ [5, 6].
Питательные среды. Для выращивания микроорганизмов использовали плотную питательную среду, содержащую: картофельный крахмал - 1,0 %; соевую муку - 3,0 %; (NH4)2C4H4O6 - 0,6 %; (NH4)2S04 - 0,4 %; СаСО3, - 0,8 %; К2НРО4 - 0,01 %; глюкозы - 2,0 %; агара - 2 %, воды водопроводной до 100 % и жидкую среду того же состава - без агара «соевая среда». Для стерилизации сред и почв использовали их автоклавирование при 121 °С в течение 1 часа.
Микробиологические методы
Количественный анализ содержания глифосата в почве и других исследуемых средах определяли методом газо-жидкостной хроматографии на хроматографе Shimadzu – QP 2010 с масс-селективным детектором (химическая ионизация) с использованием в качестве контроля растворов коммерческого препарата Раундап («Монсанто», США). Ионизирующее напряжение – 70 э.в., температура источника ионов 200 ºС, в диапазоне массовых чисел 39–520 а.е.м. Хроматографическое разделение производных глифосата проводили на кварцевой капиллярной колонке с фазой Eqity («Supelco», CША) при температуре от 120 до 290 ºС. Температура инжектора составляла 270 ºС. Масс-спектрометрией с химической ионизацией подтверждали молекулярную массу глифосата. В качестве газа-реагента использовали метан особой чистоты (99,9995 %). Предел обнаружения метода для глифосата в исследуемых средах составлял 5 нг∙см–3. Для приготовления растворов, используемых в соответствии с инструкцией к хроматографу, при получении экстрактов из сред и приготовления подвижной фазы использовали реактивы квалификации «ХЧ».
Определение групповой принадлежности почвенных микроорганизмов, определение обсемененности и выделение чистых микробных культур проводили общепринятыми методами [8–12].
В качестве посевного материала использовали двухсуточные культуры бактерий, выращенные на плотной среде при температуре 24–28 °С. Культуры, выросшие на плотной среде, смывали физиологическим раствором и разводили до концентрации 1,5·109 бактерий в см3.
В колбы Эрленмейера объемом 500 вносили по 62,5; 250,0 и 1000,0 мкл препарата Раундап (22,5; 90,0 и 360,0 мг глифосата), затем готовой жидкой средой доводили объем рабочей смеси в колбах до 140 см3 и вносили по 10,0 см3 исследуемых посевных культур. Конечная концентрация бактерий в среде при посеве составляла 1,0·108 протеобактерий в см3, глифосата – 150 и 600 мкг·см–3. Выращивание вели при температуре 24–28 °С на шуттеле со скоростью вращения платформы 250 об/мин. Через 24 ч культивирования проводили определение количества живых бактерий в средах путем высева серийных разведений на плотные среды. Родовую и видовую принадлежность выделяемых получаемых микробных культур проводили с использованием идентификационных тест-систем (наборов) МИКРО-ЛА-ТЕСТ, производства PLIVA – Lachema (Чехия) и прилагаемых к ним Code book [12].
Результаты исследования и их обсуждение
Культуры протеобактерий Proteus vulgaris, Pseudomonas alcaligenes были выделены и идентифицированы при исследовании микробной обсемененности проб почвы, отобранных на участках сельхозугодий в Оричевском и Нововятском районах Кировской области, которые многократно подвергались воздействию глифосата [5]. При каждой обработке методом распыления расход на 100 м2 поля, предназначенного под посев овощных культур и картофеля, в среднем составлял 5 литров водного раствора, содержащего 65–70 мл 36 % глифосата.
В августе 2013 г. было отобрано четыре группы образцов почвы по 5 проб в каждой: 1 группа – образцы почвы, не обрабатываемой ранее гербицидами (контроль почвы перед обработкой глифосатом); 2 группа – образцы почвы, обработанной однократно в июле 2013 г., с последней обработки до взятия пробы прошел один месяц; 3 группа – образцы почвы, обработанной 11 раз в предшествующие пять лет (2008–2012 гг.) в весенне-летний период, при этом с последней обработки прошел год; 4 группа – пробы почвы, обработанной 11 раз в предшествующие пять лет (2008–2012 гг.) в весенне-летний период и дополнительно – однократно в июле 2013 г., с последней обработки до взятия проб прошел один месяц.
Результаты анализов свидетельствовали, что общее количество микроорганизмов менялось в зависимости от количества обработок гербицидом, так, в 1 группе (контрольной) образцов почвы средняя численность микроорганизмов составляла 8·105 КОЕ·г–1, в 2–4 группах 5·102; 9·104; 2·104 КОЕ·г–1 соответственно (рис. 1).
Полученные результаты свидетельствуют, что обработка гербицидом почвы приводит к резкому снижению плотности микроорганизмов в ней. Через месяц после однократной обработки глифосатом количество микроорганизмов в исследуемых образцах почвы было меньше в 1600 раз в сравнении с контрольными. Через год после многократной (11 раз в течение 5 лет) обработки гербицидом содержание микроорганизмов в почве в значительной степени восстановилось, но было ниже, чем в контроле, примерно в 8,9 раза. В этом случае, по-видимому, сказывалось накопление глифосата и продуктов его разложения в почве.
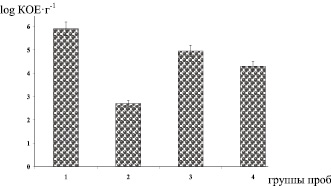
Рис. 1. Содержание общего количества микроорганизмов (log колониеобразующих единиц – log КОЕ) в 1 г проб почвы: 1 – не подвергавшейся воздействию глифосата (контроль до воздействия гербицидом); 2 – обработанной однократно в июле 2013 г., за месяц до отбора и анализа проб; 3 – подвергавшейся воздействию глифосата 11 раз в течение предшествующих пяти лет (2008–2012 гг.); 4 – подвергавшейся воздействию фосфонометилглицина 11 раз в течение предшествующих пяти лет (2008–2012 гг.) и 1 раз в 2013 г., за месяц до отбора и анализа проб
Результаты определения общего количества микроорганизмов в четвертой группе проб показали, что микрофлора почвы, регулярно подвергавшейся обработке глифосатом, стала устойчива к повторным воздействиям гербицида и быстрее восстанавливалась. Об этом свидетельствуют результаты сравнительного анализа через месяц после обработки глифосатом образцов проб почвы, многократно подвергавшейся воздействию глифосата в предшествующие годы и первично обработанной глифосатом, среднее содержание микроорганизмов в образцах проб почвы группы 4 было в 50 раз выше, чем в образцах почвы группы 2.
В ходе исследований образцов почвы, многократно обработанных глифосатом (12 раз в течение 6 лет), были выделены и идентифицированы по 6 изолятов бактерий видов Pseudomonas alcaligenes и 4 изолята Proteus vulgaris, которые наряду с ранее выделенными [5] изолятами P. fluorescens обладали повышенной устойчивостью к токсическому действию глифосата в сравнении с контрольными лабораторными изолятами, не контактировавшими с гербицидом (табл. 1).
Таблица 1
Распределение изолятов бактерий по уровням устойчивости к глифосату
|
Видовая принадлежность культур бактерий |
Количество изолятов (из числа выделенных), способных к росту в жидкой питательной среде с глифосатом в концентрации…, мкг·см-3 |
|||
|
0,006 |
0,025 |
0, 1 |
0,4 |
|
|
P. alcaligenes |
– |
1 |
3 |
2 |
|
Pr. vulgaris |
– |
2 |
1 |
1 |
|
P. fluorescens* |
– |
– |
5 |
2 |
|
P. alcaligenes 214** |
1 |
– |
– |
– |
|
Pr. vulgaris МС 12** |
1 |
– |
– |
– |
|
P. fluorescens 1457** |
1 |
– |
– |
– |
Примечания: * культуры изолятов, выделенные ранее [5];
** культуры изолятов, ранее не контактировавшие с гербицидом.
При этом 3 из вновь выделенных 10 изолятов P. alcaligenes и Pr. vulgaris (30 %) были способны к росту в жидкой среде, содержащей 0,4 мкг/см3 глифосата, 4 изолята (40 %) и 3 изолята (30 %) бактерий были способны к росту в жидкой среде, содержащей соответственно 0,1 и 0,025 мкг·см–3 фосфонометилглицина.
На основе первичных изолятов, устойчивых к 0,4 мкг·см–3 глифосата, в результате восьми пересевов культур в жидкой соевой среде с возрастающими концентрациями глифосата и отбора наиболее устойчивых клонов были выделены клоновые культуры Pr. vulgaris 3/8, P. alcaligenes5/8 и P. fluorescens 047/8 с резистентностью к 50, 110 и 250 мкг·см–3 глифосата соответственно (рис. 2).
Как видно из данных, представленных на рис. 2, при равной исходной чувствительности к глифосату нарастание устойчивости к нему у изолята псевдомонад вида P. fluorescens происходило более интенсивно, чем у изолята вида P. alcaligenes и вульгарного протея. В результате 8 пассажей на средах с возрастающими концентрациями глифосата культура P. fluorescens 047/8 повысила уровень устойчивости первичного изолята в 625 раз, в то время как культура P. alcaligenes 5/8 – в 275 раз, культура Pr. vulgaris 3/8 – в 125 раз.
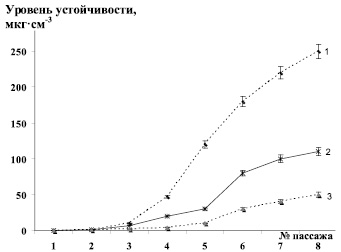
Рис. 2. Изменение уровней устойчивости бактерий в процессе восьми пассажей культур изолятов на среде с возрастающими концентрациями глифосата: 1 – P. fluorescens 047/8; 2 – P. alcaligenes5/8; 3 – Pr. vulgaris 3/8
На следующем этапе исследований, представлялось целесообразным оценить возможность использования глубинных культур полученных вариантов в процессах деструкции глифосата в лабораторных условиях глубинного культивирования и при их интродукции в контаминированную данным гербицидом почву.
При глубинном культивировании всех трех исследуемых культур и их исходных изолятов в «соевой среде» без гербицида при посевной концентрации 1,0·108 КОЕ·см–3 через сутки их концентрация составляла (4,9–6,2)·109 КОЕ·см–3 (табл. 1). Внесение в среду 150 мкг·см–3 глифосата сопровождалось снижением исходной концентрации бактерий после засева в случае культур вариантов Pr. vulgaris 3/8 и P. alcaligenes 5/8 до 0,3·106 и 0,4·108 КОЕ·см–3, при этом концентрация глифосата в среде, снижалась на 26,7–50,0 %. Культура P. fluorescens 047/8 была способна расти на среде содержащей 150 мкг·см–3 гербицида, при этом она способствовала инактивации за сутки 90 % гербицида, хотя концентрация бактерий повысилась за сутки только до 3,8·109 КОЕ·см–3, что в 1,6 раз ниже, чем в среде без глифосата. Следует отметить, что 6,7 % глифосата в контрольных средах инактивировалось без участия бактерий и при высеве исходных изолятов (табл. 2).
Таблица 2
Инактивация глифосата в жидкой «соевой среде» при глубинном культивировании протеобактерий
|
Микроорганизм |
Концентрация глифосата в жидкой среде, мкг·см-3 |
Содержание живых бактерий в среде через 24 ч, КОЕ·см-3 |
|
|
исходная |
после культивирования ( % от исходной) |
||
|
P. fluorescens 047/8 |
0 |
0 |
6,2·109 |
|
150 |
15 (10,0) |
3,8·109 |
|
|
600 |
200 (33,3) |
0 |
|
|
P. fluorescens 047 (исходный изолят) |
0 |
0 |
6,1·109 |
|
150 |
140 (93,3) |
0 |
|
|
P. alcaligenes 5/8 |
0 |
0 |
4,9·109 |
|
150 |
75 (50,0) |
0,4·108 |
|
|
600 |
450 (75) |
0 |
|
|
P. alcaligenes 5 (исходный изолят) |
0 |
0 |
4,7·109 |
|
150 |
140 (93,3) |
0 |
|
|
Pr. vulgaris 3/8 |
0 |
0 |
5,7·109 |
|
150 |
110 (73,3) |
0,3·106 |
|
|
600 |
510 (85,0) |
0 |
|
|
Pr. vulgaris 3 (исходный изолят) |
0 |
0 |
5,5·109 |
|
150 |
140 (93,3) |
0 |
|
|
Контроль (инактивация гербицида в среде без бактериальных культур) |
150 |
140 (93,3) |
- |
|
|
600 |
560 (93,3) |
- |
Далее был поставлен эксперимент по контаминации образцов стерильной почвы (рН 6,7) глифосатом из расчета 2400 мкг·см–3 с последующей инокуляцией в нее глубинной культуры P. alcaligenes 5/8, выращенной в «соевой среде» с 150 мкг·см–3 глифосата, до конечной концентрации в почве 1,0·108 КОЕ·см–3. В качестве контроля была использована та же почва без инокуляции микробной культуры. Уже через 5 часов после инокуляции глифосата в почве с внесенной в нее культурой P. alcaligenes 5/8 глифосат не определялся, в то время как в контрольных образцах его содержание в этот период снизилось за счет связывания частицами почвы, действия почвенных солей и других факторов только до 1200–1400 мкг·см–3.
Следует отметить, что период нормального полураспада глифосата в почве в зависимости от типа почв, как было установлено специалистами US EPA, находится составляет от 3 до 130 дней [13].
Выводы
1. В результате 8 пассажей на средах с возрастающими концентрациями глифосата получены варианты Pr. vulgaris 3/8, P. alcaligenes5/8 и P. fluorescens 047/8 с резистентностью к 50, 110 и 250 мкг·см–3 глифосата, что превышает уровни устойчивости первичных изолятов (исходных культур) в 125; 275 и 625 раз соответственно.
2. Инокуляция культуры варианта P. alcaligenes 5/8 в концентрации 1,0·108 КОЕ см–3 в стерильные образцы почвы, содержащей 2400 мкг·см–3 глифосата, привела к тому, что гербицид в почве не определялся уже через 5 часов, что свидетельствует о возможности создания с использованием данной глифосатрезистентной культуры специальных препаратов для ремедиации загрязненных этим ксенобиотиком почв.
Рецензенты:
Кузнецов С.М., д.м.н., начальник лаборатории промышленных микроорганизмов, ЗАО «Маркетинг-Бюро», г. Киров;
Погорельский И.П., д.м.н., профессор, ведущий научный сотрудник НИЦ ФГКУ «48 ЦНИИИ» Минобороны России, г. Киров.
Работа поступила в редакцию 28.07.2014.
Библиографическая ссылка
Бакулин М.К., Овсянников Ю.С., Туманов А.С., Бакулин В.М. ДЕГРАДАЦИЯ ГЕРБИЦИДА ГЛИФОСАТА БАКТЕРИЯМИ РОДОВ PSEUDOMONAS И PROTEUS // Фундаментальные исследования. 2014. № 8-6. С. 1377-1382;URL: https://fundamental-research.ru/ru/article/view?id=34772 (дата обращения: 04.03.2026).



