В 1944 г. шведский исследователь Холмберг обнаружил в плазме крови человека фермент, сходный по свойствам с растительным медьпротеидом – лакказой [4]. Дальнейшее интенсивное изучение этого фермента показало, что он связывает почти 95 % всей меди плазмы крови и характеризуется широким спектром оксидазной активности [5, 6]. Из-за синего цвета его концентрированных растворов этому ферменту было дано название «церулоплазмин» (blue substance from plasma). Он окисляет аскорбат, гидрохинон, ароматические диамины и дифенолы, биогенные амины – адреналин, норадреналин, серотонин, дофамин, ионы Cu+ и Fe²+. В итоге в Классификации ферментов ему было присвоено систематическое наименование Fe(II):кислород оксидоредуктаза (КФ 1.16.3.1).
Также была обнаружена его способность дисмутировать супероксидные радикалы, связанная с глутатионом пероксидазная активность, активность как NO2‒-синтазы и NO-оксидазы. Фермент может выступать в качестве прооксиданта, участвуя в окислении липопротеидов низкой плотности (см, например, обзоры [2, 16]).
Такая мультифункциональная природа церулоплазмина, с одной стороны, и отсутствие данных о его истинной физиологической роли (ролях), с другой, позволило назвать его «загадочным синим белком» [8]. Начало конца этой загадки (the beginning of the end of an enigma [10]) было положено
исследованиями атомной структуры церулоплазмина методом рентгеноструктурного анализа [1, 9, 10, 14, 19, 20]. Было установлено, что молекула церулоплазмина (единичная полипептидная цепь, 1046 аминокислотных остатков) состоит из шести субглобул (доменов). По структурному сходству эти домены разделяются на две группы: нечетные домены 1, 3 и 5 и четные домены 2, 4 и 6. Топология укладки полипептидной цепи в этих доменах соответствует таковой в однодоменных «синих» медьпротеидах, относящихся к суперсемейству купредоксинов. Сам же церулоплазмин относится к семейству мультидоменных купредоксинов, в состав которого также входят такие белки, как лакказа, оксидазы CotA и CueO, аскорбатоксидаза, факторы свертывания крови V и VIII, гефестин, циклопен, билирубиноксидаза, белок Fet3p, нитритредуктаза, металлооксидазы и др. [15]. Представители этого семейства чрезвычайно широко распространены в природе: они обнаружены в археях, бактериях и эукариотах [7, 17].
Медь-связывающие центры белков купредоксинового семейства принято классифицировать по трем типам [13]. В центрах Т1Cu (т.наз. «синих») в качестве лигандов иона Cu выявлены два остатка His, один – Cys и один – Met («каноническая четверка» остатков). Остаток Met в ряде медьпротеидов замещен на Leu, Phe или Glu. В центрах Т2Cu (т.наз. «не синих») ион Cu координирован двумя остатками His и гидроксильной группой или молекулой Н2О. Центры Т3Cu (т.наз. биядерные) содержат два антиферромагнитно спаренных иона Cu2+, каждый из которых связан с тремя остатками His, а между этими ионами находится либо ОН-группа, либо молекула O2. Причины этого будут объяснены ниже. Центры Т1Cu и Т3Cu сближены друг с другом, образуя т.наз. триядерный кластер.
В церулоплазмине центры T1Cu находятся только в четных доменах, а триядерный кластер – между доменами 1 и 6. Центры Т1Cu в доменах 4 и 6 сформированы «канонической четверкой» лигандов – His637, H685, Cys680 и Met690 (домен 4) и His975, His1026, Cys1021 и Met1031 (домен 6), в то время как в домене 2 остаток Met замещен на очень слабо связанный с ионом Cu остаток Leu (His276, His324, Cys319 и Leu329) [20]. Скорее всего, ион Cu в центре Т1Cu домена 2 постоянно находится в восстановленном состоянии – Cu+ [11]. Требуются дополнительные исследования для выяснения вопроса о функциональной роли этого центра. Не исключено, что он функционально неактивен и является своеобразным «эволюционным реликтом». Расстояния между тремя центрами Т1Сu очень близки друг к другу и находятся в диапазоне 17,5–17,9 Å. Центр Т1Cu в домене 6 находится на расстоянии 12,5–13 Å от ионов Cu2+ биядерного центра, а все три иона Cu2+ в триядерном кластере сближены на расстояние 3,4-4,5 Å. Указанное выше расстояние между центрами Т1Cu в доменах 4 и 6 достаточно для эффективного переноса электронов, что обеспечивает одномоментное окисление более чем одной молекулы субстрата (рис. 1) [9, 11].
Строение триядерного кластера (Cu2 + Cu3 + Cu4) показано на рис. 2. Данные рентгеноструктурного анализа показали, что центр Т2Cu (Cu4) находится в двух конфигурациях, отражающих различные стадии каталитического акта [1]. В одной конфигурации с ионом Cu этого центра связана ОН-группа, в другой – молекула H2O (W148). В любой из этих конфигураций ион Cu координирован остатками His101 и His978.
В домене 6 предположительно существует дополнительный центр связывания двухвалентных ионов металлов (Со, Fe, Cu) – т.наз. «labile» центр [1, 9] (M2+-центр по терминологии [11]). В случае Cu2+ лигандами такого иона могут служить остатки от домена 2: Glu272 и от домена 6: His940, Glu935 и Asp1025. Последний остаток характеризуется двумя альтернативными конфигурациями. В одной из них этот остаток ориентирован по направлению к М2+-центру, в другой – от этого центра, так что атом О (дельта 1) образует междоменную водородную связь с атомом N (дельта 2) остатка Asn271 домена 2. Степень заполнения этого центра – 50 %. Также возможно участие по крайней мере трех молекул Н2О (W111, W200 и W292) в связывании катиона этого центра. Учитывая, что в центрах T1Cu находятся три иона Cu и еще три – в триядерном центре, общее число связанных с церулоплазмином ионов Cu превышает шесть, что согласуется с данными, полученными ранее другими методами [3].
В домене 2 указанный для домена 6 мотив связывания двухвалентного катиона отсутствует; положение, эквивалентное остатку His940, занимает Tyr241.
В домене 2 указанный для домена 6 мотив связывания двухвалентного катиона отсутствует; положение, эквивалентное остатку His940, занимает Tyr241.
Что же касается домена 4, то в нем более вероятно существование дополнительного центра связывания молекулы H2O (W201). Она образует водородные связи с His602 (2,28 Å), Glu971 (2,35 Å) и со второй молекулой Н2О (W321). Расстояние между W201 и W321 – 2,44 Å. В свою очередь, молекула W321 образует водородную связь с Glu597 [1].
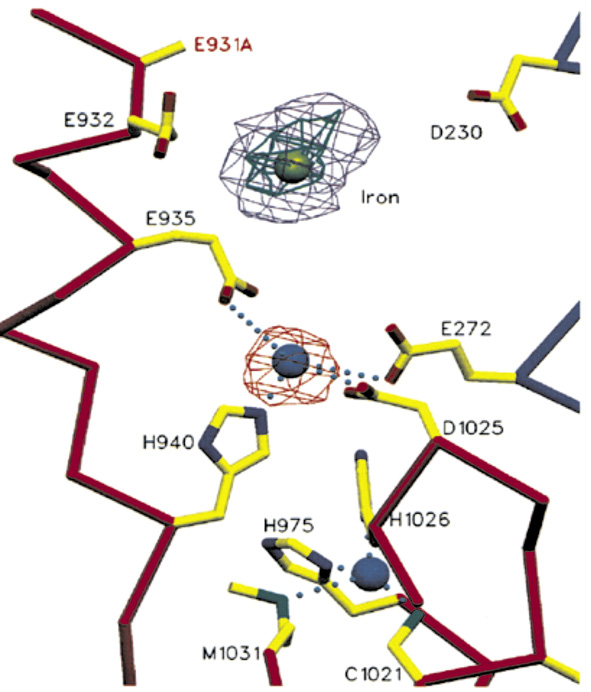
Рис. 1. Центры связывания ионов металлов в домене 6 церулоплазмина [9]. Лиганды центра
T1Cu (нижняя часть рисунка): Нis975, H1026, Cys1021 и Met1031; лиганды «labile» M2+-центра (средняя часть рисунка): His940, Glu935, Asp1025 и Glu272; лиганды «holding» М3+-центра (верхняя часть рисунка): Glu931, Glu932, Glu935 и Asp230
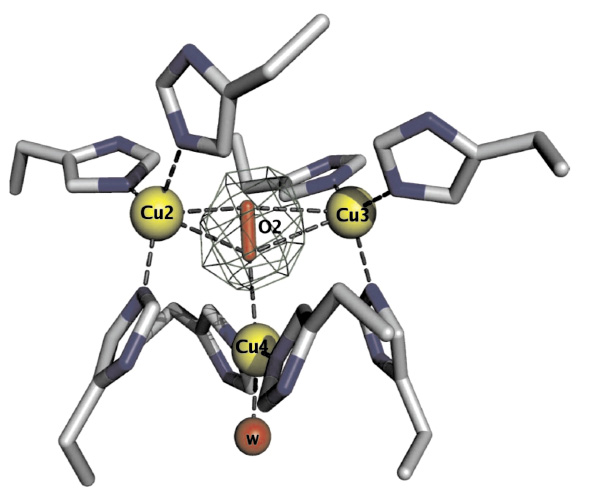
Рис. 2. Триядерный кластер в церулоплазмине между доменами 1 и 6 [1]. Лиганды иона
Cu2 в биядерном центре T2Cu: His163, His 980, His1020; лиганды иона Cu3 в биядерном центре T3Cu: His103, H161 и His1022; лиганды иона Cu4 в центре T2Cu: His101 и His978. Показаны также связи молекул О2 и воды (W148) c ионами Cu. Степень заполнения этого центра для молекулы Н2О и гидроксильной группы – 50 %
Опыты с вымачиванием кристаллов церулоплазмина в растворах, содержащих соли Fe, показали, что ионы Fe2+ замещают ионы Cu2+ в М2+-центре домена 6 и после окисления до Fe3+ меняют свое местоположение, переходя в т.наз. «holding» центр (М3+-центры по терминологии [11]). Максимумы на карте электронной плотности, соответствующие этим центрам, имеют диффузную природу, что может быть объяснено тем, что существует популяция этих центров, немного отличающихся по своей структуре. В них могут занимать позиции не только один, но, видимо, и два катиона. В домене 6 возможными лигандами М3+-центра служат остатки Glu931, Glu932, Glu935 и Asp230. В процессах транслокации из М2+- в М3+-центр домена 6 ключевую роль играет их общий остаток Glu935 [9].
Можно предположить, что именно ионы Fe3+, перемещенные в М3+-центры, которые, как установлено, находятся вблизи поверхности белковой глобулы, далее включаются в апо-форму Fe-транспортного белка, трансферрина. Возможный путь такого перемещения ионов Fe3+ будет рассмотрен далее более подробно.
Наиболее вероятные пути внутримолекулярного транспорта электронов можно описать следующим образом [11]:
1. Транспорт электрона, высвободившегося в результате реакции Fe2+ → Fe3+, из М2+-центра в центр Т1Cu (домен 6) на расстояние 8,9 Å происходит, вероятнее всего, от Glu272 на His1026. Не исключены и два альтернативных пути на тот же лиганд центра Т1Cu, His1026, – либо от Asp1025, либо от His940. Кинетические данные свидетельствуют против возможности прямого переноса электрона от М2+-центра на триядерный кластер.
2. Транспорт электрона от центра Т1Cu (домен 6) на биядерный центр Т3Сu (расстояние 12,5 Å) может быть описан последовательностью: Cys1021 → Val1023 → His1022. Транспорт электрона на лиганд второго иона Cu2+ биядерного центра, His1020, имеет почти те же кинетические характеристики.
3. Транспорт электрона от центра Т1Cu в домене 4 на такой же центр в домене 6 (расстояние 17,8 Å) может осуществляться тремя кинетически почти эквивалентными путями. Из них несколько более предпочтительными являются следующие два:
His685 → Glu971 → Ile972 → His1026;
His685 → Glu971 → Asn970 → Asp973 → His975.
4. Транспорт электрона на центр Т2Cu. В этом случае существуют две возможности. Первая – от лиганда биядерного центра Т3Cu, His980, непосредственно на His978 (расстояние 4,2 Å). Здесь не исключен путь от второго иона Cu2+ биядерного центра через гидроксидную группировку на первый ион Cu2+ и далее как описано выше. Вторая возможность – транспорт электрона от центра Т1Cu: Cys1021 → His1020 → His978 (расстояние 14,4 Å). Эти данные свидетельствуют, что восстановление иона Cu2+ в центре Т2Cu непосредственно связано с восстановлением пары ионов Cu2+ в биядерном центре.
Суммируя вышеизложенное, можно обосновать 7-стадийную схему внутримолекулярного электронного транспорта в молекуле церулоплазмина. Первые три стадии представляют собой реакции восстановления центров Т1Cu в доменах 4 и 6, сопряженные с переходом ионов Fe2+ в окисленное состояние, и быстрый внутримолекулярный перенос электрона между восстановленными и окисленными формами центров Т1Cu в доменах 4 и 6. Стадия 4 соответствует восстановлению двухэлектронного акцептора – биядерного центра T3Cu в результате последовательного переноса двух электронов – одного от ранее восстановленного центра T1Cu и еще одного от иона Fe2+ (промежуточным продуктом этого процесса является полувосстановленный интермедиат биядерного центра). Альтернативой стадии 4 служит стадия 5, в которой два электрона от восстановленных центров T1Cu доменов 4 и 6 последовательно переносятся на биядерный центр, однако стадия 5 несколько менее вероятна, чем стадия 4. Восстановление центра T2Cu может происходить двояко: либо путем переноса электрона от восстановленного центра T1Cu домена 6 (стадия 6), либо путем переноса двух электронов от восстановленного биядерного центра на центр T2Cu и на ранее окисленный центр T1Cu домена 6 (стадии 6 и 7).
Все эти результаты позволяют конкретизировать выдвинутую еще в 1966 г. гипотезу [12] о том, что одна из основных физиологических функций церулоплазмина заключается в окислении ионов Fe2+ и их последующем встраивании в апо-форму трансферрина. К настоящему времени накоплен значительный массив экспериментальных (хотя и косвенных) данных, свидетельствующих в пользу того, что церулоплазмин может образовывать белок-белковые аддукты с трансферрином и лактоферрином [16]. Что же касается конкретного пути транспорта окисленных ионов Fe3+ наружу из глобулы церулоплазмина, то в недавней работе [18], использующей цитируемые выше данные расшифровки кристаллической структуры этого белка, была построена молекулярная модель комплекса церулоплазмина с N-долей лактроферрина. Согласно этой модели, ион Fe3+ достигает белковой поверхности по цепочке остатков: M3+-центр (остатки Glu932 и Glu935) → Glu753 → Asp921 → Asp297, после чего становится способным включаться в комплекс с лактоферрином.
Рецензенты:
Кокряков В.Н., д.б.н., профессор, отдел общей патологии и патологической физиологии, НИИ экспериментальной медицины СЗО РАМН, г. Санкт-Петербург;
Трусов А.А., д.ф.-м.н., профессор, зав. кафедрой молекулярной биофизики, физический факультет, Санкт-Петербургский государственный университет, г. Санкт-Петербург.
Работа поступила в редакцию 31.01.2014.
Библиографическая ссылка
¹Мошков К.А., ²Зайцев В.Н., ¹Романовская Е.В., ¹Стефанов В.Е. ЦЕРУЛОПЛАЗМИН: ВНУТРИМОЛЕКУЛЯРНЫЙ ПЕРЕНОС ЭЛЕКТРОНОВ И ФЕРРОКСИДАЗНАЯ АКТИВНОСТЬ // Фундаментальные исследования. 2014. № 3-1. С. 104-108;URL: https://fundamental-research.ru/ru/article/view?id=33594 (дата обращения: 04.02.2026).



