По данным ВОЗ, ожоги, включая ожоги паром, в структуре травматизма занимают 3–4 % у взрослых и являются наиболее распространенными травмами у детей [18]. Актуальность проблемы ожогового травматизма определяется как медицинскими, так и социально-экономическими аспектами, которые обусловлены частотой ожогов и их последствиями: временной и стойкой утратой трудоспособности с переходом на инвалидность, а также высоким уровнем смертности от тяжёлых ожоговых травм [22]. Кроме этого, сильные ожоги оставляют, часто с последствиями на всю жизнь, рубцы, не только нарушающие внешний вид, но и функции [10].
Об актуальности и сложности изучения ожоговой болезни также свидетельствует тот факт, что даже на современном этапе единой международной классификации ожогов не существует. Важнейшим прогностическим показателем ожогов служит глубина поражения тканей. В разное время были предложены различные классификации ожогов в зависимости от глубины повреждения: Буайе (1814 г.) разработал трехступенчатую классификацию; Крейбих (1927 г.) предложил выделять пять степеней ожогов. Согласно аналитическим данным ВОЗ, в мире ежегодно получают травмы около 50 млн человек; более 100 млн подвергаются хирургическим вмешательствам [16]. По данным T. Alster (2003), келоидные и гипертрофические рубцы наблюдаются у 1,5–4,5 % общей популяции, а по результатам W. Chernoff (2007) – у 10 %. Более 4 миллионов человек страдают от рубцовых деформаций после глубоких и распространенных ожогов. Образование рубцов – нормальная функция поврежденных тканей, без которой не может существовать ни один живой организм. Рубцовая ткань не является идентичной той ткани, которую заменяет, и обладает более низкими функциональными свойствами. Необходимость предотвращения избыточного рубцеобразования после хирургических вмешательств, травм и т.д. является актуальной научно-практической задачей. Несмотря на постоянное совершенствование методов лечения термотравм и тактики послеоперационного ведения больных, образование грубых деформирующих рубцов составляет одну из серьезных проблем современной медицины [13]. Рубцы сохраняются пожизненно. Возникающие косметические и функциональные дефекты доставляют психологический дискомфорт пациенту, нарушая социальную адаптацию человека после травм и операций, и значительно влияют на качество жизни.
Несмотря на широкое обсуждение на страницах отечественной и зарубежной печати вопросов патогенеза, диагностики и лечения патологического рубцевания после операций и травм, мнения специалистов и ученых остаются крайне противоречивыми в определении единых подходов к профилактике и лечению рубцующейся ткани [3]. Диагностика патологических рубцов не представляет больших трудностей и базируется на анамнестических данных и клинических проявлениях. Lucas T, Waisman A, Ranjan R, et al., (2012) считают, что большинство описанных методов лечения и профилактики избыточного роста соединительной ткани у пациентов, у которых сформировались келоидные и гипертрофические рубцы, не основаны на глубоких представлениях о патогенетических аспектах репаративной регенерации кожи человека [10].
Между тем до настоящего времени нет таких методов лечения, которые надежно остановили бы прогрессирование патологического рубца и его рецидив после хирургического лечения. Причиной этого является недостаточная изученность процесса репаративной регенерации кожи как после ожога, так и оперативных вмешательств на коже, что диктует более глубокое изучение механизмов заживления ран кожи. До сих пор неясна роль иммунокомпетентных клеток в процессах регенерации в ожоговой ране, что не позволяет разрабатывать патогенетически обоснованное иммуномоделирование репаративных процессов при ожогах [5].
Одними из наиболее важных иммунных клеток, участвующих в воспалении и заживлении ран, являются макрофаги, которые определяют различные иммунологические процессы в коже, в том числе фагоцитоз и антигенпрезентацию. Кроме того, макрофаги производят многие цитокины и хемокины, которые стимулируют рост новых капилляров, синтез коллагена [1]. Эти представители иммунокомпетентных клеток считаются главными регуляторами воспаления и ангиогенеза, реэпителизации, заживления, а также реконструкции [12].Установлено, что лимфоциты эпидермиса выполняют функцию регуляторов пролиферативной активности кератиноцитов. Усиление активности Т-лимфоцитов в коже является одним из факторов, стимулирующих вторичную пролиферативную активность эпидермальных кератиноцитов через общие клеточные механизмы, включающие цитокины – интерлейкины (ИЛ) 1, 2, 6, 8, ФНО и др., а также факторы роста.
Главный вопрос, таким образом, касается функции различных макрофагальных типов в гомеостазе, инфекционном процессе и сценарии восстановления обожжённой кожи. Кроме того, экстраполяция результатов, полученных на примере ожогов в эксперименте на крысах, считается невозможной, как и корреляции между мышиными и человеческими макрофагами, а данные об их подтипах отсутствуют и являются серьезным препятствием для понимания иммунитета кожи человека [8, 14, 17].
Для патогенетически обоснованной активации эффекторного иммунофагоцитарного звена, правильной корреляция регенераторных процессов в зоне ожоговой раны и профилактики формирования грубых рубцов, необходимо изучение тонких механизмов регуляции и индукции иммуно моделированной репаративной регенерации в коже человека.
Целью исследования является повышение эффективности лечения больных с тяжёлыми ожогами на основе данных иммунологического мониторинга ожоговой раны в процессе заживления.
Соответственно цели были поставлены следующие задачи:
1. Получить клиническую оценку процесса заживления ожоговых ран.
2. Изучить диффероны иммуноцитов в динамике репаративных процессов в ожоговой ране: антигенпрезентирующие CD68, моноциты-макрофаги CD163 и Т4–T8 лимфоциты.
3. Установить роль иммуноцитов в репаративной регенерации кожи после термотравмы.
Материалы и методы исследований
В работе проанализирован материал кожи 145 пациентов мужского пола, получивших глубокие термические ожоги, различных возрастных групп и без соматической патологии в возрасте от 12 до 67 лет в период с 2002 по 2013 год. Группу контроля составили 28 пациентов (включая детей) в возрасте от 7 до 57 лет. Биопсийный материал фиксировался по прописи для подготовки к иммуногистохимическим исследованиям сразу после забора. Группа физиологического контроля включала цельные биоптаты кожи, полученные путем иссечения кожи боковой части живота при операциях у лиц без видимого поражения кожного покрова. Репаративные процессы в зоне термотравмы изучены от момента поступления пациента в клинику и до завершения лечения (рис. 1, а). Мониторинг проводился в одно и то же время утром в 10.00, чтобы избежать влияния суточных циркадных ритмов и только у лиц мужского пола, чтобы исключить влияние эстрогенов на пролиферативные процессы в коже пациентов. Использованы классические гистологические методы исследования с окрашиванием г/э; Victoria blu, а также иммуногистохимические методы на выявление CD4, CD8, CD 68, CD163, CD 204, TUNEL-метод на выявление апоптозирующих клеток, Ki67 для выявления пролиферативной активности, Iron hematoxilin. Анализ материала проведён с помощью микроскопа Olympus – Bx82 и цифровой камеры CDх82 с фирменным программным обеспечением.
Результаты исследований и их обсуждение
Установлено, что в процессе регенерации в ожоговой ране пролиферативная активность гена Ki67 в структурах эпидермиса и дермы нарастает до 7–10 дня после получения термотравмы, сохраняется на достигнутом уровне до 14 дня, а затем достоверно снижается до значений, соответствующих регенераторному потенциалу в первые часы при поступлении (рис. 1, б–д).
Нами отмечено, что в процессе заживления ожоговой раны на этапе гнойно-некротической фазы наблюдалась высокая степень бактериальной загрязнённости, отёчность тканей, гиперемия области раны. Иммунологический мониторинг показал, что преобладающей формой эффекторных иммуноцитов в ожоговой ране был нейтрофильный клеточный пул (рис. 2, а), что обеспечивает активное противостояние бактериальной флоры и иммунной системы. Это связано с тем, что в первой фазе заживления ожоговой раны идёт адаптация к новым физиологическим условиям функционирования поверхности повреждённой кожи, необходимости подавления первичной агрессивной микрофлоры и предотвращения дальнейшего инфицирования раны. В следующую фазу – фазу грануляции, когда должна быть обеспечена очистка раны от гнойно-некротических масс, уменьшение и исчезновение отёков, подавление бактериальной агрессии, в инфильтрате на раневой поверхности и в глубине дермы преобладают антигенпредставляющие клетки, которые обеспечивают адекватный иммунный ответ на повреждение (рис. 2, б–г). Одновременно в соответствующей динамике идентифицируются лимфоциты с рецепторами CD4 (рис. 3). Известно, что рецепторы СD4 экспрессируются преимущественно на Т-лимфоцитах и, будучи комплементарными HLA-антигенам II класса, обеспечивают контакт Т-клеток с макрофагально-гистиоцитарным микроокружением, на клетках которого экспрессируются HLA II класса [6]. Взаимодействие CD4 с HLA II класса в ходе межклеточных контактов способствует ассоциации CD4 и Т-клеточного рецептора в единый комплекс и последующей активации пролиферативного и секреторного ответа Т-клеток [7, 11].
В целом нами отмечено, что в процессе заживления ожоговой раны наблюдается периваскулярное разрежение Т-клеток по сравнению с нормальной здоровой кожей. Существует заметная активация и проникновение в зону раневой поверхности клеток памяти T CD4+ в первый период воспаления после ожога. Также увеличивается количество антиген представляющих клеток (например, клетки Лангерганса (LCs), воспалительные дендритные клетки эпидермиса (IDEC) и макрофаги. Наблюдается дегрануляция тучных клеток. Регенераторный процесс в коже после ожога сопровождается её поражением и ремоделированием, вызванным хроническим воспалением. Эти изменения кожи связаны с утолщением и увеличением осаждения коллагена в дерме.
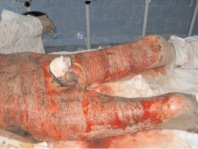 б
б 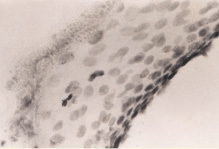
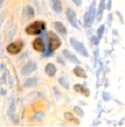 г
г 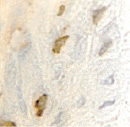 д
д 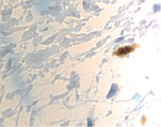
Рис. 1. а – ожоговый больной 14 лет (обширные ожоги 3б степени); б–д – Ki67 в эпидермисе (б, в, г) и дерме (д) кожи человека в зоне ожоговой раны; б – 7-е сутки после термотравмы; в – 10-е сутки после термотравмы; г – 12 сутки; б–д – иммунная гистохимия. Микрофото. Ув.: б – х400; в–д – х800
В фазу эпителизации происходит восстановление кожного покрова с формированием рубца, окончательное заживление раны. Поэтому в зоне ожоговой раны и подлежащей верхним слоям соединительной ткани появляются клетки, отвечающие за реструктуризацию кожного покрова. Мониторинг показал, что на этом этапе идентифицируются CD8 и CD163 макрофаги, фибробласты, тучные клетки (рис. 5). Поскльку в третьей фазе следует обеспечить максимальную защиту раны от внешних воздействий, чтобы способствовать полноценной регенерации, появляются CD8+-лимфоциты, которые продуцируют те же цитокины, что и CD4+-Тх1 (ФНО-альфа и бета, ИЛ-2,3, гамма-ИФ, ГМ-КСФ). Эти иммуноциты ограничивают иммунный ответ, предотвращая реакции гиперчувствительности ИС и запуск аутоиммунных процессов.
Полученные нами данные являются результатом того, что в стадию ожоговой токсемии в результате активации парасимпатической системы происходит расширение концевых артериол и начинается перфузия крови по капиллярному руслу и миграция эффекторных клеток иммунофагоцитарного звена в повреждённую ткань. Но одновременно с этим начинается массивный выход в кровеносное русло продуктов распада некротических тканей из зоны термического поражения. Это вызывает явления эндотоксикоза, что негативно влияет как на саму сосудистую стенку капилляров и артериол, так и на ее проницаемость. В результате этого количество функционирующих капилляров хоть и выше, чем в стадию ожогового шока, но тем не менее значительно ниже нормальных значений.
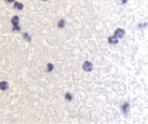 б
б 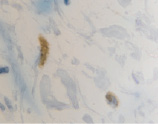
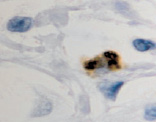 г
г 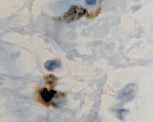
Рис. 2. CD 68 в дерме кожи человека в зоне ожоговой раны: а – 1-е сутки после термотравмы; б – 2-е сутки после термотравмы; в – 7 сутки; г – 10 сутки; а – гематоксилин-эозин; б–г – иммунная гистохимия. Микрофото. Ув. х800
а 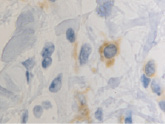 б
б 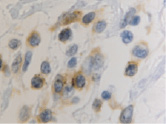
Рис. 3. CD4 в дерме кожи человека в зоне ожоговой раны: а – 4-е сутки после термотравмы; б – 7-е сутки после термотравмы. Иммунная гистохимия. Микрофото. Ув. х800
а 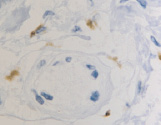 б
б 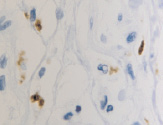
Рис. 4. CD8 в дерме кожи человека в зоне ожоговой раны: а – 4-е сутки после термотравмы; б – 7-е сутки после термотравмы. Иммунная гистохимия. Микрофото. Ув. х800
а 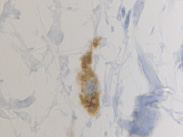 б
б 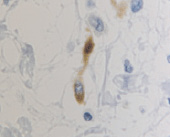
Рис. 5. CD204 в дерме кожи человека в зоне ожоговой раны: а – 4-е сутки после термотравмы; б – 7-е сутки после термотравмы. Иммунная гистохимия. Микрофото. Ув. х800
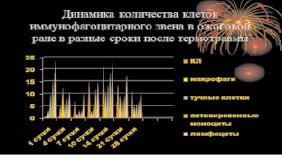
Рис. 6. Диаграмма. Характеристика иммунного гомеостаза кожи в динамике заживления ожоговой раны
Заключение
Данные, полученные в поздние стадии ожоговой болезни, свидетельствуют, что пациенты, перенесшие тяжелую термическую травму, не могут считаться выздоровевшими даже после выписки из стационара, что согласуется с данными других авторов [19, 20]. Продолжается угнетение T-клеточного звена, клеток Лангерганса, а также снижена кооперация между T- и B-лимфоцитами в коже больных после ожоговой травмы [21]. Причина этого – серьезные нарушения иммунной системы в острый период травмы, которые приводят к значительным морфофункциональным изменениям в тканях и органах пострадавших. Интегральные изменения в МЦР как показатели состояния организма в целом также отличаются от показателей организма практически здоровых людей. Клетки Лангерганса играют ключевую роль в афферентном звене иммунного ответа и осуществляют макрофагально-Т-клеточное взаимодействие, в частности, представление растворимых белков и гаптенов сенсибилизированным Т-лимфоцитам, стимулирование аллогенных Т-лимфоцитов в смешанной эпидермально-лимфоцитарной системе, индуцирование цитотоксических лимфоцитов, кооперацию Т- и В-лимфоцитов, а также участие в регулировании роста и дифференцировке эпидермальных клеток [2, 9]. Присутствие клеток Лангерганса способствует отторжению аллогенного трансплантата [4]. Однако сложный механизм сохранения гомеостатических процессов в ткани не только зависит от пролиферации и дифференцировки клеток, но и ассоциирован с характером их запрограммированной гибели – апоптозом [15]. Пути реализации программы апоптоза разнообразны, зависят как от индивидуальных особенностей клеток, так и от характера и степени выраженности внешних и внутренних воздействий, вызывающих ее включение [16]. Имеются единичные сообщения, позволяющие предполагать, что в формировании келоидных рубцов и развитии склеродермических изменений кожи задействованы механизмы апоптоза. Апоптоз и некроз приводят к селективной убыли определенных клеточных популяций дермы (прежде всего эндотелия), участвуя в формировании аваскулярного коллагена, характерного для рубцевания и келоида.
Выводы
Тяжелообожжённым показана ранняя некрэктомия до значительного ослабления защитных сил организма.
Высокая пролиферативная активность структур дермы в зоне термотравмы и эпидермиса неповреждённой кожи отмечается от 7 до 10 дня после получения термотравмы.
Наиболее высокая пролиферативная активность клеточных элементов наблюдается в области краевой эпителизации раны.
Повышение АПК в ожоговой ране нарастает до 14 дней после термотравмы и снижается с 14 дня.
В аутодермотрансплантатах, пересаженных в сроки до 7-х суток после термической травмы, можно прогнозировать превалирование регенераторных процессов над деструктивными. В аутодермотрансплантатах, пересаженных в сроки после 7-х суток, можно прогнозировать превалирование деструктивных процессов. Высокая пролиферативная активность во всех структурах кожи в зоне термотравмы, в интактной коже и на границе повреждённой и интактной кожи отмечается в сроки до 7 дней после ожоговой травмы.
Иммунологический мониторинг свидетельствует, что при ранней хирургической тактике экономический эффект будет выше вследствие значительного сокращения сроков лечения больных в стационаре, снижения прямых и непрямых расходов на лечение на 10 %.
Рецензенты:
Храмова И.А., д.м.н., профессор, врач акушер-гинеколог, Приморский краевой диагностический центр, г. Владивосток;
Шульгина Л.В., д.б.н., профессор, заведующая лабораторией микробиологии, ФГУП «ТИНРО-Центр», г. Владивосток.
Работа поступила в редакцию 15.08.2013.Библиографическая ссылка
Рева И.В., Рева И.В., Рева Г.В., Ямамото Т., Ямамото Т., Новиков А.С., Маломан Н.Ю., Гиря О.Ю., Лемешко Т.Н., Терехов С.М., Даниленко М.В., Недобыльская Ю.П., Усов В.В., Митряшов К.В., Мартыненко Е.Е. ВЗАИМОДЕЙСТВИЕ ИММУНОЦИТОВ В РЕПАРАТИВНОЙ РЕГЕНЕРАЦИИ КОЖИ // Фундаментальные исследования. 2013. № 9-3. С. 453-459;URL: https://fundamental-research.ru/ru/article/view?id=32373 (дата обращения: 14.01.2026).



