Метанол относится к числу основных крупнотоннажных продуктов химической промышленности. На его основе вырабатывается большое количество важных химических соединений: органические химикаты, синтетические смолы и пластмассы, волокна, пестициды, фармацевтические препараты, метилтретбутиловый и тетраэтиламиловый эфиры, используемые в качестве октаноповышающих добавок.
Составление схемы превращения и кинетической модели процесса является важным этапом не только математического моделирования реакционного процесса, но и сами по себе при правильной обработке результатов дают ценную информацию априори, без масштабных переходов. Все выражения для скоростей реакций в синтезе метанола основаны на учете этапа адсорбции веществ на поверхности катализатора и потому имеют соответствующий вид.
Считается, что в синтезе имеют место следующие реакции:
СО + 2Н2 = СН3ОН; (1)
СО2 + 3H2 = СН3ОН + H2O; (2)
СО2 + H2 = CO+H2O; (3)
CH3OH + CH3OH = CH3OCH3; (4)
СО + 3Н2 = СН4 + Н2О. (5)
Различные исследователи механизма синтеза периодически включают или исключают при рассмотрении реакции (4) и (5). Реакции (1)–(3) считаются идущими повсеместно на всех типах катализаторов.
Основным вопросом при составлении кинетических моделей процесса во второй половине XX века являлась роль СО2 в процессе синтеза. Большинство разработанных моделей основаны на том, что образование молекулы метанола происходит из СО, а СО2 адсорбируется на поверхности катализатора, изменяя структуру активного центра или участвует в синтезе только в реакции паровой конверсии.
Одной из первых представленных кинетических моделей была модель Клиера (1982 г.) [6], основанная на представлении о вкладе в синтез метанола реакций (1) и (2), идущих параллельно. Уравнение скорости целевой реакции в этой модели имеет следующий вид:
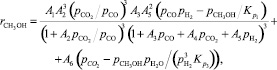 (6)
(6)
где Аi – константа скорости, с–1; рi – парциальное давление компонента, МПа; Кр – константа равновесия.
В 1985 г. Сайферт и Луфт [9] представили свою кинетическую модель синтеза метанола, основанную на подходе Ленгмюра‒Хиншелвуда, согласно которому Н2 и СО адсорбируются на поверхности катализатора, не диссоциируя и взаимодействуя между собой, образуют молекулу метанола. Согласно этой модели, метанол образуется в 2 стадии: на первом этапе происходит образование формальдегида, на втором этапе происходит взаимодействие адсорбированной молекулы формальдегида с водородом с отщеплением молекулы метанола:
СО + Н2 = НСОН; (7)
НСОН + Н2 = СН3ОН. (8)
Кинетическое уравнение целевой реакции в этом случае имеет следующий вид:
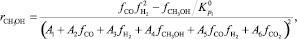 (9)
(9)
где Аi – константа скорости, с–1; fi – парциальная фугитивность компонента, МПа; Кр – константа равновесия.
Модель Вилла [10] также основана на подходе Ленгмюра‒Хиншелвуда, но учитывает взаимодействие адсорбированной молекулы СО и двух молекул водорода. Уравнение скорости целевой реакции в этой модели имеет следующий вид:
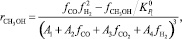 (10)
(10)
где Аi – константа скорости, с–1; fi – парциальная фугитивность компонента, МПа; Кр – константа равновесия.
Отечественными учеными также было разработано несколько кинетических моделей синтеза метанола. Первая из них, модель М.М. Караваева, применялась для описания синтеза метанола на цинк-хромовых катализаторах и выведенная из предположения, что синтез идет из СО, а лимитирующая стадия – адсорбция водорода, имеет следующий вид [1]:
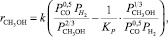 (11)
(11)
где Кi – константа скорости, с–1; рi – парциальное давление компонента, МПа.
Ф.С. Шуб, М.И. Темкин по итогам кинетических исследований синтеза предложили следующее выражение для целевой реакции [2]:
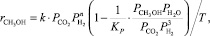 (12)
(12)
где Кi – константа скорости, с–1; рi – парциальное давление компонента, МПа.
В основу модели А.Я. Розовского [3] положены представления, что синтез идет из СО2, а СО вовлекается в синтез по реакции конверсии. Первая стадия синтеза – «ударное» замещение прочно хемосорбированной воды молекулами СО2:
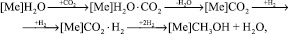
где [Me] – металлический центр на поверхности катализатора.
Предполагалось, что синтез сильно тормозится водой и протекает на каталитических центрах одной природы. Уравнение реакции синтеза метанола имеет вид:
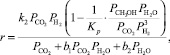 (13)
(13)
а реакции конверсии CO2 в CO:
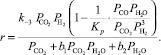 (14)
(14)
где Кi – константа скорости, с–1; рi – парциальное давление компонента, МПа.
Практически все представленные виды кинетических уравнений говорят о том, что синтез метанола описывается кинетическими уравнениями первого порядка. Исключение лишь составляет модель, обобщенная Ф.С. Шуба и М.И. Темкина, в которой авторами порядок реакций не указывается.
Наиболее распространенной в настоящее время можно считать модель Граафа [5]. В основе разработанной модели лежит представление о том, что метанол образуется одновременно и из СО, и из СО2. Реакция образования метанола из СО проходит в 4 стадии с образованием положительно заряженного хемосорбированного комплекса:
СОs1 + Нs2 = HCOs1 + s2;
HCOs1 + Нs2 = H2COs1 + s2;
H2COs1 + Нs2 = H3COs1 + s2;
H3COs1 + Нs2 = CH3OH + s1 + s2,
где s1 и s2 – активные центры катализатора.
Реакция образования метанола из СО2 происходит в 6 стадий с отщеплением воды на 3 стадии:
СО2s1 + Нs2 = HCO2s1 + s2;
HCO2s1 + Нs2 = H2CO2s1 + s2;
H2CO2s1 + Нs2 = H3CO2s1 + s2;
H3CO2s1 + Нs2 = H2COs1 + Н2Оs2;
H2COs1 + Нs2 = H3COs1 + s2;
H3COs1 + Нs2 = CH3OH + s1 + s2,
где s1 и s2 – активные центры катализатора.
Уравнения скоростей реакций в этом случае имеют следующий вид:
Реакция (1):
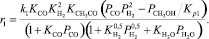 (15)
(15)
Реакция (2):
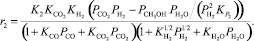 (16)
(16)
Реакция (3):
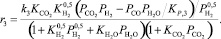 (17)
(17)
Реакция (4):
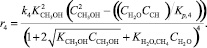 (18)
(18)
где ri – скорость реакции, моль/с; ki – константа скорости соответствующей реакции, с–1; Ki – константа равновесия процесса адсорбции i-го вещества; KP,j – константа равновесия j-й реакции; Pi – парциальное давление соответствующего компонента, МПа; Сi – концентрация соответствующего компонента, % моль.
Константы равновесия адсорбции компонентов и константы равновесия реакций достаточно точно определены в [4, 7–8].
С использованием данной кинетической модели была составлена математическая модель для расчета работы установки низкотемпературного синтеза метанола типа М-750. Результаты расчета одного из вариантов состава сырья и технологических параметров, имевших место в реальной промышленной практике, приведены в таблице.
Как видно, в целом абсолютная погрешность модели не превышает 0,9 %. Аналогичные результаты модель, в основу которой положена кинетика Граафа, демонстрирует и для других исходных данных. Таким образом, результаты моделирования работы катализаторов серий Catalco современного поколения показывают достаточную точность и использование это кинетической модели может быть рекомендовано для случаев исследования низкотемпературного синтеза.
Сравнение проектных и расчетных концентраций веществ на выходе из реактора синтеза метанола (концентрации веществ в % об.)
|
Технологический поток |
СО |
СО2 |
Н2 |
СН4 |
N2 |
СН3ОН |
Н2О |
|
|
Промышленные данные |
Вход на 1 слой |
3,069 |
2,000 |
82,483 |
10,967 |
0,917 |
0,475 |
0,077 |
|
Моделирующий расчет |
Выход с 1 слоя |
1,695 |
1,298 |
80,879 |
11,474 |
0,959 |
2,807 |
0,875 |
|
Вход на 2 слой |
2,083 |
1,496 |
81,332 |
11,331 |
0,947 |
2,148 |
0,650 |
|
|
Выход со 2 слоя |
1,065 |
1,127 |
80,361 |
11,669 |
0,975 |
3,705 |
1,083 |
|
|
Вход на 3 слой |
1,569 |
1,346 |
80,894 |
11,493 |
0,960 |
2,893 |
0,830 |
|
|
Выход с 3 слоя |
0,543 |
0,908 |
79,821 |
11,851 |
0,990 |
4,538 |
1,336 |
|
|
Вход на 4 слой |
1,076 |
1,138 |
80,382 |
11,665 |
0,975 |
3,681 |
1,070 |
|
|
Выход с 4 слоя |
0,321 |
0,724 |
79,461 |
11,950 |
0,999 |
4,994 |
1,538 |
|
|
Промышленные данные |
Выход с 4 слоя |
0,410 |
0,706 |
79,472 |
11,932 |
0,998 |
4,898 |
1,565 |
Работа выполнена в рамках государственного задания «Наука» по теме 3.2702.2011.
Рецензенты:
Короткова Е.И., д.х.н., профессор кафедры физической и аналитической химии, заместитель директора по научной работе и инновационному развитию Института природных ресурсов, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск;
Ивашкина Е.Н., д.х.н., доцент кафедры химической технологии топлива и химической кибернетики, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.
Работа поступила в редакцию 01.07.2013.
Библиографическая ссылка
Юрьев Е.М., Попок Е.В. КИНЕТИЧЕСКИЕ МОДЕЛИ СИНТЕЗА МЕТАНОЛА // Фундаментальные исследования. 2013. № 8-3. С. 779-782;URL: https://fundamental-research.ru/ru/article/view?id=32000 (дата обращения: 01.03.2026).



