Серологические методы наиболее удобны для диагностики инфекционных болезней, так как для анализа используется легко доступный клинический материал: сыворотка или плазма крови человека. Однако эти методы, включая метод ИФА, не обладают достаточной чувствительностью для диагностики туберкулеза [2]. Так, при использовании препарата, выделенного из клеточных стенок микобактерий H37Rv и содержащего антиген с молекулярной массой 38–42 кДа, противотуберкулезные антитела (ПТАТ) были выявлены только у 76,7 % больных туберкулемой и у 70,0 % больных инфильтративным туберкулезом [1]. При использовании антигенного комплекса с молекулярной массой 45–47 кДа чувствительность метода составила 40 % [5]. На использованных в недавнем прошлом антигенных препаратах у лиц с установленным диагнозом туберкулез противотуберкулезные антитела (ПТАТ) обнаруживаются в 100 % случаях только при фиброзно-кавернозном туберкулезе и при бактериовыделении [3]. Однако пациенты с фиброзно-кавернозной формой заболевания составляют небольшую часть общего количества больных туберкулезом. При очаговом туберкулезе ПТАТ обнаруживают только в 31 % случаев, а при туберкулезе бронхов − в 15,5 % случаев [3]. По данным Чуканова В.И. и соавт. ПТАТ выявляют у больных туберкулезом в среднем в 71 % случаев [4].
При использовании отдельных рекомбинантных антигенов Mycobacterium tuberculosis выявляемость ПТАТ в сыворотках больных туберкулезом за исключением ВИЧ-инфицированных пациентов также невысока − около 60 % [8]. Есть данные, что использование набора значительного количества рекомбинантных антигенов приводит к улучшению результата: ПТАТ выявляли у 93 % больных туберкулезом [6,11].
Цель настоящей работы заключалась в получении антигенного препарата из Mycobacterium tuberculosis, который отличался бы высокой активностью и специфичностью.
Материалы и методы исследования
Культуру Mycobacterium tuberculosis штамм «Академия», выращивали на твердой питательной среде Левенштейна-Йенсена в течение 40–60 дней, затем переносили в жидкую питательную среду Сотона. Наращивание бактериальной массы в последней проводили в аппарате «Bacteck» при 37 °С в течение 7–10 суток.
Антигенный препараты из Mycobacterium tuberculosis получали обработкой бактериальных клеток 10 % диметилсульфоксидом (ДМСО) с последующей дезинтеграцией стеклянными шариками в гемогенизаторе.
Белковые фракции исходного, промежуточного и конечного препаратов выявляли с помощью электрофореза в 12,5 % полиакриламидном геле (ПААГ) по Леммли [7].
Для определения молекулярной массы антигенов использовали набор белков «Broad Range» (BIO-RAD).
Гель-фильтрацию выполняли на колонках размером 2×100 см, заполненных соответственно сефадексами G-200.
Полученные антигенные препараты анализировали с помощью иммуноблотинга [10]. Иммуноблотинг выполняли по методике, описанной в инструкции к набору «NEW LAV BLOT 1» (BIO-RAD).
Результаты исследования и их обсуждение
Бактериальные клетки, выращенные на среде Сотона, осаждали центрифугированием в течение 30 минут при 8000 g и трижды промывали фосфатным буфером (рН 7,4) с 0,15 М NaCl. Клетки суспендировали в 10 % водном растворе ДМСО и в течение 30 минут гомогенизировали. Гомогенат подвергали исчерпывающему диализу против дистиллированной воды в течение ночи против 0,05 М трис-НCl буфера с рН 7,4–7,6. Центрифугированием в течение 30 минут при 8000 g освобождались от обломков клеток. Полученный ДМСО-экстракт служил в дальнейшим исходным материалом для получения антигенных препаратов из Mycobacterium tuberculosis.
Для выделения антигенных фракций ДМСО-экстракты использовали различные подходы: экстракция растворителями при различных значениях рН, высаливание, а также метод гель-фильтрации.
На первом этапе очистки рН ДМСО-экстракта доводили до значения 3,5–4,0 уксусной кислотой и выдерживали в течение 24 часов при температуре 4 °С. Образовавшийся осадок отделяли центрифугированием при 8000 g в течение 20 минут. Осадок растворяли 0,05 М трис-НCl (рН 7,4–7,6) в 1/2 первоначального объема, ДМСО-экстракта рН доводили 2 М раствором NaOH до значения 7,4–7,6.
Способы получение антигенных препаратов Mycobacterium tuberculosis
|
Препараты |
Способы фракционирования |
|
А |
Осадок ДМСО-экстракта после обработки уксусной кислотой (3,5–4,0) |
|
Б |
Супернатант из (А) |
|
В |
Препарат (А) + 30 % этанола |
|
Г |
Препарат (Б) после доведения до pH-4,0 |
|
Д |
Препарат (в) + 70 % этанола |
|
Е |
Препарат (в) + (NH4)2SO4 |
Иммуноблоты, полученные на материале осадка и супернатанта, представлены на рис. 1 (а и б соответственно). Их анализ показывает, что спектры серопозитивных фракций осадка и супернатанта мало чем отличаются между собой. В тоже время легко заметить индивидуальные различия в спектрах серопозитивных фракций, которые проявляются с сыворотками 4 больных туберкулезом. Наибольшая вариабельность по серологической активности наблюдается для белков, имеющих молекулярные массы 11–13,5; 15,5–22; 24,5–30 и 53 кДа. Что касается белков с молекулярной массой 45 кДа, то антиген к ним встречается во всех исследуемых сыворотках. Следует отметить, что белки с молекулярной массой 45 кДа более полно представлены в препаратах, полученных на основе супернатантов.
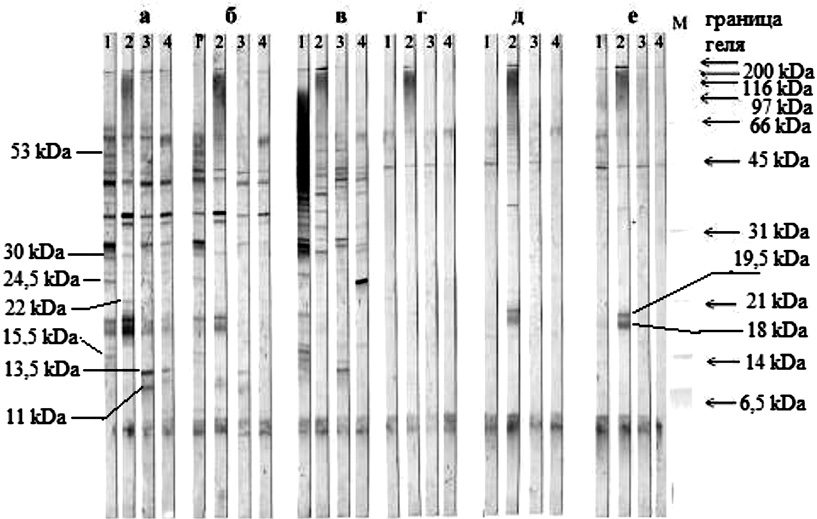
Рис. 1. Иммуноблотинги антигенных препаратов Mycobacterium tuberculosis, полученных разными способами, с сыворотками больных туберкулезом
Поэтому было проведено дополнительное осаждение супернатанта 30 % этанолом. Из рис. 1, в видно полученные в результате осаждения этанола белки обладали выраженной серологической активностью. Обращает внимание тот факт, что сыворотка пациента № 1 весьма активно реагирует с фракциями в диапазоне М.м. 31 – 200 кДа, а сыворотка больного № 4 с белками мажорной фракции с М.М. 24,5 кДа.
Анализ антигенного спектра препарата Г свидетельствует о том, что большая доля серологической активности приходится на белки с низкой массой 6,5 кДа и на белки с молекулярной массой более 45 кДа.
В препаратах Д, полученных из того же супернатанта при внесении в него 70 % этанола, спектр серопозитивных фракций мало отличался от антигенного спектра препарата Г. Исключение представлял спектр серопозитивных фракций пациента № 2. В его сыворотке присутствуют антитела, с которыми активно реагируют белки, имеющие молекулярную массу 18 и 19,5 кДа. Дополнительное осаждение сульфатом аммония не повлияло на антигенное состояние препарата.
Ввиду своеобразного распределения активности, которая в основном располагалась в области молекулярных масс более 45 кДа и менее 1 кДа, для дальнейшей очистки использовали метод гель-фильтрации.
Гель-фильтрацию сульфат-аммонийного осадка проводили на колонках 2×100 см с сефадексами G-200. Материал элюировался двумя пиками.
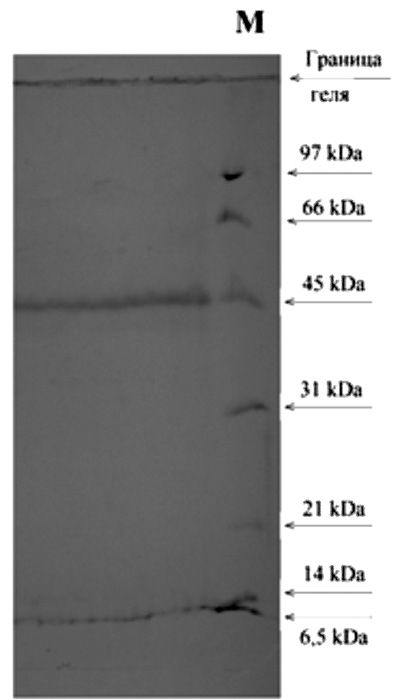
Рис. 2. Электрофорез антигенного препарата в 12,5 % ПААГ (по Леммли). Локализацию белковых фракций выявляли, используя краситель Кумасси ярко-голубой G-250
На рис. 2 представлена электрофореграмма материала 1 пика, которая свидетельствует о достаточной однородности препарата. Следует отметить, что при окрашивании белков, фракционированных в геле, азотнокислым серебром обнаруживаются минорные фракции, на долю которых приходится менее 5 % от общего количества белка.
На рис. 3 представлены иммуноблоты, полученные на материале первого пика с 24 сыворотками пациентов больных туберкулезом легких. Видно, что на всех иммуноблотах весьма четко представлена одна серопозитивная фракция с молекулярной массой в 45 кДа.
Следует отметить, что в этом эксперименте использовали произвольно взятые сыворотки пациентов больных легочной формой туберкулеза. Данный результат предполагает, что на полученном антигене проявляется 100 % чувствительность, что вызывает определенные сомнения. По литературным данным известно, что 100 % противотуберкулезные антитела (ПТАТ) выявляются только при фиброзно-кавернозном туберкулезе и при бактериовыделении [10], во всех остальных формах туберкулеза процент выявляемости ПТАТ был значительно ниже.
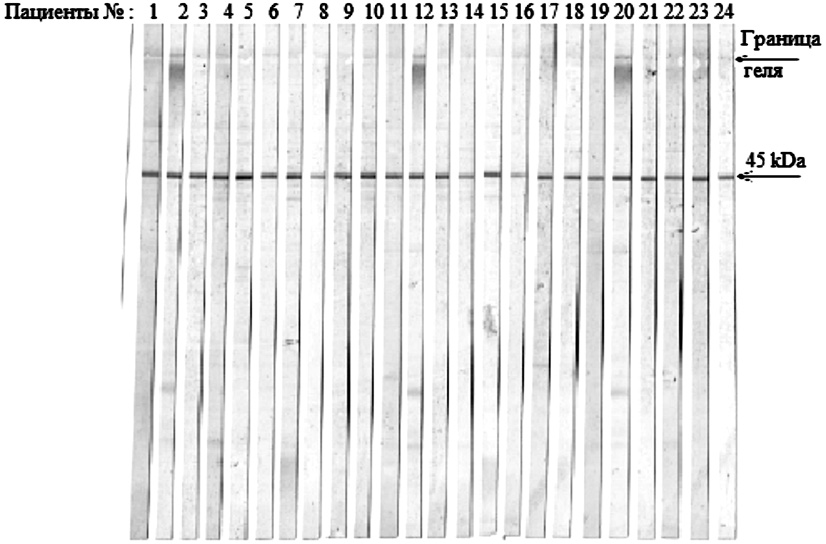
Рис. 3. Иммуноблоты, полученные на антигене 45 кДа с 24 сыворотками больных туберкулезом легких
Таким образом, в результате проведенной работы из клеток M. tuberculosis был получен антигенный препарат с молекулярной массой 45 кДа, который содержит менее 5 % балластных белков. Предположительно этот антиген представляет собой гликопротеин, локализованный на поверхности бактериальной клетки. Данное предположение основывается на щадящем приеме обработки бактериальных клеток (10 % водный раствор-ДМСО) и на сходстве молекулярных масс 45–47 кДа антигенного комплекса, описанного в статьях [5, 9].
Вывод
Предложен способ выделения серологических активных антигенных с молекулярной массой 45 кДа из M. tuberculosis штамм «Академия» включают обработку клеток 10 % раствором ДМСО с осаждением и фракционированием супернатанта уксусной кислотой, этанолом и хромотографией на сефадефа g-200
Белок с молекулярной массой 45 кДа обладал выраженной серологической активностью в реакциях иммуноблотинга сыворотками больных с установленным диагнозом туберкулеза.
Рецензенты:
Ильинская О.Н., д.б.н., профессор кафедры биохимии Института фундаментальной медицины и биологии ФГАОУ ВПО «Казанский (Приволжский) федеральный университет», г. Казань;
Коксин В.П., д.х.н., старший научный сотрудник лаборатории Республиканского центра по профилактике и борьбе со СПИД и инфекционными заболеваниями, г. Казань.
Работа поступила в редакцию 26.11.2012.
Библиографическая ссылка
Алфредо Элдер, Вершинина В.И., Хаертынов К.С., Герасимова С.В., Уразов Н.Г., Хаертынова И.М. Способ получения антигена с молекулярной массой 45 кДа из Mycobacterium tuberculosis // Фундаментальные исследования. 2013. № 1-1. С. 18-22;URL: https://fundamental-research.ru/ru/article/view?id=30862 (дата обращения: 15.12.2025).



