Введение
Ревматоидный артрит (РА) - одна из наиболее часто встречающихся форм аутоиммунной патологии, распространенная среди 0,5-1 % населения как в мировой популяции, так и в Российской Федерации, протекающая с развитием тяжелых инвалидизирующих осложнений и выраженным снижением качества жизни [1]. Среди базисных средств, применяющихся при РА, одно из ведущих мест занимает метотрексат, основной направленностью действия которого является угнетение метаболизма фолатов с формированием иммуносупрессии. Метотрексат имеет, однако, и хорошо известные ограничения к применению - угнетение кроветворения, аллергические реакции, гепатотоксичность и некоторые другие. В последние годы в клиническую практику при РА вошел относительно новый препарат - лефлюномид, уникальный механизм действия которого связан с угнетением выработки пиримидиновых нуклеотидов его активным метаболитом A771726 с торможением лимфоцитарной активации. Лефлюномид в ряде крупных клинических исследований показал достаточно высокую эффективность при РА, сравнимую или превосходящую метотрексат, с уменьшением выраженности аутоиммунного воспаления и замедлением прогрессирования суставных деструкций [9]. Большое значение в настоящее время придается оценке способности базисного препарата влиять на цитокиновое звено патогенеза РА, особенно в связи с внедрением в клиническую практику генноинженерных антицитокиновых биологических препаратов; в то же время в клинических рекомендациях всех профессиональных ревматологических ассоциаций не ставится под сомнение необходимость обязательного использования пероральных базисных препаратов [6]. Как метотрексат, так и лефлюномид; уменьшают пролиферативную активность Т- и В-лимфоцитов. Однако при установленной in vitro способности основных базисных средств уменьшать выраженность провоспалительной цитокиновой активации [3] значительно меньше работ, в которых иммунологические эффекты препаратов изучались на клиническом уровне. Так, недостаточно исследовано влияние метотрексата при РА на противовоспалительное цитокиновое звено in vivo, а существующие данные противоречивы [5]. На фоне же применения лефлюномида цитокиновый статус на клиническом уровне изучался лишь в единичных исследованиях [8]. Важно подчеркнуть, что прояснение представлений в этой области позволило бы более глубоко оценить эффективность базисной терапии. Особый интерес при РА также представляет изучение эндотелиальной дисфункции в связи с высоким уровнем кардиоваскулярной коморбидности, что непосредственно ухудшает прогноз и является одной из основных причин высокой смертности [10]. В связи с этим важно отметить, что маркеры дисфункции эндотелия на фоне терапии лефлюномидом при РА практически не исследовались, в то время как выяснение направленности их динамики косвенно может способствовать увеличению безопасности терапии базисными средствами.
Цель работы
Изучение клинической эффективности и безопасности лефлюномида при РА, а также динамическое исследование некоторых сывороточных цитокиновых и эндотелиальных факторов на фоне курсовой терапии.
Материалы и методы
Работа выполнена в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации (2008 г.) c получением письменного согласия пациента об участии в исследовании. Диагноз РА устанавливался в соответствии с критериями АРА (1987) и АРР (2007). В основную группу были включены 25 больных (8 мужчин и 17 женщин) серопозитивным РА средней и высокой степени активности в возрасте 45,4±13,8 лет с длительностью заболевания 13,4±5,3 лет, у которых традиционная базисная терапия на протяжении 5,4±2,7 лет не позволяла добиться клинико-лабораторной ремиссии. Пациенты основной группы получали лефлюномид в дозе 20 мг в сутки (арава производства Sanofi-Aventis). Группа сравнения была сформирована методом стратифицированной рандомизации, ее составили пациенты серопозитивным РА (n=32, 6 мужчин, 26 женщин), получавшие в качестве базисной терапии метотрексат в дозе 10 мг в неделю не менее чем 6 месяцев до включения в исследование. В обязательном порядке выдерживался принцип сопоставимости групп по всем основным параметрам (возрастно-половое соотношение, дозировки используемых препаратов, влияние дополнительных факторов и др.). Контрольная группа включала 25 здоровых доноров среднего возраста 46,3±6,4 лет. Из исследования исключались пациенты РА с сопутствующими инфекционными, онкологическими, гнойными заболеваниями любой локализации, почечной, печеночной, тяжелой сердечной недостаточностью, непереносимостью метотрексата или лефлюномида. Оценивалась интенсивность боли по визуально-аналоговой шкале (ВАШ), рассчитывался суставной индекс DAS-28. Показатели качества жизни определялись по опросникам анкеты оценки здоровья (HAQ), уровни личностной (ЛТ) и реактивной тревожности (РТ) по шкале самооценки Ч. Д. Спилбергера.
Показатели гемограммы, концентрацию С-реактивного белка (СРБ), ревматоидного фактора (РФ), общего холестерина и его фракций в крови оценивали с помощью автоматических гематологического и биохимического анализаторов. Сывороточную концентрацию фактора некроза опухоли-α (ФНО-α), интерлейкина-10 (ИЛ-10) определяли с использованием готовых тест-наборов («Протеиновый контур», РФ), тканевого активатора плазминогена, фактора Виллебранда, антител к циклическому цитруллиновому пептиду (АЦЦП) («Bender Medsystems», «Axis Shield Diagnostics») с помощью твердофазного иммуноферментного анализа (анализатор Statfax 2100). Статистический анализ выполнен с помощью программы Statistica 6.0. С учетом правильного распределения данные представлены в виде М±SD. Значимость различий оценена с помощью критерия Стьюдента с поправкой Бонферонни, t-теста (при сравнении пропорций).
Результаты
В табл. 1 представлены данные об изменениях на фоне терапии лефлюномидом суставного индекса DAS-28, выраженности болевого синдрома и показателей качества жизни. Указанные показатели продемонстрировали положительную динамику, проявившуюся в снижении суставного индекса DAS28 - от 7,1±1,3 до 3,3±1,2, уменьшении восприятия боли по ВАШ от 8,7±1,1 до 6±1,7. По шкале состояния ВАШ показатель снизился более чем вдвое - от 7,1±1,5 до 3,3±1,8. Показатели качества жизни на фоне терапии лефлюномидом также улучшались, что проявлялось умеренным снижением индекса HAQ, показателей реактивной и личностной тревожности.
Таблица 1
Динамика индекса DAS28, активности болевого синдрома и показателей качества жизни у больных ревматоидным артритом на фоне курса лечения лефлюномидом
|
Показатель |
Контрольная группа (n=25) |
Метотрексат (n=32) |
Лефлюномид (n=25) |
||
|
исходно (n=25) |
через 3 мес. (n=24) |
через 6 мес. (n=24) |
|||
|
DAS28 |
- |
6,1±3,2 |
7,1±1,3 |
5,3±2,7 |
3,4±1,2†§ |
|
Боль ВАШ, см |
- |
9±1 |
8,7±1,1 |
6,5±2,3 |
6±1,7†§ |
|
Состояние ВАШ, см |
- |
6,8±2 |
7,1±1,5 |
6±2,4 |
3,3±1,8†§ |
|
HAQ, баллы |
- |
4,7±2,6 |
5,2±1 |
5,1±1,6 |
3,1±1,6†§ |
|
РТ, баллы |
23,7±9,8 |
53,4±10,7* |
55,9±13,5* |
49,3±15,7* |
35,8±10,4†§ |
|
ЛТ, баллы |
27,9±7,1 |
43,7±9,5* |
39,2±9,1* |
40,1±13,7* |
33,3±7,9† |
Примечание: значимость различий оценена с помощью критерия Стьюдента с поправкой Бонферонни (p<0,05): * - сравнение с контрольной группой; † - сравнение с группой метотрексата; § - сравнение с исходными показателями в группе лефлюномида.
Лефлюномид по сравнению с метотрексатом продемонстрировал хорошую переносимость (табл. 2).
Таблица 2
Частота побочных эффектов на фоне применения лефлюномида и метотрексата
|
Показатель |
Метотрексат (n=32) |
Лефлюномид |
|
через 3 мес. (n=24) |
||
|
Инфекции верхних дыхательных путей |
2 (6 %) |
1 (4 %) |
|
Алопеция |
1 (3 %) |
0 (0 %) |
|
Повышение сывороточного уровня печеночных трансаминаз |
1 (3 %) |
0 (0 %) |
|
Аллергические реакции |
1 (3 %) |
1 (4 %) |
|
Расстройства ЖКТ |
3 (9 %) |
1 (4 %) |
|
Гриппоподобный синдром |
1 (3 %) |
0 (0 %) |
|
Анемия |
5 (16 %) |
0 (0 %) (p=0,02) |
|
Артериальная гипертензия |
4 (12,5 %) |
0 (0 %) (p=0,04) |
Примечание: в скобках указана статистическая значимость различий пропорций при сравнении с группой метотрексата (t-тест)
Отмена препарата потребовалась только у одного больного в связи с развитием аллергической реакции и расстройством желудочно-кишечного тракта, еще у одного больного лефлюномид отменялся на 15-дневный период лечения бактериальной инфекции верхних дыхательных путей. На фоне использования метотрексата отмена препарата произведена у 3 больных (у двух пациентов - аллергические реакции, у 1 - гепатотоксический эффект). Обратила на себя внимание существенная частота анемии легкой степени на фоне применения метотрексата и отсутствие этого побочного эффекта при применении лефлюномида. Частота артериальной гипертензии также оказалась статистически значимо ниже в группе лефлюномида.
В табл. 3 приводятся изученные нами некоторые клинико-биохимические показатели, а также эндотелиальные и цитокиновые сывороточные маркеры у больных РА на фоне курсовой терапии лефлюномидом.
Концентрация традиционных маркеров активности РА - С-реактивного белка, РФ, СОЭ, АЦЦП в исходном состоянии свидетельствовала о высокой активности заболевания. На фоне терапии лефлюномидом отмечен выраженный противовоспалительный эффект, проявившийся снижением большинства параметров как относительно группы метотрексата, так и относительно исходных (табл. 3).
Таблица 3
Динамические изменения клинико-биохимических параметров и некоторых маркеров эндотелиального и цитокинового статуса при ревматоидном артрите на фоне курсового лечения лефлюномидом
|
Показатель |
Контрольная группа (n=25) |
Метотрексат (n=32) |
Лефлюномид |
||
|
исходно (n=25) |
через 3 мес. (n=23) |
через 6 мес. (n=22) |
|||
|
Эритроциты, 1012 / л |
4,4 ± 0,9 |
3,8±1* |
4,5±1,5 |
4,1±1,1 |
4,6±0,8 |
|
Лейкоциты, 109 / л |
7,4±0,7 |
6,4±3,7 |
7,2±4,3 |
7±1,9 |
7,3±1,4 |
|
Гемоглобин, г / л |
136,8±12 |
118±8* |
128±4† |
129±4† |
130±6† |
|
Гематокрит, % |
39,5±4,7 |
30±5* |
38±7† |
36±5† |
35±7† |
|
СОЭ, мм / час |
10,2±3,5 |
30±7* |
33,6±8,9* |
29,3±5,3* |
25±7,5*†§ |
|
СРБ, мг / л |
5,3±1,6 |
32±8,6* |
35±9,6* |
24±6,5*† |
23±3,2*†§ |
|
РФ, МЕ / мл |
1,5±0,5 |
57±13,2* |
60±12,3* |
49,3±10,5* |
34±7,4*†§ |
|
АЦЦП, ЕД / мл |
0,1±0,02 |
57,3±16,7* |
63,9±15,9* |
48,3±10,7*† |
25,8±11,6*†§ |
|
Фибриноген, г / л |
3,3±0,9 |
7,4±2,3* |
6,4±1,4* |
5,4±1,2* |
4,3±1*†§ |
|
Общий холестерин, ммоль / л |
4,7±1,8 |
4,3±1,4 |
4,9±2,2 |
5,1±1,6 |
4,9±2,1 |
|
Триглицериды, ммоль / л |
1,4±0,3 |
1,5±0,7 |
1,2±0,4 |
1,8±0,6 |
1,5±0,7 |
|
ЛПНП, ммоль / л |
4,2±1,3 |
3,8±2,6 |
3,9±1,2 |
3,3±1,5 |
4,4±1,7 |
|
ЛПВП, ммоль / л |
1,3±0,2 |
1±0,5 |
1,4±0,6 |
1,6±0,7 |
1,8±0,9 |
|
Фактор Виллебранда, МЕ / л |
0,7 ±0,2 |
2,5±0,4* |
1,9±0,3*† |
2±0,8*† |
2,3±0,7* |
|
Отношение ФНО-α / ИЛ-10 |
0,28±0,09 |
0,73±0,15* |
0,67±0,1* |
0,6±0,2† |
0,49±0,1*†§ |
Значимость различий оценена с помощью критерия Стьюдента с поправкой Бонферонни (p<0,05): * - сравнение с контрольной группой; † - сравнение с группой метотрексата; § - сравнение с исходными показателями в группе лефлюномида
Концентрация в сыворотке фактора Виллебранда оказалась повышенной по сравнению с контролем на всех этапах исследования как на фоне метотрексата, так и при применении лефлюномида (табл. 3). Сывороточный же уровень тканевого активатора плазминогена, оставаясь сниженным по сравнению с контролем, незначительно увеличился на фоне лечения лефлюномидом к 3-му месяцу, более существенный прирост концентрации отмечен к 6 месяцам - 24 % (рисунок).
Содержание фактора некроза опухоли-α при использовании лефлюномида не изменилось по отношению к исходному, в то время как уровень интерлейкина-10 продемонстрировал значимый рост после 6 месяцев терапии - на 34 % (рисунок). Отношение сывороточных концентраций ФНО-α / ИЛ-10, косвенно отражающее дисбаланс про- и противовоспалительных цитокинов, снизилось при использовании лефлюномида за счет динамики интерлейкина-10 от 0,67±0,1 до 0,49±0,1 - на 27 % (табл. 3).
При проведении корреляционного анализа в группе лефлюномида исходно определена обратная корреляционная зависимость между сывороточными концентрациями ФНО-α и тканевого активатора плазминогена в исходном состоянии (r= - 0,6; p=0,01), выраженность которой уменьшалась через 6 мес. после терапии (r= - 0,2; p=0,04).
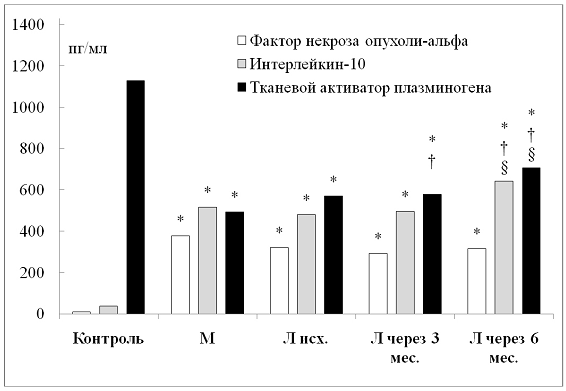
Концентрация фактора некроза опухоли-альфа, интерлейкина-10 и тканевого активатора плазминогена на фоне курсовой терапии лефлюномидом у пациентов с ревматоидным артритом
Примечание: значимость различий оценена с помощью критерия Стьюдента с поправкой Бонферонни: * - сравнение с контрольной группой; † - сравнение с группой метотрексата; § - сравнение с исходными показателями в группе лефлюномида. Сокращения: М - метотрексат; Л - лефлюномид
Обсуждение
Известно, что фактор Виллебранда и тканевой активатор плазминогена являются не только регуляторами системы тромбоцитарного гемостаза, но и маркерами дисфункции эндотелия, в том числе и при ревматоидном артрите. Поскольку в настоящее время не существует прямых корректоров дисфункции эндотелия, большое внимание исследователей приковано к изучению плейотропных эффектов различных групп активно применяющихся препаратов, в том числе базисных средств при РА [2]. Среди немногих работ, в которых изучалось влияние лефлюномида на эндотелиальный статус, можно отметить исследование Grisar J. et al. [4], в котором показана способность препарата уменьшать трансэндотелиальную миграцию лейкоцитов, их адгезивные свойства по отношению к эндотелию сосудов.
Состояние цитокиновых медиаторов при РА привлекает внимание исследователей достаточно давно, в связи с этим примечательно сравнительно небольшое количество клинических работ по их изучению на фоне применения лефлюномида [8]. Уровень ФНО-α на фоне применения лефлюномида, согласно нашим данным, значимо не изменялся, при достаточно большом разбросе показателей, что не противоречит имеющимся фундаментальным сведениям о наличии у препарата способности ингибировать синтез ФНО-α in vitro [7] и, по-видимому, связано с многообразием путей активации этого провоспалительного цитокина и постоянным активным поддержанием его локальной и системной продукции при РА за счет различных клеточных типов - лимфоцитов, макрофагов, синовиоцитов, фибробластов и т. д. Концентрация же интерлейкина-10 при использовании лефлюномида увеличивалась. Вероятно, этот факт может быть объяснен увеличением продукции ИЛ-10 за счет изменения соотношения субпопуляций лимфоцитов под действием лефлюномида при меньшем значении других альтернативных источников его синтеза. Важно отметить также выявленную нами взаимосвязь между уровнем провоспалительной цитокиновой активации, оцененным по ФНО-α, и сывороточным маркером эндотелиальной дисфункции - тканевым активатором плазминогена. Интересно, что, по нашим данным, выраженность этой взаимосвязи уменьшалась на фоне применения лефлюномида.
Таким образом, нами продемонстрирована хорошая клиническая переносимость лефлюномида, незначительная частота побочных явлений, положительная динамика болевых, суставных проявлений РА, улучшение показателей качества жизни. Определена способность лефлюномида повышать уровни интерлейкина-10 в сыворотке крови, и впервые установлена возможность улучшения состояния эндотелия посредством влияния на продукцию тканевого активатора плазминогена.
СПИСОК ЛИТЕРАТУРЫ
- Фоломеева О. М., Эрдес Ш. Ф. Инвалидность взрослого населения России, обусловленная ревматическими заболеваниями // Русский медицинский журнал. - 2007. - Т. 15. - № 26. - С. 1946-1951.
- Daza L., Aguirre M., Jimenez M. Common carotid intima-media thickness and von Willebrand factor serum levels in rheumatoid arthritis female patients without cardiovascular risk factors // Clin. Rheumatol. - 2007. - Vol. 26 (4). - P. 533-537.
- Elkayam O., Yaron I. Active leflunomide metabolite inhibits IL-l, TNF-alpha, nitric oxide, and metalloproteinase-3 production in activated human synovial tissue cultures // Ann. Rheum. Dis. - 2003. - Vol. 62. - p. 440-443.
- Grisar J., Aringer M., Koller M. D. Leflunomide inhibits transendothelial migration of peripheral blood mononuclear cells // Ann. Rheum. Dis. - 2004. - Vol. 63. - P. 1632-1637.
- Herman S., Zurgil N., Langevitz P. et al. Methotrexate selectively modulates TH1 / TH2 balance in active rheumatoid arthritis patients // Clin. Exp. Rheumatol. - 2008. - Vol. 26 (2). - P. 317-323.
- Kombe B. EULAR recommendations for the management of early arthritis: report of a task force of the European Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) // Ann. Rheum. Dis. - 2007. - Vol. 66. - P. 34-45.
- Li W. D., Ran G. X., Teng H. L. et al. Dynamic effects of leflunomide on IL-1, IL-6, and TNF-alpha activity produced from peritoneal macrophages in adjuvant arthritis rats // Acta Pharmacol. - 2002. - Vol. 23. - P. 752-756.
- Litinsky I., Paran D., Levartovsky D. et al. The effects of leflunomide on clinical parameters and serum levels of IL-6, IL-10, MMP-1 and MMP-3 in patients with resistant rheumatoid arthritis // Cytokine. - 2006. - Vol. 33. - P. 106-110.
- Osiri M., Shea B., Robinson V. et al. Leflunomide for the treatment of rheumatoid arthritis: a systematic review and meta-analysis // J. Rheumatol. - 2003. - Vol. 30. - P. 1182-1190.
- Turesson C., Jacobsson L. T., Matteson E. L. Cardiovascular co-morbidity in theumatic diseases // Vascular Health and Risk Management. - 2008. - Vol. 4 (3). P. 605-614.



