Введение
Макрофаги играют исключительно важную роль в иммунных ответах. Это связано с тем, что внедрение в организм чужеродного агента вызывает мощную активацию макрофагов, выделение цитокинов и других медиаторов воспаления. Макрофаги, стимулированные внутриклеточными микробами, такими, как вирусы или бактерии, липополисахаридом (ЛПС) и / или IFN-γ, отвечают классической активацией, т. е. продукцией провоспалительных цитокинов, таких, как IL-1, TNF-α, IL-12 и IFN-γ, и генерацией активных форм кислорода и азота. Такой фенотип макрофагов получил название M1 [6]. M1 макрофаги обладают выраженными фагоцитирующими и бактерицидными свойствами. Макрофаги, стимулированные экстраклеточными паразитами или IL-4, IL-13, TGF-ß или глюкокортикоидами, формируют альтернативный М2 фенотип [6]. М2 макрофаги продуцируют антивоспалительные цитокины, такие, как IL-10, IL-13 [6], и содействуют ангиогенезу, репарации и ремоделированию тканей.
Провоспалительные цитокины IL-1, TNF-α, IL-12 и IFN-γ, продуцируемые преимущественно М1 фенотипом, потенцируют развитие Th0 клеток в Тh1 и угнетают Тh2 ответ. Таким образом, M1 макрофаги интегрированы в клеточный Th1 ответ, который обезвреживает микроорганизмы и опухолевые клетки. Антивоспалительные цитокины IL-10, IL-4 и IL-13, продуцируемые преимущественно М2 фенотипом, сдвигают дифференцировку Тh0 клеток в Тh2 и ингибируют пролиферацию Тh1. Th2 клетки способствуют секреции антител В клетками и запускают гуморальный иммунный ответ [6].
Интересно, что Th1 клетки продуцируют тот же набор цитокинов, что и М1 макрофаги, а Th2 - что и М2 макрофаги. Поэтому провоспалительные цитокины иногда называют Th1 цитокинами, а антивоспалительные - Th2 цитокинами.
Нарушение в правильном выборе между Th1 и Th2 ответами лежит в основе развития большого количества заболеваний. Соответственно факторы, которые могут влиять на этот выбор, представляют кардинальный интерес для современной иммунопатологии.
В этом отношении наше внимание привлек сурфактантный белок D (SP-D). Главным образом, SP-D продуцируется в легких. Основная функция легочного SP-D состоит в модулировании воспаления и иммунной защиты в легких. В легких SP-D связываются c разными рецепторами на поверхности альвеолярных макрофагов и в зависимости от своей олигомерной структуры может стимулировать про- или антивоспалительную активность макрофагов [5]. В настоящее время изучение влияния SP-D на продукцию Th1 и Th2 цитокинов становится ключевым моментом в понимании роли SP-D в регуляции воспаления и всего иммунного ответа.
Недавно было показано, что SP-D обнаружен не только в легких, но и в сердце, желудке и кишечнике [9]. Отсюда возникает первый важный вопрос: может ли SP-D регулировать секреторную активность других макрофагов, кроме альвеолярных? То есть, вовлечен ли SP-D в иммунный ответ всего организма? Второй важный вопрос - зависят ли регуляторные эффекты SP-D от фенотипа макрофагов? И, наконец, третий вопрос - вовлечен ли SP-D в сам процесс программирования макрофагов и приобретение того или иного фенотипа секреторной активности?
Цель исследования
Цель работы заключалась в определении роли SP-D в регуляции баланса макрофагальных Th1 и Th2 цитокинов. Для этого было необходимо ответить на три вышеобозначенных вопроса. Для того чтобы ответить на эти вопросы, мы сравнили динамику ЛПС-индуцированной продукции цитокинов в разных фенотипах перитонеальных макрофагов, выделенных от нормальных и SP-D (- / -) мышей.
Материал и методы исследования
C57BL / 6 мыши, не имеющие SP-D гена (SP-D (- / -)), были получены в лаборатории S. Hawgood и переданы в Пенсильванский университет, США [3]. В качестве контроля были использованы сопоставимые по возрасту (8-10 недель) C57BL / 6 нормальные мыши. Мыши содержались в условиях, не допускающих попадание патогенных микроорганизмов, в соответствии с протоколом Комиссии по содержанию животных (Пенсильванский университет, США). Перитонеальные макрофаги выделяли из перитонеального смыва мышей, которым за 4 дня вводили в / б 2 мл 4 % бульона тиогликолята. Перитонеальные макрофаги культивировали в среде RPMI 1640 с 10 %-ной сывороткой с 100 U / мл пенициллина и 100 µг / мл стрептомицина. Для получения М1 и М2 фенотипов макрофагов была использована методика Zhang and Morrison [1]. Для этого первичная культура наивных перитонеальных макрофагов была разделена на три пула. В первый пул для формирования М1 фенотипа было добавлено на 6 часов 0,5 нг / мл ЛПС (из E. coli O111:B4, List Biologic Laboratories, Campbell, CA); во второй пул для формирования М2 фенотипа - 5 нг / мл ЛПС. Третий пул служил контролем (нативный М0 фенотип). Для активации макрофагов использовали ЛПС в концентрации 500 нг / мл.
Для измерения цитокинов, 200 мкл культуральной среды замораживали при -80 ºC. Оценку содержания INF-γ, TNF-α, IL-12, IL-6, IL-10 и IL-13 проводили с помощью SearchLight® Technology multiplex cytokine assay (Pierce Biotechnology, Woburn, MA).
Результаты представляли как M ± m и обрабатывали статистически с использованием t-критерия Стьюдента. Отличие между группами считалось достоверным при p < 0,05.
Результаты исследования и их обсуждение
Макрофаги, репрограммированные на М1 фенотип, на действие ЛПС в высоких концентрациях (500 нг / мл) отвечали преимущественным увеличением Th1 цитокинов, а репрограммированные на М2 - Th2 цитокинов (рис. 1). Например, в нативном М0 фенотипе макрофагов ЛПС-стимулированная продукция Th1 цитокинов TNF-α и IL-12 составляла 4812+666 и 44+5 пг / мл соответственно, а Th2 цитокинов IL-10 и IL-13 - 475+38 и 17+6 пг / мл соответственно. В М1 фенотипе ЛПС-стимулированная продукция Th1 цитокинов TNF-α и IL-12 составляла 8714+865 и 51+3 пг / мл соответственно, а антивоспалительного IL-10 и IL-13 - 329+40 и 6+2 пг / мл соответственно. Тогда как в М2 фенотипе продукция Th1 цитокинов TNF-α и IL-12 составляла всего 4412+468 и 11+2 пг / мл, соответственно, а Th2 цитокинов IL-10 и IL-13 - 780+35 и 6+1 пг / мл соответственно. В результате оказалось, что продукция Th1 цитокина IL-12 в М1 фенотипе макрофагов была в 5 раз выше, а Th2 цитокина IL-10 почти в 2,5 раза ниже по сравнению с М2 фенотипом макрофагов нормальных мышей. Таким образом, мы воспроизвели методический прием альтернативного репрограммирования нативных М0 макрофагов на М1 (провоспалительный) и М2 (антивоспалительный) фенотип.
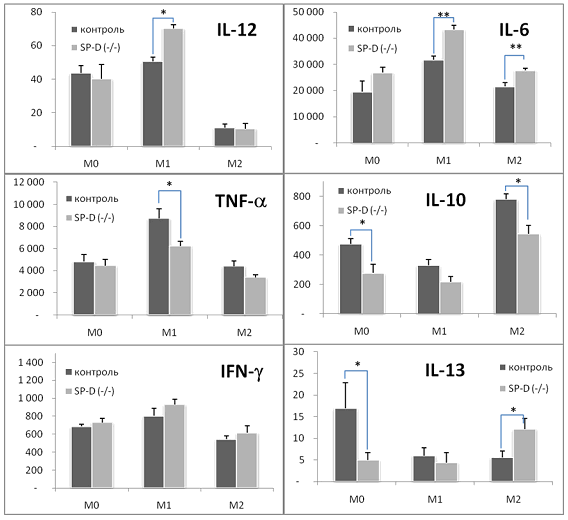
Рис. 1. Изменение продукции Th1 и Th2 цитокинов у контрольных и SP-D (-/-) макрофагов разных фенотипов в ответ на стимуляцию ЛПС (500 нг/мл)
По оси ординат: концентрация цитокинов в культуральной среде, пикограмм/мл
Достоверность различий между контролем и SP-D (-/-): * - р<0,05 и ** - р<0,01
В макрофагах SP-D (- / -) мышей в ответ на стимуляцию высокими концентрациями ЛПС (500 нг / мл) наблюдалась следующая картина (рис. 1). В нативном М0 фенотипе ЛПС-индуцированная продукция Th1 цитокинов IL-12, TNF-α и IFN-γ и Th2 цитокина IL-6 достоверно не различалась между макрофагами нормальных и SP-D (- / -) мышей. Продукция Th2 цитокинов IL-10 и IL-13 в М0 фенотипе макрофагов SP-D (- / -) мышей была снижена в 2 и 3 раза соответственно по сравнению с М0 фенотипом макрофагов нормальных мышей.
В М1 фенотипе SP-D (- / -) макрофагов изменение продукции разных Th1 цитокинов было разнонаправленным. Продукция IL-12 была достоверно увеличена, TNF-α - снижена, а IFN-γ практически не изменилась по сравнению с М1 фенотипом макрофагов нормальных мышей. Изменение продукции разных Th2 цитокинов в М1 фенотипе SP-D (- / -) макрофагов также было разнонаправленным. А именно: продукция IL-6 достоверно увеличилась, а продукция IL-10 и IL-13 практически не изменилась по сравнению с М1 фенотипом макрофагов нормальных мышей.
В М2 фенотипе SP-D (- / -) макрофагов продукция Th1 цитокинов IL-12, TNF-α и IFN-γ достоверно не изменялась по сравнению с М2 фенотипом макрофагов нормальных мышей. В М2 фенотипе SP-D (- / -) макрофагов изменение продукции разных Th2 цитокинов было разнонаправленным. А именно: продукция IL-6 и IL-13 достоверно увеличивалась, а IL-10 достоверно снижалась по сравнению с М2 фенотипом нормальных макрофагов.
До 90-х годов исследования механизмов активации макрофагов фокусировались, главным образом, на индукции воспалительных и эффекторных функций. Открытие и описание М1 и М2 фенотипов макрофагов, вырабатывающих разный спектр Th1 и Th2 цитокинов, привело к разработке новой М1 / М2 концепции роли макрофагов в иммунитете. В этой концепции качество, интенсивность и специфичность активации макрофагов зависят от природы действующего патогена и модулирующих цитокинов. При этом, Th1 цитокины способствуют формированию М1 фенотипа, тогда как Th2 цитокины, напротив, М2 фенотипа. Эти исследования обеспечили физиологическую основу для объяснения функциональной гетерогенности макрофагов, роли микроокружения в формировании фенотипа макрофагов и механизмов пластичности иммунного ответа. Поэтому в нашей работе мы сосредоточились на SP-D, который, как известно, является компонентом микроокружения макрофагов в легких и одним из ключевых регуляторов их активности [5]. Полученные данные позволяют ответить на важные вопросы и сделать вывод о значении SP-D в регуляции иммунного ответа организма в целом.
Первый вопрос. Регулирует ли SP-D активность других макрофагов, кроме альвеолярных? Представленные здесь данные показывают, что отсутствие SP-D в организме мышей оказывает влияние на секреторную активность перитонеальных макрофагов. Это означает, что SP-D является не только локальным фактором легочного иммунитета, но, вероятно, также играет роль в развитии иммунного ответа всего организма. Вместе с тем обнаружилась определенная специфика в эффектах SP-D на макрофаги разной локализации. Так, хорошо известно, что удаление SP-D гена приводит к увеличению количества и размера альвеолярных макрофагов [7]. В случае SP-D (- / -) перитонеальных макрофагов изменения размера и количества макрофагов не происходило [2].
Второй вопрос. Зависят ли регуляторные эффекты SP-D от фенотипа макрофагов? Наши результаты позволяют положительно ответить на этот вопрос. Так, например, отсутствие гена SP-D не влияло на продукцию Th1 цитокинов IL-12 и TNF-α в нативном и М2 фенотипах, но приводило к увеличению секреции IL-12 и к снижению TNF-α в М1 фенотипе. При оценке влияния SP-D на секрецию Th2 цитокинов выяснилось следующее. Отсутствие гена SP-D не влияло на продукцию IL-6 в М0 фенотипе, но приводило к увеличению продукции этого цитокина в М1 и М2 фенотипе. Зависимость эффектов SP-D от фенотипа макрофагов также обнаружилась и на примере IL-10. Однако наиболее ярко она проявилась на примере IL-13 - отсутствие SP-D приводило к снижению продукции этого Th2 цитокина в М0 фенотипе, не влияло на продукцию в М1 фенотипе и повышало в М2 фенотипе. Исключение из правила о зависимости эффектов SP-D на секреторную активность макрофагов составил IFN-γ: удаление гена SP-D не приводило к изменению продукции этого цитокина ни в одном из фенотипов макрофагов.
Зависимость влияния SP-D на продукцию разных Th1 и Th2 цитокинов от фенотипа макрофагов предопределяет изменение баланса Th1 / Th2 цитокинов. Так, в ЛПС-стимулированном нативном М0 фенотипе SP-D (- / -) макрофагов за счет снижения продукции Th2 цитокинов IL-10 и IL-13, Th1 / Th2 баланс цитокинов сдвигается в сторону Th1 цитокинов. В М1 фенотипе отсутствие SP-D оказывает разнонаправленный эффект на разные Th1 и Th2 цитокины. И, наконец, в М2 фенотипе за счет усиления продукции продукции Th2 цитокинов баланс Th1 / Th2 цитокинов сдвигается в сторону Th2.
Выяснение механизмов, определяющих зависимость эффектов SP-D от фенотипа макрофага, осложняется тем, что на первичное влияние SP-D на продукцию цитокинов вторично могут накладываться усиливающие и ослабляющие эффекты одних цитокинов на синтез других. Кроме того, разные олигомерные формы SP-D могут оказывать противоположное влияние на активность макрофагов, связываясь с разными рецепторами на поверхности этих клеток [5]. Так, SP-D в нативной мультиолигомерной форме через свой карбоксильный домен связывается с рецептором SIRP-α и блокирует провоспалительные ответы благодаря ингибированию активацию р38 MAPK и NFkB (рис. 2). Также подтверждено, что именно мультиолигомерная структура SP-D ингибирует ЛПС-индуцированный воспалительный ответ макрофагов [5].
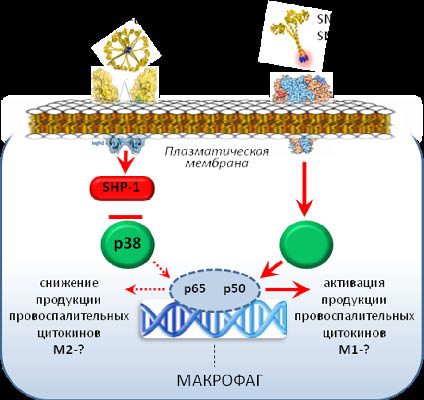
Рис. 2. Схема про-и противовоспалительных функций SP-D (модифицированная схема Gardai, 2003) [4]
Во время воспаления SP-D становиться мишенью для NO. В результате мультиолигомерная структура SP-D распадается на S-нитрозилированные тримеры и мономеры. Тримеры и мономеры в отличие от мультимеров SP-D связываются с другим рецепторным комплексом - кальретикулин / С91, и, таким образом, активируют продукцию провоспалительных цитокинов благодаря фосфорилированию p38 и активации NFkB [5].
И, наконец, недавно было показано, что количество рецепторов SIRP-α, с которыми связывается мультиолигомерная форма SP-D на поверхности макрофагов, значительно уменьшается после стимуляции ЛПС [8]. Понятно, что этот феномен также будет интерферировать с механизмами зависимости эффектов SP-D от фенотипа макрофагов.
Третий вопрос, на который позволяет ответить наше исследование: вовлечен ли SP-D в механизмы программирования макрофагов и формирование того или иного фенотипа секреторной активности? Наши данные позволяют сделать предположение о важной роли SP-D в механизме программирования фенотипа макрофагов. Мы обнаружили, что отсутствие SP-D приводит к инверсии феномена репрограммирования в отношении цитокина IL-13 (рис. 1), а именно: ЛПС-зависимое программирование макрофагов нормальных мышей привело к тому, что продукция этого цитокина в М2 фенотипе была существенно ниже по сравнению с М0 фенотипом, тогда как программирование макрофагов SP-D (- / -) мышей привело к обратному соотношению: продукция IL- 13 в М2 фенотипе была существенно выше по сравнению с М0 фенотипом. При этом известно, что IL-13 сам по себе является мощным фактором программирования макрофагов в сторону М2 фенотипа. Критическая значимость SP-D в программировании секреторного фенотипа макрофагов позволяет считать SP-D важным эндогенным фактором репрограммирования макрофагов и определяет важную роль SP-D в развитии врожденных и адаптивных иммунных ответов организма.
Для понимания биологической значимости функций SP-D в качестве эндогенного фактора репрограммирования макрофагов необходимо также учитывать следующие обстоятельства. Нативные нерепрограммированные М0 макрофаги при активации одновременно продуцируют и провоспалительные (Th1), и антивоспалительные (Th2) цитокины с противоположными эффектами на дифференцировку Тh0 клеток. Это может приводить к задержке в развитии альтернативного Th1 / Th2 приобретенного иммунитета. Предварительное SP-D-зависимое репрограммирование макрофагов может иметь место на самых ранних стадиях инфекции при действии низких концентраций ЛПС. Репрограммированные макрофаги в ответ на действие высоких концентраций патогена будут отвечать преимущественной продукцией или Th1, или Th2 цитокинов. Это помогает быстро предопределить вектор и скорость развития воспалительного процесса и адекватного Th ответа и способствует более эффективному уничтожению патогена.
Выводы
В целом наши данные позволяют дополнить существующие знания о роли SP-D в регуляции активности макрофагов, а именно: впервые начинает складываться представление 1) о генерализованной роли SP-D в развитии иммунного ответа организма; 2) о том, что регуляторная роль SP-D зависит от фенотипа макрофагов и 3) о том, что SP-D может регулировать формирование врожденных и адаптивных иммунных ответов как за счет влияния на Th1 / Th2 баланс цитокинов, так и за счет участия в репрограммировании макрофагов малыми дозами патогенна.
СПИСОК ЛИТЕРАТУРЫ
- Atochina E., Beers M., Tomer Y. et al. Attenuated allergic airway hyperresponsiveness in C57BL / 6 mice is associated with enhanced surfactant protein (SP) -D production following allergic sensitization. Respir Res., 2003; 4: 15
- Atochina-Vasserman E. N., Abramova H., Tomer Y. et al. SP-D-dependent regulation of NO metabolism in LPS-stimulated peritoneal macrophages. Journal of Bulletin Experimental Biology & Medicine, 2009; 147 (4):415-20
- Botas C., Poulain F., Akiyama J. et al. Altered surfactant homeostasis and alveolar type II cell morphology in mice lacking surfactant protein D. Proc.Natl.Acad. Sci. USA 95; 1998:11869-11874
- Gardai S. J., Xiao Y. Q., Dickinson M. et al. By binding SIRPalpha or calreticulin / CD91, lung collectins act as dual function surveillance molecules to suppress or enhance inflammation. Cell, 2003;115:13-23.
- Guo C. J., Atochina-Vasserman E. N., Abramova H. et al. S-Nitrosylation of surfactant protein-D controls inflammatory function. PLoS Biology, 2004; 6 (11).
- Martinez F. O., Sica A., Mantovani A. et al. Macrophage activation and polarization. Front Biosci., 2008; 13: 453-61.
- Wert S. E., Yoshida M., LeVine A. M. et al. Proceedings of the National Academy of Sciences of the United States of America 97, 2000: 5972-5977
- Kong X.-N., Yan H.-X., Chen L. et al. Journal of Experimental Medicine, 2007; 204: 2719-2731.
- J. H. Fisher, V. Sheftelyevish, Y.-S. Ho et al. Pulmonary-specific expression of SP-D corrects pulmonary lipid accumulation in SP-D gene-targeted mice. Am. J. Physiol. Lung Cell Mol. Physiol., 2000; 278: L365-L373.



