Введение
Макрофаги играют исключительно важную роль в иммунных ответах. Это связано с тем, что внедрение в организм чужеродного агента вызывает прежде всего мощную активацию макрофагов, выделение цитокинов и других медиаторов воспаления. При этом в зависимости от микроокружения макрофаги могут существенно модифицировать свою активность. Так, макрофаги, находящиеся в среде с низкими дозами бактериального липополисахарида (ЛПС) и / или IFN-γ, в ответ на действие стимулирующих факторов отвечают классической активацией, т. е. продукцией провоспалительных цитокинов, таких, как IL-1, TNF-α, IL-12 и IFN-γ, и генерацией активных форм кислорода и азота. Такой фенотип макрофагов получил название M1 [8]. M1 макрофаги обладают выраженными фагоцитирующими и бактерицидными свойствами и уничтожают внутриклеточных микробов, таких, как вирусы и бактерии, а также опухолевые клетки. Макрофаги, находящиеся в среде с IL-4, IL-13, TGF-ß или глюкокортикоидами, формируют альтернативный М2 фенотип, который в ответ на действие стимулирующих факторов продуцирует антивоспалительные цитокины, такие, как IL-10, IL-13 [8]. M2 макрофаги уничтожают экстраклеточных паразитов, таких, как гельминты и грибы, содействуют ангиогенезу, репарации и ремоделированию тканей, но при этом могут способствовать опухолевому росту. Особая активация М2 фенотипа была обозначена новым термином «альтернативная активация» для подчеркивания контраста с «классической активацией» М1 макрофагов.
В очаге воспаления макрофаги функционируют в агрессивной среде, и для того чтобы выжить, макрофаги активируют синтез собственных внутриклеточных защитных стресс-белков HSP70 [7]. Индукция HSP70 представляет собой ключевой маркерный компонент так называемого стресс-ответа, который защищает макрофаги от некроза и апоптоза [7], индуцируемого различными воспалительными медиаторами. Таким образом, способность макрофагов к индукции HSP70, по сути, определяет, сможет ли макрофаг проявить свою иммунологическую активность в очаге воспаления. По сравнению с другими клетками макрофаги проявляют наибольшую способность активировать синтез HSP70 в ответ на действие провоспалительных цитокинов и компонентов бактериальных клеток, включая ЛПС [7].
Очевидно, что факторы, которые могут влиять на процесс формирования фенотипа макрофагов, на их секреторную активность и способность к индукции HSP70, представляют кардинальный интерес для современной иммунологии и медицины.
В качестве такого фактора, в настоящее время серьезное внимание привлекает сурфактантный белок D (SP-D). SP-D является мультимерным Са2+-связывающим белком из семейства коллагеноподобных лектинов. Главным образом, SP-D продуцируется в легких [5]. Недавно было показано, что в зависимости от своей олигомерной структуры SP-D может связываться или с CD91, или SIRP-α (сигнальный ингибирующий регуляторный белок-α) на поверхности альвеолярных макрофагах и соответственно стимулировать про- или антивоспалительную активность макрофагов [5]. Основная функция легочных SP-D состоит в модулировании воспаления и иммунной защиты в легких. Было показано, что удаление SP-D гена (SP-D (- / -)) приводит к увеличению количества и размера макрофагов в легких, нарушению профиля сурфактантных фосфолипидов, увеличению активности металлопротеаз, оксидативному и нитрозативному стрессу [9], а также повышению базального уровня воспаления в легких с последующим развитием эмфиземы [3] и повышению восприимчивости организма к бактериальным и вирусным инфекциям.
Недавно SP-D был обнаружен не только в легких, но и в сердце, желудке и кишечнике [4]. После этого сразу возник важный вопрос: может ли SP-D регулировать секреторную активность других макрофагов, кроме альвеолярных? То есть является ли SP-D только локальным фактором легочного иммунитета или он также может быть вовлечен в иммунный ответа всего организма. Недавно мы получили данные, которые позволили положительно ответить на этот вопрос, а именно: мы показали, что SP-D фенотип-зависимым образом влияет на продукцию NO и цитокинов перитонеальными макрофагами. При этом оказалось, что SP-D также играет роль и в самом процессе альтернативного программирования фенотипа макрофагов. Вместе с тем, вопрос о том, как влияет SP-D на способность макрофагов к индукции стресс-белков, и зависит ли это влияние от фенотипа макрофагов, до сих пор остается открытым.
Цель исследования
Цель работы состояла в том, чтобы определить, влияет ли SP-D на способность макрофагов к индукции стресс-белков HSP70, и если да, то является ли этот эффект фенотип-зависимым. Для того чтобы ответить на этот вопрос, мы сравнили степень ЛПС-индуцированного синтеза HSP70 в разных фенотипах перитонеальных макрофагов, выделенных от нормальных и SP-D (- / -) мышей.
Материал и методы исследования
C57BL / 6 мыши, не имеющие SP-D гена (SP-D (- / -)), были получены в лаборатории S. Hawgood и переданы в Пенсильванский университет США для дальнейших исследований. Сопоставимые по возрасту (8-10 недель) C57BL / 6 нормальные мыши были использованы в качестве контроля. Мыши содержались в условиях аккредитованного вивария, не допускающих попадание патогенных микроорганизмов, в соответствии с протоколом Комиссии по содержанию животных (Пенсильванский университет, США). Перитонеальные макрофаги выделяли из перитонеального смыва контрольных и SP-D (- / -) мышей, которым за 4 дня вводили в / б 2 мл 4 % бульона тиогликолята. Перитонеальные макрофаги культивировали в среде RPMI 1640 с 10 %-ной сывороткой с 100 U / мл пенициллина и 100 µг / мл стрептомицина в 48-ми луночных планшетах по 0,5x106 клеток на лунку. Для получения М1 и М2 фенотипов макрофагов была использована методика Zhang and Morrison [2]. Для этого первичная культура нативных перитонеальных макрофагов была разделена на три пула. В первый пул для формирования М1 фенотипа было добавлено на 6 часов 0,5 нг / мл ЛПС (из E. coli O111:B4, List Biologic Laboratories, Campbell, CA); во второй пул для формирования М2 фенотипа - 5 нг / мл ЛПС. Третий пул служил контролем (нативный М0 фенотип). Для активации макрофагов использовали ЛПС в концентрации 500 нг / мл.
Для подтверждения феномена репрограммирования макрофагов оценивали продукцию маркерного для М1 фенотипа интерлейкина 12 (IL-12); и маркерного для М2 фенотипа IL-10. Для измерения цитокинов 200 мкл культуральной среды замораживали при -800C. Оценку содержания IL-12 и IL-10 проводили с помощью SearchLight® Technology multiplex cytokine assay (Pierce Biotechnology, Woburn, MA). Результаты представляли как M + СО и обрабатывали статистически с использованием t-критерия Стьюдента. Отличие между группами считалось достоверным при p < 0,05.
Оценку содержания белка HSP70 проводили с помощью Вестерн-блот анализа. Для этой цели макрофаги лизировали в буфере, содержащем 62,5 мМ Tris-HCl, pH 6,8, 2 % SDS, 25 % глицерол, 0,01 % Bromophenol Blue. Белки электрофоретически разделяли с помощью SDS PAGE и электрофоретически переносили на PVDF мембрану (Bio-Rad) в присутствии 48 мМ Tris, 380 мМ глицина, 0,1 %SDS, 20 % метанола, pH 8,3. Неспецифическое связывание на мембране блокировали 5 % обезжиренным молоком в PBS-Tween в течение ночи при 4 ºC. Затем блоты инкубировали в течение 1 часа с первичными моноклональными мышиными анти-HSP70 антителами, которые распознают индуцибельные HSP70, при разведении 1:1000 (Stressgen, Cat # SPA-810). В качестве вторичных антител использовали конъюгированные с пероксидазой хрена антимышиные антитела (Santa Cruz, Cat # sc-2005) в разведении 1:3000. Просмотр бэндов осуществлялся с использованием хемилюминесценции (ECL+, Amersham Inc., Pittsburgh, PA), количественное определение проводилось путем денситометрического сканирования экспонированных пленок или направленным просмотром на устройстве Kodak 440 Imaging System (New Haven, CT). Измерение HSP70 проводили до и через 24 часа после активации макрофагов с помощью ЛПС (500 нг / мл). Способность к индукции HSP70 выражали в процентах как отношение содержания HSP70 через 24 часа стимуляции ЛПС к исходному уровню HSP70 до стимуляции, которое принимали за 100 %.
Результаты исследования и их обсуждение
Формирование М1 и М2 фенотипов макрофагов по методике Zhang и Morrison [2] мы подтвердили с помощью измерения цитокинов после стимуляции макрофагов ЛПС (рис. 1).
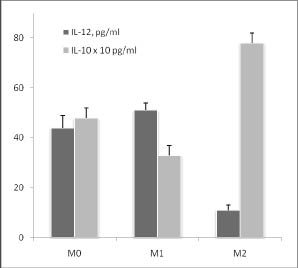
Рис. 1. Продукция IL-12 и IL-10 макрофагами М0, М1 и М2 фенотипа в ответ на действие 500 нг / мл ЛПС в течение 24 часов:
* - достоверность различий между М0 и М1 фенотипами
# - достоверность различий между М0 и М2 фенотипами
@ - достоверность различий между М1 и М2 фенотипами
Действительно, М1 макрофаги продуцировали преимущественно провоспалительный цитокин IL-12, а М2 - антивоспалительный IL-10. Эти данные принципиально не отличались от уже опубликованных ранее. На рис. 1 видно, что отсутствие гена SP-D привело к увеличению ЛПС-индуцированной продукции IL-12 в М1 фенотипе и не повлияло на продукцию этого фенотипа в М0 и М2 фенотипах. ЛПС-индуцированная продукция IL-10 была снижена в М0 и М2 фенотипах, и осталась неизменной в М1 фенотипе макрофагов SP-D (- / -) мышей по сравнению с нормальными макрофагами тех же фенотипов.
Данные, представленные на рис. 2, показывают, что все три фенотипа перитонеальных макрофагов нормальных мышей отвечали значительной активацией синтеза HSP70 на действие 500 нг / мл ЛПС.
Содержание HSP70 увеличивалось более чем в 100 раз. При этом оказалось, что предварительное репрограммирование макрофагов на М1 и М2 фенотипы практически не повлияло на способность нормальных макрофагов индуцировать синтез защитных стресс-белков. Наблюдалась лишь тенденция к снижению ЛПС-индуцированного синтеза HSP70 в М1 фенотипе по сравнению с М0 и М2 фенотипе по сравнению с М1.
В макрофагах SP-D (- / -) мышей в ответ на стимуляцию высокими концентрациями ЛПС (500 нг / мл) наблюдалась следующая картина (рис. 2). Удаление гена SP-D привело к тому, что ЛПС-индуцированный синтез HSP70 в нативном М0 фенотипе был незначительно выше, в М1 фенотипе практически не изменялся, а в М2 фенотипе был более чем в 2 раза увеличен по сравнению с соответствующим фенотипом макрофагов нормальных мышей. Эти данные отражают выраженную зависимость эффектов SP-D на синтез HSP70 от фенотипа перитонеальных макрофагов.
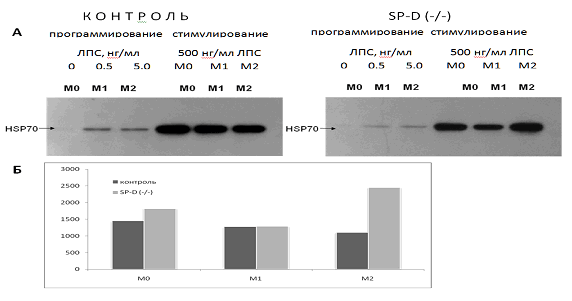
Рис. 2. Увеличение содержания HSP70 в макрофагах М0, М1 и М2 фенотипов в ответ на действие 500 нг / мл ЛПС в течение 24 часов. Макрофаги были выделены из перитонеальной жидкости нормальных (контроль) и SP-D (- / -) мышей:
А - репрезентативная фотография Вестерн блот анализа. Эксперимент проведен в трех повторах;
Б - графическое изображение данных Вестерн блот анализа (рис. 2 А) в процентах. За 100 % принято содержание HSP70 перед добавлением 500 нг / мл ЛПС
До 90-х годов исследования механизмов активации макрофагов фокусировались, главным образом, на индукции воспалительных и эффекторных функций. Открытие и описание М1 и М2 фенотипов макрофагов, вырабатывающих разный спектр Th1 и Th2 цитокинов, привело к разработке новой М1 / М2 концепции роли макрофагов в иммунитете. В этой концепции качество, интенсивность и специфичность активации макрофагов зависят от природы действующего патогена и модулирующих цитокинов [1]. Эти исследования обеспечили физиологическую основу для объяснения функциональной гетерогенности макрофагов, роли микроокружения в формировании фенотипа макрофагов и механизмов пластичности иммунного ответа. В этой работе мы сосредоточились на механизме индукции HSP70, который обеспечивает выживание макрофагов в неблагоприятной среде очага воспаления, и роли SP-D в регуляции этого защитного механизма.
Полученные нами результаты впервые показали, что SP-D вовлечен в регуляцию стресс-ответа макрофагов, и одновременно поставили два важных вопроса.
Первый вопрос, который возникает при анализе наших результатов - почему эффект удаления гена SP-D на синтез HSP70 зависит от фенотипа макрофагов. Очевидное предположение, что ЛПС-зависимое репрограмирование фенотипа макрофагов также «затрагивает» гипотетические пока механизмы SP-D-зависимого синтеза HSP70. На сегодняшний день у нас нет каких либо данных, которые помогли бы более конкретно интерпретировать этот результат.
Второй вопрос - почему удаление гена SP-D приводит к такому существенному увеличению индукции HSP70 в М2 фенотипе. Пока мы также не можем ответить на этот вопрос без дополнительных экспериментов. Вместе с тем увеличенный синтез HSP70 в М2 фенотипе макрофагов SP-D (- / -) мышей является четким указанием на то, что по крайне мере в М2 фенотипе макрофагальный SP-D играет негативную роль в отношении ЛПС-индуцированного стресс-ответа макрофагов. Действительно, хорошо доказано, что SP-D может ограничивать взаимодействие ЛПС со своим рецептором TLR4 (Toll-like receptor 4) на поверхности макрофагов и, таким образом, ингибировать ЛПС-зависимую активацию NFkB [10]. Можно было бы предположить, что в М2 фенотипе макрофагов SP-D (- / -) мышей резкое увеличение синтеза HSP70 в ответ на действие ЛПС связано с отсутствием негативного контроля SP-D и более эффективным связыванием ЛПС с TLR4. Недостающими звеньями этой гипотезы является отсутствие данных о том, что ЛПС-индуцированный синтез HSP70 вовлекает активацию NFkB.
Дополнительный намек на то, почему удаление гена SP-D приводит к такому существенному увеличению индукции HSP70 в М2 фенотипе, возникает при сопоставлении наших данных о влиянии удаления гена SP-D на продукцию цитокинов IL-12 и IL-10 с изменением синтеза HSP70 в разных фенотипах макрофагов (рис. 3).
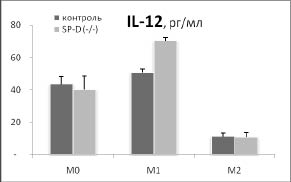
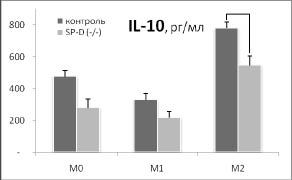
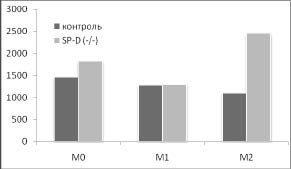
Рис. 3. Сопоставление влияния удаления гена SP-D на продукцию цитокинов и синтеза HSP70 в макрофагах М0, М1 и М2 фенотипов в ответ на действие 500 нг / мл ЛПС в течение 24 часов. Макрофаги были выделены из перитонеальной жидкости нормальных (контроль) и SP-D (- / -) мышей.
* - достоверность различий между контролем и SP-D (- / -).
Хорошо видно, что в отличие от IL-12, IL- 10 имеет четкую отрицательную корреляцию с изменением синтеза HSP70 в разных фенотипах при удалении гена SP-D. Можно предположить, что повышение синтеза HSP70 в М2 фенотипе макрофагов SP-D (- / -) мышей опосредовано снижением продукции IL-10. Это предположение поддерживают данные о том, что IL-10 действительно может угнетать индукцию HSP70 [6].
В целом наши данные еще раз подтверждают, что регуляторные эффекты SP-D зависят от фенотипа макрофагов, и свидетельствуют о важной роли SP-D в сопряжении и согласованной регуляции секреторной активности и клеточного стресс-ответа в макрофагах.
СПИСОК ЛИТЕРАТУРЫ
- Adams D. O., Hamilton T. A. Molecular basis of macrophage activation: diversity and its origins Lewis, C. E. McGee, J. O. eds. The Macrophage,1992, 75-114 Oxford University Press Oxford, UK.
- Atochina E., Beers M., Tomer Y. et al. Attenuated allergic airway hyperresponsiveness in C57BL / 6 mice is associated with enhanced surfactant protein (SP) -D production following allergic sensitization. Respir Res., 2003; 4: 15.
- Botas C., Poulain F., Akiyama J. et al. Altered surfactant homeostasis and alveolar type II cell morphology in mice lacking surfactant protein D. Proc.Natl.Acad. Sci. USA 95; 1998:11869-1187.
- Fisher J. H., Sheftelyevish V., Ho Y.-S. et al. Pulmonary-specific expression of SP-D corrects pulmonary lipid accumulation in SP-D gene-targeted mice. Am. J. Physiol. Lung Cell Mol. Physiol., 2000; 278: L365-L373.
- Guo C. J., Atochina-Vasserman E. N., Abramova H. et al. S-Nitrosylation of surfactant protein-D controls inflammatory function. PLoS Biology, 2004; 6 (11).
- Hoegl S., Boost K. A., Czerwonka H. et al. Inhaled IL-10 reduces biotrauma and mortality in a model of ventilator-induced lung injury. Respir Med., 2009; 103 (3): 463-70.
- Malyshev I. Yu., Kruglov S. V., Bakhtina L. Yu. et al. Stress response and apoptosis in pro- and antiinflammatory macrophages. Bulletin of Experimantal Biology and Medicine, 2004; 138 (8): 140-143.
- Martinez F. O., Sica A., Mantovani A. et al. Macrophage activation and polarization. Front Biosci., 2008; 13: 453-61.
- Wert S. E., Yoshida M., LeVine A. M. et al. Proceedings of the National Academy of Sciences of the United States of America 97, 2000: 5972-5977.
- Yamazoe M., Nishitani C., Takahashi M. et al. Pulmonary surfactant protein D inhibits lipopolysaccharide (LPS) -induced inflammatory cell responses by altering LPS binding to its receptors. J Biol Chem., 2008; 283 (51): 35878-88.



