В XXI век человечество вступило с высокой заболеваемостью туберкулезом. Предполагалось, что туберкулез останется одним из самых тяжелых заболеваний в мире до 2010 года [3]. Однако появление и быстрое распространение в мире туберкулеза с обширной лекарственной устойчивостью (XDR-TB) обусловило анонсирование новой стратегии ВОЗ, рассчитанной на период до 2015 года, центральным положением которой объявлено продолжение интенсивных исследований в области туберкулеза [9].
Ухудшение эпидемиологической ситуации привело к увеличению числа инфицированных туберкулезом лиц. Согласно официальным статистическим данным, за последнее 10-летие инфицированность туберкулезом детей в России увеличилась в 2,5 раза и в настоящее время в 10 раз превышает аналогичный показатель в развитых странах [1].
Персистирование жизнеспособных M. tuberculosis на протяжении всей жизни в зараженном организме определяет особенность инфекционного процесса - как малую болезнь, с длительным скрытым течением и постоянной угрозой развития заболевания при снижении сопротивляемости инфекции [8].
Обобщенное представление об этапности в патогенезе туберкулеза [4] возродило интерес среди исследователей к проблеме латентной (скрытой) туберкулезной инфекции (LBTI) в отличие от манифестной (явной).
Изучение методов диагностики LBTI по Национальным руководствам 50-ти стран показало, что кожный туберкулиновый тест применяется с этой целью, однако определить угрозу прогрессирования инфекции по нему не представляется возможным [6]. Чувствительность кожного теста снижена у людей с иммунодефицитом, специфичность его ограничена перекрестными антигенами MBT и BCG, интерпретация затруднена в условиях массовой вакцинации BCG [5]. Такое же отношение высказали многие авторы и к недавно разработанному методу диагностики LBTI ex vivo - IGRA, который измеряет продукцию IFNγ в ответ на специфические антигены микобактерий туберкулеза [2]. Они пришли к выводу о том, что туберкулиновый кожный тест и IGRA «не различают» активную и латентную инфекцию. К тому же туберкулиновые пробы и результаты IGRA плохо коррелируют из-за позитивного результата кожного теста у лиц, вакцинированных BCG [7].
Цель исследования
Разработать способ определения риска прогрессирования латентной туберкулезной инфекции у детей с учетом генетической устойчивости/предрасположенности к заболеванию.
Материалы и методы
В ходе работы сформированы следующие клинические группы:
Дети славянской национальности, больные различными формами туберкулеза органов дыхания - 129 человек.
Дети с латентной туберкулезной инфекцией (LTBI), здоровые инфицированные - 118 человек славянской национальности.
С целью формирования группы контроля для молекулярно-генетических исследований проведена случайная выборка из новорожденных популяции славянской национальности. Отобрано 109 здоровых новорожденных детей с отсутствием у родителей рентгенологических признаков локального туберкулеза органов дыхания.
Контролем для сравнительного исследования цитокинового профиля служили результаты исследования у 30 здоровых неинфицированных детей из регионального банка данных кафедры аллергологии и иммунологии КГМУ.
У всех детей проводили общепринятый комплекс клинико-лабораторного обследования с применением обязательных, дополнительных и факультативных методов исследования. В каждом случае обращали внимание на семейный анамнез и возможный контакт с больными туберкулезом.
Генотипирование локуса DRB1HLA и локуса INT4 NRAMP1 проводили по методике C. Søborg et al. (2002).
Концентрацию IL-4, IL-10, IL-18 и IFN-γ определяли в сыворотке крови иммуноферментным методом с использованием наборов CYTELISATM («Cytimmune», США). Оценку результатов проводили на иммуноферментном анализаторе ANTHOS 2010 (фирма «Becton Dickinson», США).
Статистическую обработку полученных результатов проводили методом вариационной статистики на основе анализа абсолютных и относительных величин. Наличие взаимосвязи между группами и ее достоверность оценивали с помощью статистики хи-квадрат, включающей поправку на непрерывность Иэйтса [http://www.biometrica.tomsk.ru]. Различия или показатели считали значимыми при уровне р<0,05. Обработку полученного материала проводили с использованием программ Microsoft Excel и STATISTICA.
Результаты исследования и их обсуждение
Исследование ассоциации антигенов системы HLA локуса DRB1у детей, больных локальными формами туберкулеза органов дыхания, показало, что для них характерно увеличение частоты встречаемости аллельных специфичностей *04 и *16 по сравнению со здоровыми новорожденными детьми из популяции в 4,4 и 3,5 раза и здоровыми детьми, инфицированными микобактериями туберкулеза, в 2,2-1,6 раза соответственно (р<0,05) (рис.1).
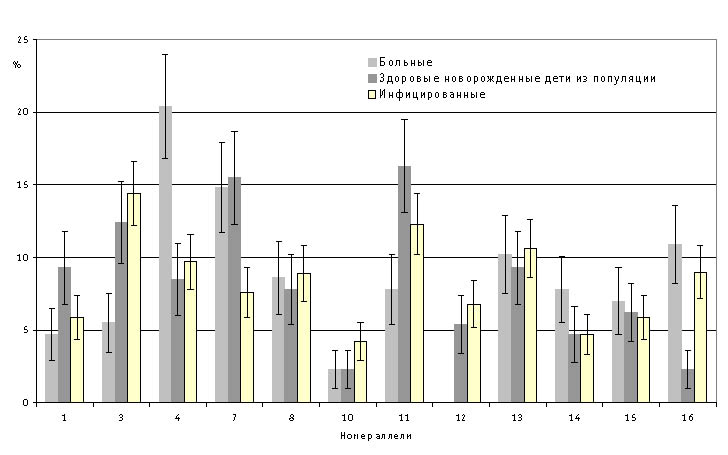
Рис. 1. Частота встречаемости аллелей гена HLA локуса DRB1 у больных туберкулезом, здоровых новорожденных из популяции и инфицированных МБТ детей
Частота встречаемости аллелей *03 и *11 среди здоровых новорожденных детей из популяции по сравнению с больными повышена: *03 в 3,9, *11 - в 5 раз, а среди здоровых, инфицированных МБТ - в 3,1 и в 3,9 раза соответственно (р<0,05). Аллель *12 встретилась только у здоровых и совсем отсутствовала у больных детей. В то же время в группе больных туберкулезом органов дыхания и у здоровых, как новорожденных, так и инфицированных МБТ детей, установлена одинаковая (48,2 и 47,9% соответственно против 55,4%) частота встречаемости аллельных специфичностей гена HLA локуса DRB1 *01, *07, *08, *10, *13, *14, *15 (р>0,05).
Полученные результаты исследования позволили нам рассматривать аллельные специфичности в генотипе HLA DRB1 *03, *11, *12 как генетические факторы устойчивости, а *04 и *16 - как генетические факторы предрасположенности к заболеванию туберкулезом. Обнаруженные в значительном количестве аллельные специфичности HLA DRB1, одинаково часто встречающиеся у больных и здоровых детей, мы назвали нейтральными и отнесли к этой группе аллели *01, *07, *08, *10,*13, *14, *15.
Следует отметить полное отсутствие у жителей Краснодарского края специфичностей HLA DRB1 *02, *05, *06, *09.
Сравнительный анализ вариантов генотипа, то есть сочетания двух аллелей системы HLA DRB1 локуса, на устойчивость/ предрасположенность у детей, заболевших локальным туберкулезом, в сравнении со здоровыми новорожденными из популяции и здоровыми, инфицированными МБТ показал, что для больных больше характерен наследственный фактор парности двух аллелей DRB1 *04/*04, *04/*16, *16/*16 с маркерным признаком предрасположенности к заболеванию (17,8%), тогда как у здоровых новорожденных детей из популяции подобные наследственные компоненты вообще не обнаружены, а у здоровых инфицированных МБТ, составили 9,3% (р<0,05).
Кроме того, среди больных детей сочетание специфичностей с признаками, ассоциированными с высокой вероятностью развития туберкулеза - DRB1 *04 и*16, с аллелями, имеющими другие признаки (устойчивости, нейтральности), обнаружено в 2 раза чаще по сравнению с группой здоровых новорожденных и здоровых, инфицированных МБТ детей (38,0±4,2 против 18,3±3,7 и 18,6±3,5 соответственно, р<0,05).
Наличие в генотипе здоровых новорожденных из популяции и здоровых, инфицированных МБТ детей, сочетания антигенов HLA, которые обусловливают устойчивость к туберкулезу - DRB1 *03, *11, *12 в 5,5 и 4,3 раза (61,5±4,6 и 53,4±4,5 соответственно против 12,5±2,5%, р<0,05) превышает таковую у больных. Одновременно генотип, состоящий из двух разных специфичностей, включающий аллель с маркерным признаком предрасположенности, встречается в 4 и 3 раза чаще у больных по сравнению со здоровыми новорожденными детьми из популяции и здоровыми, инфицированными МБТ (55,8±4,3 против 18,3±3,7 и 18,6±3,5%, р<0,05). В то же время у здоровых детей по сравнению с больными, сочетания специфичностей с маркерным признаком устойчивости и с признаком нейтральности обнаружены чаще в 7,8 и 6 раза соответственно (36,7 и 30,5 против 4,7%, р<0,05), что может свидетельствовать о разграничении «значимого» и «незначимого» антигена HLA, определяющего устойчивость/предрасположенность к заболеванию.
Вместе с тем существенной разницы между изучаемыми показателями в контрольной группе новорожденных из популяции и в группе здоровых, инфицированных МБТ детей не установлено, кроме полного отсутствия генотипа HLA DRB1 с наличием обеих аллелей предрасположенности к заболеванию у новорожденных.
Генетическое сочетание аллелей, наделенных маркерными признаками нейтральности - DRB1 *01, *07, *08, *10, *13,*14, *15, обнаруживалось у больных так же часто, как и у здоровых новорожденных детей из популяции и здоровых, инфицированных МБТ (36,4 против 26,6 и 28,0%, р>0,05).
Анализ вариантов генотипа DRB1 с сочетанием антигенов устойчивости и предрасположенности показал, что количественный показатель сочетания этих наследственных компонент только у здоровых новорожденных детей из популяции существенно превосходит таковой у больных (11,9 против 4,7%, р<0,05).
Таким образом, результаты исследования позволяют прийти к выводу о влиянии наследственной компоненты HLA DRB1 локуса на прогрессирование возникшей туберкулезной инфекции.
В ходе изучения ассоциации полиморфизмов генов-кандидатов проведено исследование одной из самых распространенных мутаций гена NRAMP1 - в интроне 4 (INT4).
Прежде всего мы установили частоту встречаемости аллельных специфичностей NRAMP1 INT4 у наблюдаемых детей (табл. 1).
Таблица 1
Частота встречаемости аллельных специфичностей NRAMP1 локуса INT4 у здоровых и больных туберкулезом детей (%, М±m), n=356
|
Аллели |
Частота встречаемости аллельных специфичностей |
|||||||
|
у здоровых новорожденных детей из популяции |
у здоровых инфицированных МБТ детей |
у больных туберкулезом детей |
всего |
|||||
|
абс. |
%±m |
абс. |
%±m |
абс. |
%±m |
абс. |
%±m |
|
|
C |
83 |
38,1±2,3** |
90 |
38,1±3,1** |
53 |
20,5±2,5 |
226 |
31,7± |
|
G |
135 |
61,9±2,3 |
146 |
61,9±3,1 |
205 |
79,5±2,8* |
486 |
68,3± |
|
Итого |
218 |
100 |
236 |
100 |
258 |
100 |
712 |
100 |
* достоверность по отношению к здоровым, p<0,05;
** достоверность по отношению к больным, p<0,05
Из представленного видно, что аллель G в локусе INT4 гена NRAMP1 обнаружена в 68,3% случаев. Аллель C вообще более редко встречается - на нее приходится 31,7%, что в 2,2 раза меньше по сравнению с аллелью G. В то же время у здоровых детей показатель частоты встречаемости аллели C существенно выше (38,1%) по сравнению с больными, у которых она встретилась в 20,5% (р<0,05). Несмотря на то, что аллель G отличается более частой встречаемостью у всех детей, все же разница между здоровыми и больными детьми прослеживается. В частности, у больных детей она встретилась в 79,5% случаев, у здоровых - в 61,9%.
Исследование наиболее часто встречаемых генотипов NRAMP1 - в интроне 4 (INT4) - C/C, C/G и G/G показало, что среди здоровых детей, как новорожденных из популяции, так и инфицированных МБТ, встречается генотип C/G на 14,8% - 13,1% (55,9 и 54,2 против 41,1%, p<0,05) чаще по сравнению с больными. В то же время гомозиготный генотип С/С у детей с локальным туберкулезом не был обнаружен вовсе, а в группе здоровых он встретился в 10,2% и 11,0% случаев соответственно (рис. 2). Гомозиготный генотип G/G более часто (на 25,0 и 24,1% соответственно) обнаружен у больных детей, по сравнению со здоровыми при этом различие достоверно (р<0,05).
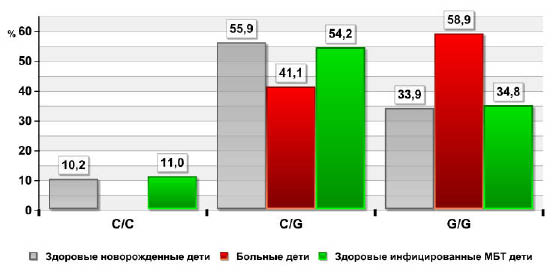
Рис. 2. Частота встречаемости генотипов локуса INT 4 гена NRAMP 1 у больных туберкулезом и здоровых детей
С целью получения дополнительных сведений о роли генов-кандидатов в формировании наследственной компоненты устойчивости/ предрасположенности к туберкулезу мы провели сопоставительный анализ частоты встречаемости аллельных специфичностей NRAMP1 среди детей, у которых в HLA системе превалирующими являются те или иные антигены. Так, в 53,9% случаев встречаемости HLA аллелей устойчивости регистрируется вариант C/G NRAMP1, в 31,1% - вариант G/G и в 15,0% - вариант C/C. Из всех случаев встречаемости аллелей предрасположенности в 57,6% обнаружен вариант G/G, в 42,4% - вариант C/G (табл. 2).
Таблица 2
Соотношение аллельных специфичностей HLA локуса DR B1 и генотипов NRAMP 1 INT4 n=356 (%, М±m)
|
Генотипы |
Аллельные специфичности системы HLA DRB1 |
|||||||
|
устойчивости |
предрасположенности |
нейтральности |
Всего |
|||||
|
абс. |
%±m |
абс. |
%±m |
абс. |
%±m |
абс. |
%±m |
|
|
C/G |
104 |
53,9±3,5 |
67 |
42,4±3,9 |
185 |
51,2±2,6 |
356 |
50,0±1,8 |
|
G/G |
60 |
31,1±3,3 |
91 |
57,6±3,9 |
157 |
43,5±2,6 |
308 |
43,3±1,8 |
|
C/C |
29 |
15,0±2,5 |
- |
- |
19 |
5,3±1,1 |
48 |
6,7±0,9 |
|
Итого |
193 |
100 |
158 |
100 |
361 |
100 |
712 |
|
Очевидно, что генотип G/G в локусе INT4, существенно чаще сочетающийся с аллелями HLA DRB1, предрасполагающими к заболеванию, может быть одним из главных претендентов на прогностический индикатор прогрессирования возникшей туберкулезной инфекции. В противоположность этому генотипы C/C и C/G, обнаруживаемые в 68,9±3,3% случаев в сочетании с аллелями устойчивости, по-видимому, обладают возможностью стабилизировать возникшую туберкулезную инфекцию путем ограничения репликации микобактерий.
Выводы
Исследование генетических факторов главного комплекса гистосовместимости (HLA) и гена естественного, связанного с резистентностью белка макрофагов (NRAMP1), позволяет определить, насколько реальна угроза прогрессирования туберкулезной инфекции у детей после ее возникновения.
Генетическая предрасположенность к туберкулезу у детей славянской национальности Краснодарского края связана с аллелями *04 и *16, генетическая устойчивость - с аллелями *03, *11, *12 системы HLA локуса DR B1.
Исследование гена-кандидата NRAMP1 показало, что генотип С/С локуса INT4 является наследственной компонентой, определяющей устойчивость к туберкулезной инфекции. Сочетание генотипа G/G локуса INT4 гена NRAMP1 со специфичностями гена HLA, которым присущи признаки предрасположенности к заболеванию - *04 и *16 и нейтральности - *01, *07, *08, *10, *13, *14, *15, определяет высокий уровень риска прогрессирования туберкулезной инфекции.
СПИСОК ЛИТЕРАТУРЫ
- Аксенова В.А. Внелегочные формы туберкулеза у детей в России // Репродуктивное здоровье детей и подростков: научно-практический журнал. - 2007. - N 3. - С. 21-25.
- Bakir M., Millington K.A., Soyal A. et al. Prognostic value of a T-cell-based, interferon-γ biomarker in children with tuberculosis contact. // Ann. Intern. Med. - 2008; 149: 777-787.
- Dye C. Tuberculosis 2000-2010: control, but not elimination. // Int. J. Tuberc. Lung Dis. - 2000; 4 (Suppl.). - P. 146-52.
- Dannenberg A.M., Jr. Immune mechanisms in the pathogenesis of pulmonary tuberculosis // Rev. Infect. Dis. - 1989. - 11(Suppl. 2). - P. 369-378.
- Lalvani A., Millington K.A. T-cell based diagnosis of childhood tuberculosis infection.// Curr. Opin. Infect. Dis. - 2007; 20:264-271.
- Mack U., Migliori G.B., Sester M. et al. LTBI: latent tuberculosis infection or lasting immune reponses to M. tuberculosis? A TBNET consensus statement // Eur. Respir. J. - 2009; 33: 956-973.
- Pai M., Menzies D. Interferon-γ release assays: what is their role in the diagnosis of active tuberculosis? // Clin. Infect. Dis. - 2007; 44: 74-77.
- Rook G.A., Zumla A. Advances in the immunopathogenesis of pulmonary tuberculosis // Curr Opin Pulm Med. - 2001; 7: 116-123.
- World Health Organization. Guidelines for management of drug-resistant Tuberculosis. WHO/HTM/TB/2006.361. - Geneva, World Health Organization, 2006.



