Интоксикации дихлорэтаном (ДХЭ), который отличается высокой токсичностью и куммуляционной способностью, чаще всего встречаются на производстве, где растворитель находит широкое применение. При сохраняющейся высокой летальности от острых интоксикаций ДХЭ основную массу составляют отравления, наблюдаемые при длительном поступлении токсиканта в организм, когда явной клинической симптоматики может и не возникнуть.
Картина острых отравлений химической этиологии уже в ранние сроки формируется не только за счет высоких концентраций яда в крови, но и зависит от развития эндогенной интоксикации [4]. В то же время развитие эндотоксикоза при длительном поступлении яда в организм, патофизиологические изменения, нарушающие гомеостаз, происходящие в эти сроки, изучены далеко не полно. Одним из важных патогенетических факторов в данном аспекте является перекисное окисление липидов (ПОЛ) - универсальный механизм, регулирующий клеточные процессы как в норме, так и при патологии. В настоящее время ПОЛ рассматривается как весьма эффективный показатель изменения гомеостаза, позволяющий судить об интенсивности протекающих патологических процессах. В ряде исследований показана тесная взаимосвязь между прогрессированием синдрома эндогенной интоксикации и интенсификацией процессов ПОЛ, которые наряду с активацией мембранных фосфолипаз ведут к дестабилизации клеточной мембраны вследствие перестройки ее липидного бислоя. Состояние клеточных мембран может отражать степень эндотоксикоза как показатель суммарного влияния всех мембраноповреждающих факторов на клетку. В работах многих авторов установлена тесная корреляция между изменениями свойств мембран эритроцитов и клеточных мембран внутренних органов. Поэтому можно использовать эритроцитарные мембраны в качестве естественной модели для исследования общих характеристик всех биологических мембран [7].
В рамках проблемы коррекции при хронической интоксикации ДХЭ остаются нерешенными научно-практические вопросы. Определенный интерес представляет метод лазерной терапии с использованием низкоэнергетических источников облучения. При исследовании механизмов биологического и терапевтического действия НИЛИ было показано нормализующее влияние его на ПОЛ [9]. В связи с этим целью исследования явилось изучение интенсивности эндотоксикоза, ПОЛ, антиоксидантной защиты и состояния мембран эритроцитов при субхронической интоксикации ДХЭ до и после коррекции лазерным излучением.
Материалы и методы
Эксперименты выполнены на 36 здоровых половозрелых неинбредных белых крысах-самцах массой 180-220 г, разделенных на 3 группы: 1-я - контрольная (n=11), 2-я - животные с моделированной интоксикацией дихлорэтаном (n=13), 3-я - животные, получавшие ДХЭ и НИЛИ (n=12). Эксперименты проводились в соответствии с требованиями приказов №1179 МЗ СССР от 10.10.83 г., № 267 МЗ РФ от 19.06.03 г. «Правила проведения работ с использованием экспериментальных животных», «Правила по обращению, содержанию, обезболиванию и умерщвлению экспериментальных животных».
Субхроническая интоксикация дихлорэтаном достигалась ежедневным энтеральным введением токсиканта в дозе 5 мг/кг (0,01 LD 50) в течение 30 суток. Опытная группа крыс получала курс сочетанного воздействия импульсного НИЛИ с длиной волны 0,63 и 0,89 мкм. Использовался аппарат АЛТ «Матрикс» с зеркальной насадкой для воздействия в области печени контактной методикой (0,89 мкм, импульсная мощность - 7 Вт, частота - 80 Гц, доза - 0,01 Дж/см2) и аккупунктурной насадкой для надвенного облучения крови в области хвостовой вены (0,63 мкм, импульсная мощность 5 Вт, частота - 80 Гц, доза - 0,12 Дж/см2). Курс лазеротерапии начинали со 2-й недели и продолжали 14 дней. Объектом исследования служили эритроциты и плазма крови. Тестирование осуществляли на 30 сутки.
Состояние ПОЛ оценивали по концентрации диеновых конъюгатов (ДК) и малонового альдегида. Содержание диеновых конъюгатов определяли методом прямой спектрофотометрии. Принцип метода заключается в выделении нативных жирных кислот путем экстракции смесью равных объемов гептана и изопропанола с последующим измерением оптической плотности проб изопропаноловой фазы липидного экстракта. Поглощение при длине волны 232 нм отражает содержание диеновых конъюгатов [2]. Для определения малонового диальдегида (МДА) использовали метод M.Mihara (1980), заключающийся в образовании окрашенного комплекса при взаимодействии продуктов ПОЛ с тиобарбитуровой кислотой, с помощью стандартного набора фирмы Агат-Мед (Россия). Одновременно с процессами ПОЛ регистрировали активность ферментов каталазы [3], супероксидисмутазы [5], глюкозо-6- фосфатдегидрогеназы [10]. Систему водорастворимых антиоксидантов оценивали, определяя содержание церулоплазмина в плазме крови, учитывая его способность окислять p-фенилендиамин с образованием окрашенного комплекса, а также определяя содержание восстановленного глутатиона в эритроцитах, учитывая его способность реагировать с избытком аллоксана с образованием соединения, имеющего максимум поглощения при длине волны 305 нм, применяя для этого методики, изложенные в руководствах по биохимическим методам исследования.
Состояние мембран эритроцитов оценивали по их стойкости к гемолитическому действию соляной кислоты. Для этого применяли метод кислотных эритрограмм, предложенный Н.Н. Гительзоном и И.А. Терсковым (1959).
Вычислялся индекс стойкости эритроцитов (I) по формуле:
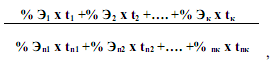 ,
,
где % Эn x tn - произведение процента гемолизированных эритроцитов данной группы на время гемолиза, определяющее стойкость этой группы в нормальной крови;
% Э x t - произведение процента гемолизированных эритроцитов данной группы на время гемолиза в исследуемой крови.
Для оценки интенсивности эндотоксикоза определяли содержание веществ низкой и средней молекулярной массы (ВНиСММ) в эритроцитах и плазме крови по методике, предложенной М.Я. Малаховой [6]. Регистрировали спектральную характеристику водного раствора супернатанта при длинах волн от238 до 306 нм. Расчет ВНиСММ проводили по формуле: ВНиСММ = (Е238 + Е242+ +...+Е306) ˣ 4 (усл. ед.)
Фракции фосфолипидов(ФЛ) получали методом тонкослойной хромотографии [8]. Количество отдельных фракций ФЛ определяли по содержанию липидного фосфора и выражали в процентах. Общие ФЛ вычисляли по сумме отдельных фракций.
Обработку полученных результатов проводили с применением методов вариационной статистики. В сравниваемых группах определяли средние величины (М), ошибку средних величин (m). Оценку достоверности проводили по критерию Стьюдента (t).Минимальный уровень достоверности верифицировали при р<0,05. Математическую обработку выполняли на компьютере с применением программного обеспечения Microsoft Excel.
Результаты и обсуждение
Результаты наших исследований представлены в табл. 1, из которой видно, что ДХЭ, введенный по указанной схеме, повышает активность свободнорадикального окисления, что подтверждается увеличением концентрации в эритроцитах продуктов ПОЛ-диеновых конъюгатов в 1,94 раза (р<0,05) и МДА в 2,03 раза (р<0,05) от нормальных показателей. Важную роль в регуляции процессов ПОЛ играют антиоксидантные ферменты, такие, как супероксиддисмутаза (СОД) и каталаза. СОД катализирует реакцию взаимодействия двух супероксидных радикалов, играющих важную роль в инициации свободнорадикального окисления, с образованием перекиси водорода и молекулярного кислорода. Проведенные исследования установили повышение активности СОД в эритроцитах на 28,1% (р<0,05), что свидетельствует о мобилизации защитно-приспособительных механизмов, связанных с избыточной продукцией супероксидного анион-радикала. Избыточная активность СОД ведет к повышенному образованию перекиси водорода. В свою очередь, перекись водорода может быть использована фагоцитами для синтеза гипохлорита либо диффундировать в клетки и разрушаться там каталазой и глутатионпероксидазой, либо в присутствии железа разрушаться с образованием гидроксильного радикала. При этом, по нашим данным, активность каталазы увеличивается незначительно, что может быть связано с повышенной концентрацией водородных ионов, приводящих к возникновению протонированной формы фермента, обладающего измененной каталитической активностью.
Таблица1
Влияние НИЛИ на ПОЛ, на активность антиокислительной системы и показатели эндогенной интоксикации в крови крыс при субхронической интоксикации дихлорэтаном (M±m)
|
Показатель |
Животные 1-й группы (n=6) |
Животные 2-й группы (n=7) |
Животные 3-й группы (n=6) |
|
ДК, (λ=232нм) усл. ед. на 1мл крови |
1,8±0,16 |
3,5±0,19* |
2,15±0,2 ^ |
|
ТБК-РП, мкмоль на литр |
3,1±0,3 |
6,3±0,7* |
4,8±0,5* ^ |
|
Каталаза, ммоль в мин на 1 мг гемоглобина |
92,7±4,8 |
102,3±5,1 |
89,6±6,3 |
|
СОД, усл. ед. на 1 мг гемоглобина |
1,9±0,09 |
2,43±0,13* |
2,1±0,14 ^ |
|
Г6ФДГ, нмоль в мин на 1мг гемоглобина |
14,5±0,4 |
12,1±0,55* |
15,7±0,43* ^ |
|
Глутатион восстановленный, мг% |
78,3±5,1 |
60,1±7,3* |
72,1±4,2 |
|
Церулоплазмин, мг% |
16,2±2,1 |
29,7±2,8* |
21,7±3,2 ^ |
|
ВНиСММ плазмы, усл.ед. |
5,8±0,19 |
7,2±0,5* |
6,1±0,4 |
|
ВНиСММ эритроцитов, усл.ед. |
18,5±1,5 |
26,3±2,9* |
19,7±2,1 ^ |
Примечание:* - достоверно (p<0,05) по сравнению с первой (контрольной) группой;
^ - достоверно (р<0,05) 3-й группы по сравнению со 2-й группой
В проведенном исследовании установлено снижение активности глюкозо-6-фосфатдегидрогеназы (Г6ФДГ) на 16,6% (р<0,05), а также содержание восстановленного глутатиона на 23,2% (р<0,05). Глутатион участвует как в индуцированной глутатионпероксидазной реакции, так и в поддержании восстановленного состояния сульфгидрильных групп белковых молекул, редокс-статуса клетки в целом. Соотношение окисленных и восстановленных форм глутатионовой системы зависит от скорости реакции пентозного цикла, ключевым ферментом которого является Г6ФДГ. Выявленные изменения со стороны глутатион опосредованной детоксикации значительно снижают резистентность клеток к цитоповреждающему действию продуктов ПОЛ, свободных радикалов.
В системе неферментативного звена антиоксидантной защиты биологических молекул важная роль принадлежит церулоплазмину (ЦП), представляющему собой медьсодержащий гликопротеид α2 глобулиновой фракции сыворотки крови, синтезируемый, главным образом, в печени. В результате проведенных исследований установлено повышение содержания церулоплазмина на 83,3 % (р<0,05). Известно, что уровень ЦП возрастает при воспалительных процессах, что отражает его роль в организме в качестве белка острой фазы, и в значительной мере противовоспалительное действие его обусловлено антиоксидантными свойствами. ЦП обладает способностью к дисмутации супероксидных радикалов, а также окисляет Fe+2 до Fe+3 кислородов в плазме крови без образования свободных радикалов.
Таким образом, в ходе проведенных исследований при субхронической интоксикации ДХЭ выявлена активация свободнорадикального окисления на фоне дисбаланса антиоксидантной системы. В настоящее время признается, что именно ПОЛ по своей практической значимости и реакционной способности занимает важное место среди факторов продукционной эндогенной интоксикации. Проведенные исследования выявили увеличение содержания ВНиСММ в плазме крови и в эритроцитах к 30 суткам на 24,1 % (р<0,05) и на 42,2 % (р<0,05) соответственно. Умеренное повышение концентрации ВНиСММ в плазме и эритроцитах свидетельствует о компенсированной фазе интоксикации, при которой наблюдается увеличение сорбционной способности эритроцитов.
Повышенный фон перекисеобразования отрицательно воздействует на структурно-функциональную характеристику биологической мембраны. В настоящей работе определили стабильность клеток крови к действию водородных ионов. Известно, что при этом выявляются скрытые повреждения эритроцитарных мембран. Результаты исследования свидетельствуют о том, что индекс стойкости, характеризующий суммарную резистентность эритроцитов, у крыс с интоксикацией ДХЭ снижался к 30 суткам до 0,74 усл.ед.
В стабилизации биомембран существенное место занимают фосфолипиды, которые сами по себе являются субстратами для свободнорадикального окисления. При интоксикации ДХЭ в эритроцитах уменьшается содержание общих фосфолипидов (ФЛ) на 23,2%(р<0,05). Анализ фосфолипидного состава, представленный в табл. 2, выявил снижение содержания легкоокисляемых фракций фосфатидилхолина (ФХ) и фосфатидилэтаноламина (ФЭА) на 15,5% (р<0,05) и 22,4% (р<0,05) соответственно. Одновременно отмечался рост относительного содержания трудноокисляемой фракции сфингомиелина (СфМ) на 62,3% (р<0,05) и увеличение содержания лизофосфатидилхолина (ЛФХ) на 70% (р<0,05), разрыхляющих липидный слой мембран, увеличивая их проницаемость. Увеличению проницаемости также способствовало наблюдаемое снижение ФХ и ФЭА. В повреждении биомембран особая роль отводится ЛФХ, который является специфическим маркером фосфолипазной активности. При интоксикации ДХЭ активация фосфолипазного гидролиза наряду с активацией ПОЛ является дополнительным фактором модификации клеточных мембран, так как окисленные ФЛ легче поддаются атакам эндогенных фосфолипаз, что усиливает их мембранодеструктивное действие.
На основании вышеизложенного можно заключить, что в патогенезе эндогенной интоксикации при субхроническом поступлении ДХЭ важная роль принадлежит мембранодеструктивным процессам. Нарушение структурно-функциональной организации клеточных мембран изменяет внутриклеточный гомеостаз и определяет основные патофизиологические проявления эндотоксикоза.
Таблица 2
Фосфолипидный состав мембран эритроцитов у крыс при субхронической интоксикации дихлорэтаном и на фоне применения НИЛИ (M±m)
|
Исследуемый показатель |
Группы животных |
||
|
1-я группа(n=5) |
2-я группа(n=6) |
3-я группа(n=6) |
|
|
Общие ФЛ мг/100 мл эр. массы |
234,5±9,8 |
180,1±11,2 * |
207,5±8,5 * ^ |
|
Фракции ФЛ, % |
|||
|
ЛФХ |
6,4±0,62 |
10,88±0,79 * |
8,3±0,85 * ^ |
|
ФХ |
52,3±2,3 |
44,2±1,3 * |
49,6±2,5 ^ |
|
ФЭА |
26,1±1,2 |
20,25±1,4 * |
23,2±1,6 |
|
СфМ |
15,2±1,3 |
24,57±1,2 * |
18,9±1,45 * ^ |
* - различие достоверно (р<0,05) по сравнению с 1-й группой (контроль); ^ - различие достоверно (р<0,05) 3-й группы по сравнению со 2-й группой
Курсовое применение НИЛИ, проведенное у животных 3-й экспериментальной группы, оказало антиоксидантный, противоперекисный и мембраностабилизирующий эффекты. Уровень ДК уменьшился на 38,6% (р<0,05) и МДА на 23,8 % (р<0,05) по сравнению с данными 2-й группы, а активность каталазы и СОД приближалась к исходным значениям. Влияние лазерного излучения на ферментативную активность подтверждают данные литературы о возможных механизмах НИЛИ влиять на активность данных ферментов за счет депротонирования соответствующих гистидиновых остатков и последующего восстановления нативной структуры активного центра [1]. Важно отметить статистически достоверную тенденцию к нормализации содержания восстановленного глутатиона и активности Г6ФДГ после проведения курса НИЛИ. Г6ФДГ является ключевым ферментом пентозного цикла, в ходе которого генерируется НАДФН. Данное соединение предохраняет ненасыщенные жирные кислоты, входящие в состав клеточной мембраны, от аномальных взаимодействий с кислородом, поддерживает нормальную степень окисления атомов железа гемоглобина, является субстратом для глутатионредуктазы.
НИЛИ усиливает кислотную устойчивость эритроцитов к гемолитическому действию соляной кислоты. Индекс стойкости эритроцитов к 30 суткам повышался в 1,3 раза (р<0,05) по сравнению с данными животных 2-й группы, приближаясь к контрольным значениям. НИЛИ изменяет липидный состав мембран эритроцитов. Это проявляется в том, что повышается содержание фосфолипидов, а количество отдельных фосфолипидных фракций приближается к исходному уровню. Уменьшение содержания ЛФХ отражает существенное снижение процессов ПОЛ и, по всей видимости, активности фосфолипаза А2 . Уровень ФЭА выравнивался, относительное содержание ФХ приближалось к контрольным значениям, а именно, эти фракции ФЛ наиболее лабильные к фосфолипазному гидролизу.
Заключение
Таким образом, применение НИЛИ при субхронической интоксикации ДХЭ, нормализуя баланс ПОЛ и антиокислительной системы, способствует сохранению структуры и функции клеточных мембран и, в свою очередь, поддержанию приемлемого уровня естественных процессов в организме, включая дезинтоксикационные. Подобное обстоятельство можно объяснить необходимым уровнем запаса эндогенных (тканевых) антиоксидантов, реактивация которых оказывается достаточной для нормализации баланса про- и антиокислительной активности.
СПИСОК ЛИТЕРАТУРЫ
- Владимиров Ю.А. Три гипотезы о механизме действия лазерного излучения на организм человека // Эфферентная медицина. - М.: Медицина, 1994. - С. 51-56.
- Волчегорский И.А., Налимов А.Г., Яровинский Б.Г., Лифшиц Р.И. Сопоставление различных подходов к определению продуктов перекисного окисления липидов в гептан-изопропанольных экстрактах крови // Вопр. мед. химии. - 1989. - № 1. - С. 127-130.
- Королюк М.А., Иванова Л.И., Майорова И.Г. Метод определения активности каталазы // Лаб. дело. - 1988. - № 1. - С. 16-18.
- Лужников Е.А., Гольдфарб Ю.С., Марупов А.М. Эндотоксикоз при острых экзогенных отравлениях. - М.: БИНОМ, 2008. - 200 с.
- Макаренко Е.В. Комплексное определение активности супероксиддисмутазы и глутатионредуктазы в эритроцитах у больных с хроническими заболеваниями печени // Лаб. дело. - 1988. - № 11. - С. 48-50.
- Малахова М.Я. Методы регистрации эндогенной интоксикации. - СПб.: МАПО, 1995. - 32с.
- Михайлович В.А., Марусанов В.Е., Бичун А.Б., Доманская И.А. Проницаемость эритроцитарных мембран и сорбционная способность эритроцитов - оптимальные критерии тяжести эндогенной интоксикации // Анестезиология и реаниматология. - 1993. - № 5. - С. 66-69.
- Молочкина Е.М. Количественное определение состава фосфолипидов методом тонкослойной хроматографии // Исследование синтетических и природных антиоксидантов in vitro и in vivo. - М.: Наука, 1992. - С.100 - 102.
- Москвин С.В. Эффективность лазерной терапии. - М.: НПЛЦ «Техника», 2003. - 254 с
- Glock G., MeLean P. Further studies on the properties and assay of glucose-6-phosphate dehydrogenase and 6-phosphogluconate dehydrogenase of rat liver // Biochem. - 1953. V. 55, № 3. - P. 400-408.



