Кишечные инфекции - группа заболеваний вирусной, бактериальной природы, для которых характерен фекально-оральный механизм передачи, с синдромом общей интоксикации, диарейным синдромом, склонностью к развитию дегидратации различной степени выраженности. Заболеваемость кишечными инфекциями неустановленной этиологии в Российской Федерации стабильно превышает показатель 100 на 100 тысяч населения [13].
Вирусные кишечные инфекции в большинстве случаев имеют не только фекально-оральный, но и воздушно-капельный путь передачи. Кишечные инфекции бактериальной природы с фекально-оральным механизмом передачи наблюдаются у детей первых 5 лет жизни. В последние годы отмечается тенденция к росту острых кишечных инфекций (ОКИ) у детей. В возрастном аспекте большинство (70%) составляют дети до 5-ти лет. Среди ОКИ расшифрованной этиологии 55,8% составляют ОКИ условно патогенной флоры, наметился рост (35%) ротавирусной инфекции, увеличивается заболеваемость в крупных городах с многочисленными контактами детей, проявляясь симптомокомплексом гастроэнтерита на фоне условно-патогенной флоры (18%). Сочетание ротавирусной инфекции (1,4%) с ОКИ шигеллезной этиологии составляет от 0,5 до 6,5%, по тяжести заболевания преобладают среднетяжелые формы кишечной инфекции, тяжелые формы чаще встречаются при сочетании ротавирусной инфекции с сальмонеллезом [11,28]. Основной причиной ОКИ у детей раннего возраста являются вирусы из разных таксонов (рота 35%,-норо- 16.7%,-астровирусы - 6.2%)[ 32].
Бесконтрольное и необоснованно длительное применение антибиотиков способствует продолжительной дисфункции кишечника, развитию антибиотик-ассоциированных диарей и глубоких дисбиотических нарушений [29]. Заболевания пищеварительного тракта характеризуются развитием дефицита факторов местного иммунитета, снижением противо- и провоспалительных цитокинов, уровня лизосомальнокатионного белка, обеспечивая тяжесть и активность воспалительного процесса [24]. Этиотропная терапия вирусных кишечных инфекций у детей остается малоразработанной. При внедрении патогена в организме происходит снижение иммунорезистентности, нарушаются процессы переваривания и всасывания, возникает транзиторный иммунодефицит с развитием интерферонодефицита, обусловливая затяжное и хроническое течение кишечных инфекций [1,19].
При негладком течении кишечной инфекции дисбаланс про- и противовоспалительных цитокинов характеризуется преобладанием Th-2 иммунного ответа, сохраняясь на протяжении всего заболевания. Среди бактериальных кишечных инфекций особое внимание привлекают шигеллы, обладающие высокими инвазивными и патогенными характеристиками. Сегодня доминируют штаммы Флекснер 2а и 3а, поэтому клиника заболевания характеризуется преобладанием среднетяжелых и тяжелых форм инфекции, наблюдается выраженный интоксикационный синдром с длительным бактериовыделением, явлениями гемо- и энтероколита, при бактериологическом исследовании выявляется Sh.zonnae 2g. Сальмонеллезы являются ведущими в этиологической структуре острых кишечных инфекций бактериальной этиологии, при затянувшейся санации от возбудителя нарушаются все звенья иммунной защиты [16,22], указывая на целесообразность широкого использования иммунокорригирующих препаратов [17,18,31]. Клиническая картина эшерихиозов разнообразна и зависит от состояния иммунной системы больного, его возраста, биологических характеристик возбудителя. Принадлежность возбудителя к той или иной О-серогруппе и наличие определенных факторов патогенности определяет характер патоморфологических изменений, течение инфекционного процесса и исход заболевания. Возможность развития тяжелых форм эшерихиозов обусловливает необходимость назначения адекватной патогенетически обусловленной и этиотропной терапии [ 36,37].
Выявленная роль интерферонов [14] в патогенезе заболеваний желудочно-кишечного тракта, особенно при рецидивирующих формах, позволяет в лечении отводить место иммунотерапии, определяя стратегию и тактику заболевания.
Для коррекции иммунных нарушений при кишечных инфекциях нами выбран циклоферон (метилглюкамина акридонацетат) - ранний индуктор интерферона 1 и 2-го типов. Основным его достоинством является полифункциональность - сочетание широкого спектра фармакологических эффектов, что позволяет рассматривать этот препарат в качестве иммунотропного средства лечения и профилактики различных заболеваний, включая и кишечные инфекции, что указано и в инструкции по его медицинскому применению. Продукция интерферонов под влиянием циклоферона обусловлена наличием чувствительных клеточных систем, способных синтезировать эндогенный интерферон в ответ на введение препарата. При действии циклоферона индуцируются сигналы, активирующие цитокиновую сеть организма. Характер иммунного ответа зависит от СД4+Th1 -и 2-типов, различающихся по продукции цитокинов при развитии иммунного ответа по клеточному и гуморальному типу. Препарат активирует Th1 иммунный ответ, продуцируя интерферон-гамма, интерлейкин 2, а ФНО-альфа, стимулирует Т-лимфоцитоы и макрофаги, развивая иммунный ответ по клеточному типу, обеспечивая решающую роль в противовирусной защите [24].
Циклоферон является одним из перспективных препаратов для лечения бактериальных инфекций. Вопрос влияния циклоферона на биологические свойства внутриклеточных бактериальных патогенов не изучен. В связи с этим, под руководством академика РАМН О.В.Бухарина (2005) проведено исследование антимикробной активности препарата и его влияния на персистенцию внутриклеточных бактерий. Показано подавление факторов персистенции (антилизоцимная и антикомплементарная активность) грамотрицательных (шигел,сальмонелл, бруцел, франциселл) бактерий, затрудняя их паразитирование внутри клеток, повышая эффективность лекарственных воздействий. Ингибирование циклофероном персистентного потенциала внутриклеточных патогенов способствует их элиминации при острых и хронических инфекционных процессах [ 3].
С целью предотвращения негладкого течения шигеллеза циклоферон включен в терапию. Клинический эффект циклоферона заключается в гладком течении заболевания, отсутствии повторного выделения возбудителя. У 12,8% больных, получавших антибактериальную терапию, продолжалось повторное выделение возбудителя. После того, как эти дети пролечены циклофероном, наблюдалась 100%-ная санация организма от возбудителя [ 10]. У больных с дизентерией и сальмонеллезом, получавших циклоферон в комплексной терапии, микробиологическая санация наступала у 90,3% больных, а у 89% пациентов нормализовался стул [15]. Среднетяжелая и тяжелая форма заболевания при гастроэнтероколитической форме заболевания выявляется в 25,8% случаев, в 74,2% - при гастроэнтеритическом варианте заболевания. У 13,1% больных после перенесенного заболевания остаются остаточные явления в виде затянувшейся репарации слизистой оболочки, характеризующейся усиленной макрофагальной инфильтрацией, что проявлялось неустойчивостью стула, склонностью к запорам на фоне длительного астенического синдрома, что расценивается как предпосылка к развитию хронического воспаления в слизистой оболочке толстой кишки. Протеолитические энзимы сальмонелл способствуют сохранению возбудителя в макрофагах, подавляя их функции через протеолитическую модификацию клеточных рецепторов [ 5,33].
И.А. Старикова (2004), оценивая эффективность циклоферона при кишечных (шигиллез, сальмонеллез) инфекциях, показала наступление санации кишечника у 95 из 100 больных, уменьшение кишечного токсикоза, общетоксического и колитического синдромов, что способствовало сокращению сроков пребывания детей в стационаре [27].
Под руководством В.В.Ботвиньевой (2010) [8] установлена этиология ОКИ, расшифрованная у 49,% детей, среди 104 детей, в возрасте от года до 14 лет. Шигиллез выявлен в 14,4% случаев, сальмонеллез наблюдался у 10,6% детей, эшерихиоз в 3,9% случаев, кишечная инфекция, вызванная условно патогенной флорой, документирована у 9,6% больных, а ротавирусная инфекция - в 10,6% случаев. У 74% больных первым проявлением заболевания были симптомы интоксикации, в 17,3% случаев -дисфункция кишечника, в 8,7% - повышение температуры. Диарейный синдром проявлялся в 35-64,4% случаев учащением стула до 5-6 раз, максимальная его частота составила 15 раз. Патологические примеси в виде слизи установлены в 81%, зелени - в 40,4%, прожилок крови - в 9,6% случаев. На боли в животе, метеоризм, тенезмы жаловались, соответственно, 75,9;50,0 и 19,2% наблюдаемых детей. Явления эксикоза с токсикозом I степени установлены у 47,1%, I-II степени - у 18,3% детей, а нейротоксикоз наблюдался в 6,7% случаев. В патологический процесс вовлекались все отделы желудочно-кишечного тракта, развитие гастроэнтероколита отмечено у 45,2% детей, гастроэнтерита - у 40,4%, а энтероколит и энтерит установлен, соответственно, в 7,7 и 6,7% случаев. Выявлена недостаточность фагоцитарного звена иммунитета при повышенной поглотительной активности нейтрофилов. Дисгаммаглобулинемия проявлялась гиперпродукцией иммуноглобулинов класса Е на фоне значительной активации провоспалительных цитокинов ИЛ-8 и ФНО-альфа, подтверждая значимую роль межклеточных медиаторов в развитии воспалительного процесса в желудочно-кишечном тракте при острых кишечных инфекциях [20,34].
Включение циклоферона в стандартную терапию кишечных инфекций способствовало исчезновению у 70,6% больных инфекционного токсикоза (против 38,2% - в группе сравнения), диарейного синдрома - у 35,3% против 14,7%, Клиническое выздоровление установлено на 5 день лечения у 94,1% больных, против 61,8% детей в группе сравнения. Значительно реже наблюдали сохранение признаков воспалительного процесса и показателей нарушения ферментативной и всасывательной функции желудочно-кишечного тракта. Применение пробиотика пробифор как стартового средства и препарата циклоферон с целью интенсификации общепринятой антибактериальной терапии сопоставимы, но терапевтический эффект пробифора наблюдали на 1-2 день, циклоферона - на 3-4 день. Циклоферон минимизировал интоксикационный синдром, а на фоне лечения пробифором достигался выраженный и быстрый регресс местных проявлений кишечной инфекции у детей. Следовательно, целесообразно комбинировать эти два препарата с различным механизмом действия с целью интенсификации терапии.
Оптимизация антибактериальной терапии циклофероном способствовала стимуляции фагоцитоза, активации гуморального звена иммунитета, нормализации уровня ИЛ-8, снижению концентрации ФНО-альфа. С учетом наличия прямой корреляционной связи между ИЛ-8 и ФНО-альфа в начальном периоде заболевания нами определена и прямая корреляционная связь между ИЛ-8 и ФНО-альфа у детей, получавших пробиотик и циклоферон, указывая на патогенетически обоснованное их применение, направленное на повышение механизмов иммунологической защиты и уничтожение возбудителя. Применяя циклоферон у больных с иерсиниозной инфекцией, отмечено снижение числа рецидивов заболевания (9% против 16%) [10,30].
Иммунный дисбаланс, приводящий к развитию тяжелых и осложненных форм заболевания, поддерживается дисбиотическими нарушениями слизистых оболочек дыхательных путей и кишечника. Так, у часто болеющих детей супрессия синтеза sIgA и дисбиотические нарушения в кишечнике обусловливают длительную персистенцию условно-патогенных микроорганизмов, что приводит к усилению клинических симптомов дисбиоза. В детском возрасте дисбактериозы формируются под действием респираторных инфекций, а самые тяжелые формы нарушения микробиоценоза происходят под воздействием активной терапии антибиотиками и химиопрепаратами. Развитию кишечного дисбактериоза способствует и прямое токсическое действие антибиотиков на эпителий и ретикулоэндотелиальную строму слизистой оболочки кишечника. У 88,1% часто болеющих детей выявлены нарушения микрофлоры толстой кишки, а у 92% часто болеющих детей с функциональными нарушениями желудочно-кишечного тракта выявляется дисбиоз с изменениями в системе иммунитета (повышение уровня CD3+,CD8+, снижение JgA). Одновременное поражение дыхательных путей и кишечника у детей остается недостаточно изученным в отношении как этиологии, особенностей клинического течения, механизмов патогенеза, так и и принципов лечения. Чаще всего ОРВИ с гастроинтестинальным синдромом регистрируется у детей 1-го года жизни (33,7%), реже у детей от 1 до 2- лет (30,4%), в возрасте 3-7 лет (27,2%), у школьников (21,2%). Респираторная вирусная этиология выявлена [12] у 79% пациентов, бактериальная инфекция участвовала в поражении дыхательных путей в 5,4% случаев, всегда сочетаясь с вирусной этиологией. Ротавирусная инфекция выявлена в 39,1% случаев, с помощью электронной микроскопии выявлены коронавирусы, детекция которых не проводится в обычной клинической практике [25,26].
Изменение качественного состава и количественного соотношения биоциноза кишечника - «дисбактериоз» зависит от характера питания, антибактериальной, гормональной, химиотерапии, наличия хронических заболеваний пищеварительного тракта. В основе их развития лежит изменение условий обитания в биотопе, в результате чего популяция одного из нескольких видов, составляющих микробиоценоз, получает преимущества для роста и размножения перед своими конкурентами, приобретая доминирующее, несвойственное им положение в микробиоцинозе [2,21].
Целесообразность применения циклоферона в комплексной коррекции дисбиоза кишечника выявлена и у детей раннего возраста (уровень микрофлоры кишечника восстановился до нормы у 95% пациентов, а число условно-патогенной микрофлоры сократилось в 12 раз). С целью коррекции дисбиоза желудочно-кишечного тракта изучали микрофлору кишечника у 96 часто болеющих детей в возрасте от 4 до 6 лет. В анамнезе у 44,8% матерей наблюдаемых детей были хронические заболевания, и у трети из них (29,8%) отмечались их обострения во время беременности. У 78% детей отмечались функциональные нарушения желудочно-кишечного тракта, на периодическое недомогание жаловались 13,5% детей, у 46,8% наблюдался сниженный аппетит, у 11,4% отмечалась изжога, тошнота, у 53,1% - боли в животе, у 46,8% - запоры, у 11,4% - неустойчивый стул. У 8,3% пальпировались спазмированные участки толстой кишки, у 11,4% - умеренное вздутие живота, урчание. У 18,0% детей отмечалась прозрачная слизь на поверхности фекалий с непереваренными частицами пищи. У 73,5% детей наблюдались осложнения в виде бронхита, пневмонии, ларинготрахеита, отита, лимфаденита, синусита. Прием антибактериальных средств потребовался 91,2% больным. Бактериологическое исследование выявило нарушение видового и количественного состава микрофлоры кишечника у 88,1% часто болеющих дошкольников. Патогенные микроорганизмы не определялись, выявлено снижение уровня Lactobacillus (р<0,001) и повышение E. coli со сниженными ферментативными свойствами (р<0,01) по сравнению со здоровыми детьми, а среди условно-патогенной микрофлоры наблюдали увеличение содержания Proteus ( р<0,01). Эшерихии с низкой ферментативной активностью определялись у 50 (52,1%) часто болеющих дошкольников.
На фоне снижения штаммов облигатных представителей микрофлоры у 48 детей (50,0%) диагностирована контаминация толстой кишки условно-патогенной флорой. Грибы рода Candida - 38,7%, Proteus - 20,4%, S. aureus - 3,2% [ 25].
Нами предпринята попытка изучить влияние циклоферона на элиминацию аллохтонной флоры из состава кишечного микробиоценоза при кампилобактериозе, поскольку доказано (in vitro) воздействие препарата на экспрессию факторов персистенции грамотрицательных патогенных, условно-патогенных энтеробактерий и грамположительных кокков [4].
In vivo эффект доказан положительным результатом лечения сальмонеллеза и иерсиниоза [30]. Дети с установленным диагнозом дисбактериоза кишечника жаловались на периодическое недомогание (27,5%), у 50,0% из них отмечался сниженный аппетит, у 72,7% периодически возникали боли в животе, у 40,9% детей наблюдались запоры, на неустойчивый характер стула указывали 54,6% детей. Обложенность языка наблюдалась у 36,4% дошкольников. У 8,3% пальпировались спазмированные участки толстой кишки, у 11,4% - умеренное вздутие живота, урчание. У 18,5% отмечалась прозрачная слизь на поверхности фекалий [23,26].
В остром периоде кампилобактериоза оценена эффективность циклоферона, в виде ректальных суппозиториев 1. Курс терапии циклофероном составил 5-7 дней, препарат назначался в первые сутки госпитализации с момента установления диагноза кампилобактериоза методом ПЦР.
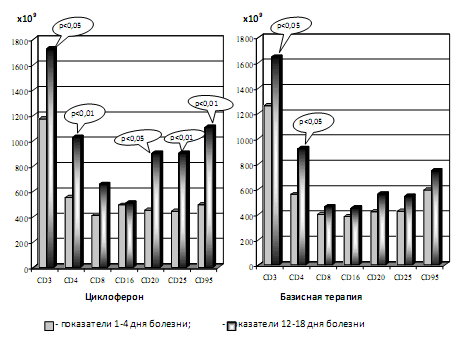
Рис.1. Динамика абсолютных значений субпопуляций лимфоцитов на фоне различных схем терапии кампилобактериоза
Изменения субпопуляций лимфоцитов (показатели 1-4-го и 12-18 дней болезни) выявили, что при включении циклоферона происходит нарастание абсолютного содержания лимфоцитов, несущих рецепторы CD3+ и CD4+ фенотипа Т-клеток. Так, изначально средний уровень Т-лимфоцитов периферической крови составил 1173х109 клеток у детей, пролеченных циклофероном, и 1262х109 клеток у получавших базисную терапию, а уровень CD4+ клеток, соответственно, составил 551х109 и 558х109 клеток. Сравнение с показателями в реконвалесцентном периоде выявило нарастание уровня Т-лимфоцитов до 1724х109 и 1645х109 клеток и CD4+ лимфоцитов до 1027х109 и 920х109 клеток ( р<0,05) для каждого показателя в обеих группах. При этом показатели реконвалесцентного периода уровней Т-лимфоцитов и клеток, несущих CD4+ рецепторы, не различались (р>0,05). Однако уровень антителпродуцирующих клеток и лимфоцитов, несущих рецепторы активации, в двух сравниваемых группах были неоднозначными (рис. 1).
При использовании циклоферона происходило значительное увеличение (+49,7%) абсолютных цифр CD20+ фенотипов лимфоцитов с 453х109 до 902х109 клеток (р<0,05), экспрессия рецепторов к интерлейкину-2 увеличивалась на 50,8% (с 443х109 до 902х109 клеток, р<0,05), а количество CD95+ клеток возрастало на 55,3% (с 494х109 до 1106х109, р<0,05). Напротив, у детей, находящихся на базисной терапии, увеличения лимфоцитов не происходило, относительный прирост показателей составил 25,0%, 21,35% и 20,5% соответственно ( р<0,05).
Значимости влияния на продукцию циркулирующих иммунных комплексов использованной терапии отмечено не было, однако тенденция к нарастанию ЦИК у больных, получавших циклоферон, была более заметной (+0,02 ед.опт.плотн.), чем при базисной терапии (+0,006 ед.опт.плотн.).
Влияние циклоферона на гуморальное звено иммунного ответа изучено (табл.1) определением титров специфических антител в парных сыворотках и синтеза общего иммуноглобулина класса А в копрофильтратах с помощью реакции иммунофлюоресценции. Исходно среднегеометрическая концентрация циркулирующих противокампилобактерных антител не отличалась у детей двух наблюдаемых групп, динамика прироста антител имела сходные тенденции, а титр сывороточных антител (к началу третьей недели) не имел различий (5,01±0,34 и 5,36±0,41 1/Log2, р>0,05). У детей, получавших циклоферон, уровень общего IgA кишечного секрета составил 4,21±0,39 1/Log2 при исходном значении 1,97±0,15 1/Log2, то есть более чем в 2 раза (р<0,05), тогда как у детей, получавших базисную терапию прирост общего IgA в копрофильтратах произошел только в 1,3 раза (2,04±0,11 и 2,78±0,31 1/Log2 соответственно), разница в содержании иммуноглобулинов класса А в копрофильтатах у пациентов в периоде реконвалесценции составила 33,97%.
Таблица 1
Уровень антигенспецифических сывороточных антител и общих IgА в копрофильтратах на фоне комплексной терапии (1/Log2)
|
Терапия |
Специфические АТ (кровь) |
Общий IgA (копрофильтрат) |
||||
|
1-4 дни |
5-10 дни |
11-15дни |
1-4 дни |
5-10 дни |
11-15дни |
|
|
Базисная терапия, n=26 |
1,26±0,28 |
3,42±0,20 |
5,01±0,34 |
2,04±0,11 |
2,48±0,27 |
2,78±0,31 |
|
Циклоферон, n=25 |
1,19±0,16 |
3,64±0,19 |
5,36±0,41 |
1,97±0,15 |
3,02±0,30 |
4,21±0,39* |
Примечание: * - значимое различие по сравнению с группой на базисной терапии (по t-критерию Стьюдента, р<0,05)
Таким образом, полученные данные явились основанием для разработки терапевтической тактики детей с кампилобактерной инфекцией. Проводимая антибактериальная терапия оказывала неравнозначное влияние на микробиоценоз кишечника. Использование при кампилобактериозе цефалоспоринов, аминогликозидов и хлорамфеникола приводило к угнетению роста индигенной флоры. В сравнении с макролидами эти препараты более негативно влияли на состав анаэробных микроорганизмов и, как следствие, облегчали контаминацию кишечника условно-патогенной флорой, приводя к декомпенсации дисбактериоза [7]. Эффективность циклоферона заключалась в уменьшении длительности местных клинических проявлений кампилобактериоза, снижении уровня контаминации кишечника микробами-ассоциантами в ходе заболевания, значительным сокращением частоты повторного бактериовыделения возбудителя и в нарастании продукции общего иммунолобулина класса А в кишечнике, позволяя рекомендовать использовать циклоферон в составе комплексной терапии кампилобактериоза у детей.
Клинический эффект включения циклоферона проявлялся сокращением длительности субъективных ощущений дискомфорта (болей в животе и снижения аппетита), определяемой болезненности при пальпации живота и синдрома дистального колита (длительность тенезмов и спазма, болезненности, урчания сигмовидной кишки) в среднем в 1,5 раза по сравнению с традиционной терапией. Установлено снижение частоты затяжного бактериовыделения (рис.2) в периоде реконвалесценции более чем в 5 раз, а также отмечена очевидная тенденция к снижению вероятности негладкого течения с появлением обострений и рецидивов заболевания [23]. Ректальное использование в терапии кампилобактериоза циклоферона приводило к уменьшению глубины деструктивных и воспалительных изменений в кишечнике, что значимо отразилось на длительности болевого абдоминального синдрома, проявлений дистального колита и динамике восстановления самочувствия и аппетита больного ребенка. У детей, в терапию которых был включен циклоферон, уже в периоде ранней реконвалесценции, отмечено снижение титров условно-патогенной флоры кишечного содержимого (Kl. рneumoniae, St. aureus, Enterobacter spp.) и заполнение слизистой нормальной кишечной палочкой. Включение в комплекс терапии циклоферона предотвращало заселение кишечника микробами-ассоциантами, сохраняя степень контаминации условно-патогенной флорой на уровне 1,9 Lоg/1 грамм.
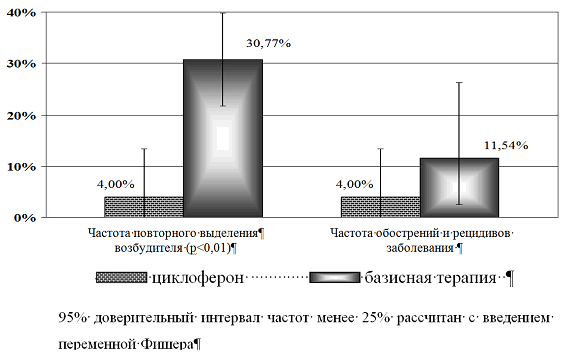
Рис.2. Влияние циклоферона на эффективность санации и течение инфекционного процесса при кампилобактериозе
Снижение колонизационной активности условно-патогенной флоры способствовало нормализации соотношения аэробной флоры и ускорило заселение кишечника индигенными аэробами: уровень полноценных эшерихий в обследованной группе детей вырос с 2,59 Lоg до 4,75 Lоg, тогда как в группе детей, пролеченных базисной терапией, титр кишечной палочки снизился более чем в 2 раза (до 5,22 Lоg) (р<0,05). Благодаря более быстрой элиминации возбудителя и предотвращению контаминации представителями условно-патогенных энтеробактерий, кокков и грибов у этой группы больных не происходило углубления степени дисбиоза, как интегрального показателя состояния микробиоценоза кишечника.
Установленная О.В.Тихомировой [26] зависимость течения кишечных инфекций вирусной этиологии от интенсивности антительного ответа и индукции альфа-IFN явилась основанием для применения циклоферона в комплексной терапии ротавирусной инфекции. Ротавирусная инфекция чаще регистрируется в осенне-зимние месяцы, максимальное количество (70%) больных наблюдается в январе-феврале. К заболеванию приводят в 46% случаев погрешности в питании и дефекты ухода, в 12% случаев - контакт в семье с больным ОКИ, а в 42% случаев причину не удается установить [ 9].
Включение циклоферона привело к более легкой форме течения заболевания и укорочению продолжительности основных клинических проявлений (интоксикации, лихорадки, катаральных явлений, диареи, болей в животе, метеоризма). У детей, получавших циклоферон, отмечено снижение (в 7,1 раза) ротавирусного антигена на фоне стимуляции (в 2,9 раза) противовирусных антител, обеспечивая выздоровление детей.
Циклоферон при ротавирусном гастроэнтерите обеспечивал более легкое течение заболевания и укорочивал продолжительность основных клинических проявлений (табл. 2).
Таблица 2
Длительность основных клинических симптомов ротавирусной инфекции у детей
|
Основные симптомы заболевания |
1-я группа детей, получавших Циклоферон (n= 150) |
2-я группа детей, получавшая базовую терапию Группа сравнения (n=150) |
|
Длительность в днях |
Длительность в днях |
|
|
Интоксикация |
2,0±0,2* |
2,9±0,3 |
|
Лихорадка |
2,4±0,2* |
3,5±0,5 |
|
Гиперемия зева |
2,7±0,2* |
4,8±0,6 |
|
Рвота |
1,6±0,2 |
1,7±0,2 |
|
Метеоризм |
1,1±0,3* |
2,0±0,3 |
|
Боли в животе |
1,5±0,2* |
2,5±0,2 |
|
Диарея |
3,9±0,1* |
6,1±0,6 |
|
Длительность пребывания в стационаре |
5,3±0,3* |
8,2±0,5 |
* - p ≤0,05 по сравнению с больными группы сравнения
Так, симптомы интоксикации купировались на день раньше в группе детей, получавших циклоферон, чем в группе сравнения. Появление аппетита отмечали у 91 (60,7%) ребенка (после первого дня терапии циклофероном), а после курса терапии аппетит восстановился у 97,3 % детей в среднем на 2,4±0,2 день, в то время как, у детей группы сравнения, появление аппетита у 80,0% детей отмечалось лишь после трех дней стационарного лечения (3,4±0,3 дня). В более ранние сроки у детей улучшалось самочувствие, нормализовалась двигательная активность.Повышение температуры тела у всех детей (100%) прекращалось на 3-й день лечения циклофероном, причем снижение до субфебрильных цифр отмечалось уже после 1-го дня лечения у 70% больных, имевших фебрильные цифры температуры тела до начала этиотропной терапии. В то время как в группе сравнения лихорадка наблюдалась до 4-х дней, нарастая ко 2-му - 3-му дню стационарного лечения.
Явления дискомфорта в животе (метеоризм, урчание, болезненность), а также водянистая диарея на фоне лечения циклофероном прекращались раньше на 2-3 дня по сравнению с группой сравнения, и, соответственно, в более быстрые сроки нормализовался стул.
Применение циклоферона больным с норовирусным гастроэнтеритом приводило к купированию основного симптома - рвоты в 1 день лечения, а у детей с этой инфекцией в группе сравнения продолжительность рвоты была на 1 день больше. При торовирусном гастроэнтерите отмечалось сокращение длительности неоформленного стула в 2 раза на фоне приема препарата.
При ротавирусном поражении организма наибольшая клиническая эффективность препарата наблюдалась в отношении катаральных явлений со стороны верхних дыхательных путей. Характерный симптом при ротавирусной инфекции - гиперемия зева у детей, не получавших этиотропное лечение, наблюдался в течение 4,8±0,6 дней, применение циклоферона сокращало продолжительность этого симптома до 2,7±0,2 дней. На фоне лечения циклофероном катаральные явления купировались на 4 дня раньше.
Ротавирусный антиген до лечения выявлялся в 65,12%-67,50% случаев в концентрации 0,23±0,02 отн.ед. и 0,24±0,03 отн.ед. у детей наблюдаемых групп. После терапии циклофероном у детей 1-й группы ротавирусный антиген отмечен у 9,30% детей в концентрации 0,04±0,006 отн.ед. В группе больных, получавших курс базовой терапии, ротавирусный антиген выявлялся у 40,0% детей, а его концентрация составила 0,26±0,03 отн.ед., т.е. была выше в 6,5 раз.
Терапия циклофероном приводила к стимуляции (в 1,2 раза) выработки противоротавирусных антител (с 0,37±0,04 отн.ед. у 27,91% детей до лечения и до 0,45±0,07 отн.ед., которые выявлялись у 81,40% больных) после лечения, а у детей, получавших курс базовой терапии (группа сравнения), уровень антител не менялся (с 0,36±0,04 до 0,39±0,04 отн.ед.).
Вследствие этого отмечалось более значительное уменьшение уровня антигена в фекалиях детей, получавших циклоферон, по сравнению с группой детей, находящихся на базовой терапии, составив 0,04, против 0,20 отн.ед. (табл. 3).
Таблица 3
Уровень ротавирусного антигена, антител и ИФН в крови больных ротавирусной инфекции
|
Показатели |
1-я группа пациентов (циклоферон) (n=150) |
2-я группа пациентов сравнения (базовая терапия) (n=150) |
|
|
АГ в фека- лиях ( отн.ед) |
до лечения |
0,23±0,02 |
0,24±0,03 |
|
после лечения |
0,04±0,006* |
0,20±0,03 |
|
|
альфа -ИФН Ме/мл |
до лечения |
24,6±3,1 |
26,8±3,1 |
|
после лечения |
35,6±3,8* |
7,1±1,2 |
|
|
Гамма -ИФН Ме/мл |
до лечения |
15,2±1,5 |
10,2±1,8 |
|
после лечения |
20,2±2,0* |
12,2±1,9 |
|
|
АТ в крови (отн.ед) |
до лечения |
0,37±0,04 |
0,21±0,02 |
|
после лечения |
0,45±0,07* |
0,24±0,02 |
|
|
АТ в фека- лиях (отн.ед) |
до лечения |
0,28±0,03 |
0,23±0,02 |
|
после лечения |
0,38±0,04 |
0,36±0,02 |
|
* - р≤0,05 в сравниваемых показателях
В крови больных в острый период уровень α-ИФН исходно колебался от 23 до 40 МЕ/ мл (составив 24,6±3,1 МЕ/ мл), а γ-ИФН выявлялся в меньших концентрациях - от 10 до 17 Ед/мл, составив 15,2±1,5 МЕ/ мл.
После лечения циклофероном уровень α-ИФН увеличился на +11,0, составив 35,6±3,8 МЕ/мл. Уровень же γ-ИФН достиг 20,2 Ед/мл. Очевидно, что низкие концентрации α- и γ-ИФН приводят к необходимости дополнительной стимуляции этих цитокинов, их концентрация возрастает при индуцировании циклофероном, синтезируя противоротавирусные антитела, обеспечивая более быструю санацию кишечника от патогена [6].
Оценивая воспалительный процесс, выявлен низкий процент положительных результатов, что объяснимо недостаточностью иммунного ответа при средне-тяжелой и тяжелой формах заболевания (табл.4-5).
Таблица 4
Сравнительный анализ титров С-реактивного белка (СРБ) у детей при среднетяжелой форме заболевания
|
Титры СРБ |
При поступлении |
На фоне лечения (3 день) |
||
|
Циклоферон |
Базовая терапия |
Циклоферон |
Базовая терапия |
|
|
отрицательный |
19.0 |
11,12 |
61,1 |
44,4 |
|
1 : 1 |
33,3 |
22,22 |
22,2 |
44,4 |
|
1 : 2 |
28,7 |
33,33 |
16,7 |
11,1 |
|
1 : 4 |
19.0 |
33,33 |
--- |
--- |
|
1 : 8 и выше |
--- |
--- |
--- |
--- |
*, ** - статистически значимое различие в сравниваемых группах на 3-й день
Таблица 5
Сравнительный анализ титров С-реактивного белка (СРБ) при тяжелой форме заболевания
|
Титры СРБ |
При поступлении |
На фоне лечения (3 день) |
||
|
Циклоферон |
Базовая терапия |
Циклоферон |
Базовая терапия |
|
|
отрицательный |
10.0 |
0 |
62,5* |
16,7 * |
|
1 : 1 |
10.0 |
16,7 |
12,5 |
33,3 |
|
1 : 2 |
35.0 |
16,7 |
25 |
16,7 |
|
1 : 4 |
40.0 |
50.0 |
0 ** |
33,3 ** |
|
1 : 8 и выше |
5.0 |
16,7 |
0 |
00 |
*, ** - статистически значимое различие в сравниваемых группах на 3-й день
Циклоферон способствует более эффективной элиминации ротавирусов из организма ребенка. При среднетяжелой и тяжелой формах ротавирусного гастроэнтерита, процент положительных результатов выявления антигена снижался при лечении циклофероном до 58,3-82,4% (табл.4-5), минимизируя риск персистенции ротавируса и развитие хронизации процесса, обеспечивая снижение риска развития внутрибольничной ротавирусной инфекции.
Таким образом, инфекционные заболевания желудочно-кишечного тракта у детей, характеризуются нарушением факторов местного иммунитета, развитием дисбаланса цитокиновой сети, обеспечивая тяжесть течения и активность воспалительного процесса. Применение в комплексной терапии заболеваний желудочного-кишечного тракта вирусной и бактериальной природы препаратов, обладающих иммунотропной активностью, патогенетически обосновано, способствует коррекции иммунных нарушений и скорейшему клиническому и микробиологическому выздоровлению, повышая качество оказываемой медицинской помощи детям.
СПИСОК ЛИТЕРАТУРЫ
- Александрова В.А. Основы иммунной системы желудочно-кишечного тракта /Методическое пособие. - СПб., 2006. - 43с.
- Бондаренко В.М., Мацулевич Т.В. Дисбактериоз кишечника как клинико-лабораторный синдром: современное состояние проблемы. - М.,2007. - 300с.
- Бухарин О.В. Влияние циклоферона на биологические свойства бактериальных внутриклеточных патогенов / О.В.Бухарин, Д.А.Кириллов, Н.В.Шеенков, В.А.Кириллов //Журн. микробиол., эпидемиол., иммунобиологии. - 2005. - №3. - С. 8-10.
- Воробьев А.А., Сичинский Л.А., Дратвин С.А. Возможности лабораторной диагностики инфекций, вызванных бактериями рода Campilobacter // Журнал микробиологии и эпидемиологии. - 2000. - № 1. - С. 95- 103.
- Воротынцева Н.В., Горелов А.В. Влияние биологических свойств возбудителя на клинические проявления сальмонеллеза у детей. //Эпидемиология и инфекционные болезни. М.; Медицина; 2004. - Т. 1. - С. 41-47.
- Гордеец А.В., Седулина О.Ф., Юрусова Е.Н. Циклоферон в лечении ротавирусной диареи у детей // Детские инфекции.-2007. - №2. - С.62-64.
- Горелов А.В., Воротынцева Н.В. Клинические проявления кампилобактериоза у детей // Эпидемиология и инфекционные болезни. - 1997. - №3. - С. 37-40.
- Гуссоева И.Г., Ботвиньева В.В. Рамонова А.М. Вопросы оптимизации лечения ОКИ у детей старше года. - СПб.,2010. - 24с.
- Денисюк Н.Б., Каган Ю.Д. Эпидемиологические особенности ротавирусной инфекции и ее место в структуре острых кишечных инфекций // Материалы II ежегодного Всероссийского конгресса по инфекционным болезням. - М., 2010. - 383 с.
- Дизентерия Флекснера у детей на современном этапе. Особенности течения и рациональная тактика терапии: пособие для врачей / под ред. О.В.Тихомировой. - СПб., - 2004. - 58 с.
- Долженко Д.А., Сапрыкина П.А., Семеняка О.В., Киклевич В.Т. Клинико-эпидемиологическая характеристика ротавирусной инфекции детей Восточной Сибири // Материалы II ежегодного Всероссийского конгресса по инфекционным болезням. - М., - 2010. - 98с.
- Дондурей Е.А. Арбидол в комплексном лечении сочетанного поражения респираторного и желудочно-кишечного тракта у детей /Детские инфекции.-2007.-№2.
- Заболевания, протекающие с диарейным синдромом: учебно-метод. пособие / под редакцией Т.В.Сологуб. - СПб., 2006. - 43 с.
- Карал-оглы Д.Д., Агрба В.З. Цитокины при кишечных инфекциях в модельных опытах на обезьянах // Материалы II ежегодного Всероссийского конгресса по инфекционным болезням. - М., 2010. -136 с.
- Караськова Н.Г., Романцов М.Г. Терапия кишечных инфекций циклофероном //Врач. - 2001. - №6. - С.28-32.
- Кафтырева Л.А. Сальмонеллезы. Проблемы и перспективы. Актовая речь. СПб., 2000. 28 с.
- Милютина Л.Н., Голубев А.О. Клинико-иммунологические особенности современных сальмонеллезов //Материалы II ежегодного Всероссийского конгресса по инфекционным болезням. - М., 2010. - 200 с.
- Милютина Л.Н. Клинические особенности современного сальмонеллеза, вызванного S. enteritidis у детей // Инфекционные болезни. - 2003. - т. 1. - № 1. - С. 26- 29.
- Михайлов И.Б. Коррекция вторичного приобретенного иммунодефицита у детей и взрослых /Методическое пособие для врачей. - СПб., 2007.- 19с.
- Мокрецова Е.В. Клиника и паТ.орфологические аспекты патогенеза гастроинтестинальной формы сальмонеллеза. Автореферат. дисс.... канд. мед. наук. М., 2003. - 24 с.
- Нарушение микрофлоры кишечника у детей / Римарчук Г.В., Щеплягина Л.А.,Круглова И.В., Тюрина Т.К. - М., 2007. - 27с.
- Рожнова С.Ш., Фролочкина Т.И., Головинова М.А. Эпидемиологическая ситуация по сальмонеллезам в России на рубеже веков. Материалы VIII Всероссийского общества эпидемиологов, микробиологов и паразитологов. М., 2002; Т. 1; С. 91-92.
- Романцов М.Г. Опыт применения циклоферона в терапии кишечных инфекций у детей. - СПб., 2010. - 14с.
- Романцов М.Г., Горячева Л.Г., Коваленко А.Л. Новые возможности применения иммунотропных препаратов //Противовирусные и иммунотропные препараты в детской практике. - СПб.,2008. - С.31-62.
- Романцов М.Г., Ершов Ф.И. Состояние микрофлоры кишечника //Часто болеющие дети. Современная фармакотерапия.- (Изд.группа «ГЭОТАР-Медиа»).- М., 2009. -С.80-87.
- Тихомирова О.В. Заболевания желудочно-кишечного тракта /Романцов М.Г., Горячева Л.Г., Коваленко А.Л. //Противовирусные и иммунотропные препараты в детской практике. - СПб., 2008. - С. 85- 97.
- Старикова И.А. Эффективность циклоферона при острых кишечных инфекциях у детей //ВРАЧ.- 2004. - №7. - С.54- 55.
- Семеняко О.В., Васютенко Е.Б., Киклевич В.Т. Клинико-эпидемиологические особенности острых кишечных инфекций в Иркутске //Материалы II ежегодного всероссийского конгресса по инфекционным болезням. - М.,2010. - 284с.
- Татаркина А.Н., Вовк Т.Г., Корейченко Т.С. К вопросу антибиотикотерапии детей раннего возраста, больных бактериальными острыми кишечными инфекциями //Материалы II ежегодного Всероссийского конгресса по инфекционным болезням. - М., 2010. - 314с.
- Тихомирова О.В., Бехтерева М.К., Ныркова О.И. Эффективность использования препаратов реамберин и циклоферон в терапии кишечных инфекций у детей: Метод. рекомендации. - СПб., 2003. - 43с.
- Тихонова Е.П., Кузьмина Т.Ю., Тихонова Ю.С. Вспышка шигеллеза в детском учреждении //Материалы II ежегодного всероссийского конгресса по инфекционным болезням. - М., 2010. - 321с.
- Тикунова Н.В., Жираковская Е.В., Боднев С.А. Этиологическая значимость и генетическая характеристика гастровирусов, циркулирующих в Сибири: Материалы II ежегодного Всероссийского конгресса по инфекционным болезням. - Москва. - 2010. - 317с.
- Тилка Г.С., Мокрецова Е.В., Боровская Т.Ф. Исходы сальмонеллеза и возможности его коррекции: Материалы II ежегодного Всероссийского конгресса по инфекционным болезням. - Москва. - 2010. - 325с.
- Тюрин Е.О. Сальмонеллез enteritidis (клинико-патогенетические аспекты, вопросы терапии). Автореферат. дисс. канд. мед. наук. М., 1998. - 18 с.
- Тюрин Ю. А., Мустафин И.Г. Роль и значение экзопротеазной активности сальмонелл при гастроинтестинальной форме сальмонеллеза // Материалы II ежегодного Всероссийского конгресса по инфекционным болезням. - М., 2010. - 329с.
- Халиулина С.В., Анохин В.А. Современные аспекты эпидемиологии, клиники и диагностики кампилобактериоза // Казанский медицинский журнал. - 2001; №81(6). С. 446-450.
- Халиуллина С.В., Гутор И.А. Антибиотикорезистентность диаррейных E.coli // Материалы II ежегодного Всероссийского конгресса по инфекционным болезням. -М., 2010. - 346 с.
1 разрешение № 288 от 23 июля 2008г. Росздравнадзора.



