Цирроз печени представляет собой одну из наиболее сложных и нерешенных проблем современной гастроэнтерологии. В экономически развитых странах цирроз печени (ЦП) входит в число шести основных причин смерти в возрасте 35-60 лет и составляет от 14 до 30 случаев на 100000 населения.
Основными причинами смерти больных ЦП являются осложнения портальной гипертензии (ПГ). Современные клинические и экспериментальные исследования подтверждают важную роль нарушений состава интестинальной микрофлоры в патогенезе таких осложнений ПГ, как печеночная энцефалопатия, гепаторенальный синдром, спонтанный бактериальный перитонит [8]. Бактериальные инфекции, особенно с включением интестинальной флоры, являются частыми осложнениями и могут иметь тяжелые клинические последствия у больных ЦП [6].
В некоторых исследованиях было показано, что функциональное состояние и морфологические изменения слизистой оболочки кишечника у больных ЦП с ПГ являются потенциальным фактором риска для развития транслокации кишечных бактерий во внутреннюю среду [9]. Учитывая роль нарушений нормального состава кишечных бактерий в патогенезе осложнений ЦП, терапия, направленная на восстановление кишечной микрофлоры, является патогенетически обоснованной.
Цель исследования
Изучить роль нарушений кишечной микрофлоры в патогенезе функциональных расстройств кишечника у пациентов ЦП с наличием портальной гипертензионной колонопатии (ПГК).
Задачи исследования
1. Изучить частоту выявления синдрома избыточного бактериального роста в тонкой кишке и нарушений состава толстокишечной микрофлоры с наличием условно-патогенных бактерий у больных ЦП с ПГК.
2. Определить роль нарушений состава кишечной микрофлоры в формировании клинических проявлений, обусловленных функциональными кишечными расстройствами, у пациентов ЦП с ПГК.
3. Оценить эффективность терапии, включающей невсасывающийся антибиотик рифаксимин с последующим назначением пробиотика бифиформ, на нормализацию кишечной микрофлоры и купирование симптомов кишечной диспепсии у больных ЦП с ПГК.
Материалы и методы исследования
После одобрения локальным этическим комитетом протокола в исследование было включено 74 больных вирусным циррозом печени с наличием портальной гипертензионной колонопатии (54 мужчин и 20 женщин, средний возраст 56,5 лет).
Критерии включения больных в исследование: 1) наличие ЦП с портальной гипертензионной колонопатией, подтвержденной эндоскопическими и/или морфологическими методами исследования; 2) информированное согласие больного на участие в исследовании.
Критерии исключения больных из исследования: 1) ЦП токсического генеза (алкогольный, лекарственный и др.), а также ЦП с отсутствием ПГК; 2) наличие сопутствующих воспалительных заболеваний кишечника, дивертикулярной болезни, заболеваний поджелудочной железы с внешнесекреторной недостаточностью; 3) выявление опухолевых процессов любой локализации; 4) тяжелое состояние больного, не позволяющее проведение эндоскопического и морфологического исследований слизистой оболочки желудочно-кишечного тракта (ЖКТ).
Диагноз ЦП устанавливался на основании данных анамнеза, результатов физикального и лабораторно-инструментального и в ряде случаев гистологического исследования биоптатов печени. Вирусная этиология ЦП была доказана исследованиями маркеров вирусов гепатита В, С, D.
Наличие ПГ подтверждалось результатами компьютерной томографии, ультразвукового и эндоскопического исследования органов брюшной полости.
При клиническом исследовании помимо синдромов, характерных для цирроза печени, нами оценивалось также наличие клинических проявлений, связанных с нарушением функций кишечника. По аналогии с Римскими критериями III, применяемыми для классификации функциональных нарушений желудочно-кишечного тракта, при наличии у пациентов симптомов, характерных для синдрома раздраженной кишки (СРК), включающих три обязательных признака - абдоминальные боли, нарушение частоты стула и формы кала, нами, как и рядом других авторов, использовался термин «СРК-подобные нарушения» [7]. При этом в зависимости от характера нарушения стула выделялись СРК-подобные нарушения с запором, диареей, смешанного и недифференцированного типа. Болевой абдоминальный синдром и синдром метеоризма, если они не сочетались с изменениями частоты стула и консистенции кала, анализировались самостоятельно.
Всем больным, включенным в исследование, проводилось эндоскопическое исследование пищевода, желудка, двенадцатиперстной кишки и толстого кишечника, что позволило получить информацию о состоянии этих органов у больных ЦП с наличием портальной гипертензии [3].
При колоноскопии основное внимание уделялось оценке состояния СО с выявлением эндоскопических признаков ПГК. По аналогии с предложенными T.T. Mc Cormack критериями диагностики портальной гипертензионой гастропатии диагноз ПГК ставился на основании наличия при эндоскопическом исследовании множественных эритематозных участков на желтоватом или белесоватом фоне (мозаичность слизистой оболочки кишки), мелкоточечной гиперемии («скарлатиноподобные» изменения) вишнево-красных или темно-коричневых пятен, а также сосудистых эктазий [11].
У всех пациентов при КФС была взята биопсия из правых отделов толстой кишки и сигмовидной кишки с целью проведения морфологического и морфометрического исследований СО. При этом отличительным морфологическим признаком ПГК считалось наличие эктазии сосудов в сочетании с увеличением толщины их стенок.
Для диагностики избыточного бактериального роста (ИБР) в тонкой кишке использовался водородный дыхательный тест с лактулозой.
Бактериологическое исследование кала проводилось по методике, а интерпретация полученных результатов - по критериям, разработанным Московским научно-исследовательским институтом эпидемиологии и микробиологии им. Г.Н. Габричевского. При анализе посева кала нами учитывалось наличие или отсутствие условно-патогенной микрофлоры [2]. Анализ полученных результатов проводился при первичном исследовании и через месяц от начала наблюдения.
Все пациенты получали симптоматическое и патогенетическое лечение цирроза печени. В дополнение к базисной терапии пациентам с наличием нарушений кишечной микрофлоры проводилась деконтаминационная терапия, включающая рифаксимин 1200 мг/сутки в течение 7 дней с последующим назначением курса пробиотиков (бифиформ по 2 капсулы 2 раза в день) в течение 2 недель. При этом наблюдаемым пациентам не назначались препараты, влияющие на моторную функцию и висцеральную чувствительность кишки.
При статистической обработке полученных результатов для анализа количественных признаков использовался критерий Стьюдента, качественных - критерий χ2 .
Результаты собственных исследований
После проведения эндоскопического и морфологического исследования СО толстой кишки из 160 больных ЦП у 74 (46,2 %) было установлено наличие ПГК. По результатам дыхательного водородного теста с лактулозой и бактериологического анализа кала у 52 (70,3%) больных были выявлены нарушения состава кишечной микрофлоры, из них у 20 (27%) имел место ИБР в тонкой кишке, у 25 (33,8%) - толстокишечный дисбактериоз и у 7 (9,5%) выявлялись сочетанные дисбиотические нарушения. У 22 (29,7%) пациентов микрофлора кишечника оказалась нормальной. В зависимости от полученных результатов больные были распределены на две группы: в первую было включено 52 пациента с наличием нарушений кишечной микрофлоры; во вторую - 22 больных с нормальным составом кишечной микрофлоры.
Динамика дисбиотических нарушений в кишечнике у исследуемых пациентов в процессе наблюдения представлена в таблице.
Характеристика кишечной микрофлоры у больных ЦП с наличием ПГК при первичном исследовании и по окончании наблюдения
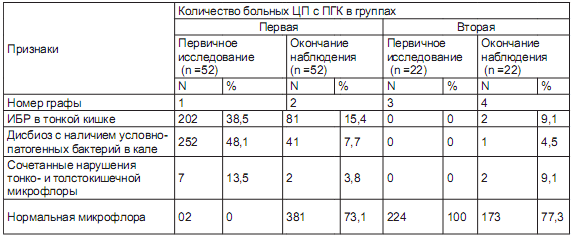
Как следует из данных, представленных в таблице, при первичном исследовании в первой группе больных ИБР в тонкой кишке выявлялся у 20 (38,5%), нарушение состава толстокишечной микрофлоры с наличием условно-патогенных штаммов бактерий - у 25 (48,07%) и сочетание дисбиоза тонкой и толстой кишки - у 7 (13,5 %) пациентов. Во второй группе больных в начале наблюдения нарушения состава кишечной микрофлоры отсутствовали.
К окончанию наблюдения нормальный состав кишечной микрофлоры был выявлен у 38 (73,1%) первой и у 17 (77,3%) второй группы. У 5 (22,7%) пациентов второй группы отмечено развитие дисбиотических нарушений. Так, ИБР в тонкой кишке, нарушение состава толстокишечной микрофлоры с выделением условно-патогенных штаммов бактерий и сочетание дисбиоза тонкой и толстой кишки были выявлены соответственно у 8 (15,4%), 4 (7,7%) и 2 (3,8%) больных первой и у 2 (9,1%), 1 (4,5 %) и у 2 (9,1 %) второй группы.
Результаты, полученные при сравнительном анализе состава кишечной микрофлоры и частоты выявления симптомов, связанных с нарушением функций кишечника, у больных ЦП при первичном исследовании и по окончании наблюдения свидетельствуют о том, что при первичном исследовании клинические проявления, связанные с нарушением функций кишечника, имели место у всех пациентов первой и у 22,7% второй группы, при этом преобладали СРК подобные нарушения, которые были обнаружены у 71,2% и у 18,2% больных первой и второй группы соответственно.
К окончанию наблюдения из 38 пациентов первой группы, у которых была достигнута нормализация кишечной микрофлоры, у 30 (78,0%) симптомы кишечной диспепсии были купированы. СРК подобные нарушения были выявлены у 6 (15,8%), абдоминальный болевой синдром - у 2 (5,3%). У остальных 14 больных, у которых оставались дисбиотические нарушения, симптомы кишечной диспепсии сохранялись.
У пациентов второй группы к окончанию наблюдения увеличилось количество больных как с кишечным дисбактериозом, так и с наличием клинических проявлений, связанных с нарушением функции кишечника. Так, если при первичном исследовании клинические симптомы отсутствовали у 77,3% пациентов, то к окончанию наблюдения их количество составило 45,5%. Таким образом, у большинства больных ЦП с наличием ПГК после проведения курса антибактериальной терапии с последующим назначением пробиотика наряду с нормализацией кишечной микрофлоры наблюдалась существенная положительная динамика клинических проявлений кишечной диспепсии.
Обсуждение полученных результатов
В проведенном нами исследовании у 70,3% больных ЦП с наличием ПГК имели место нарушения нормального состава кишечной микрофлоры, из них у 48,1% выявлялись условно-патогенные бактерии в кале и у 22,2% - избыточный бактериальный рост в тонкой кишке. Полученные нами результаты свидетельствуют о наличии у подавляющего большинства больных ЦП нарушений нормального состава кишечной микрофлоры с наличием избыточного бактериального роста в тонкой кишке и/или дисбиоза толстой кишки с выделением условно-патогенных бактерий и совпадают с литературными [5].
В связи с тем, что у большинства наблюдаемых больных ЦП с ПГК имели место клинические проявления, характерные для функциональных нарушений толстой кишки, в нашей работе особое внимание было отведено изучению роли нарушений микробиоценоза кишечника в их формировании.
Полученные нами данные свидетельствуют, что СРК-подобные нарушения, абдоминальный болевой синдром, метеоризм в разных соотношениях выявлены у всех пациентов с нарушением состава кишечной микрофлоры, тогда как у больных с нормальной микрофлорой данные симптомы встречались значительно реже. Полученные нами данные о преобладании в первой группе исследуемых больных ЦП синдромов кишечной диспепсии могут свидетельствовать о связи последних с наличием нарушений кишечной микрофлоры. Результаты наших исследований совпадают с данными, опубликованными в последние годы, в которых приводятся убедительные доказательства роли нарушений нормального состава кишечной микрофлоры и ее взаимоотношений с СО кишечника в механизмах формирования клинических проявлений синдрома раздраженной кишки [12].
Учитывая важную роль дисбиоза кишечника не только в патогенезе диспепсических симптомов, но и осложнений ЦП [4], нами исследована эффективность терапии, направленной на нормализацию кишечной микрофлоры, которая включала недельный прием невсасывающегося антибактериального препарата рифаксимина с последующим назначением пробиотика бифиформ в течение 2 недель.
В литературе имеются доказательства успешного использования рифаксимина с целью нормализации микробного биоценоза в кишечнике, что приводит к положительной динамике симптомов СРК [1]. Полученные нами результаты свидетельствуют о том, что вышеуказаная терапия способствует элиминации дисбиотических нарушений у большинства (73%) пациентов, а также купированию клинических симптомов, связанных с нарушением функции кишечника в 78,9% случаев. Результаты наших исследований подтверждаются литературными данными об эффективности терапии, направленной на нормализацию кишечной микрофлоры у больных ЦП в купировании симптомов кишечной диспепсии и профилактике осложнений ЦП [10]. Следовательно, проведение у больных ЦП с наличием ПГК терапии, направленной на нормализацию состава кишечных бактерий, является патогенетически обоснованным.
Выводы
1. У большинства больных ЦП (70,3%) с наличием портальной гипертензионной колонопатии были выявлены нарушения нормального состава кишечной микрофлоры, из них синдром избыточного бактериального роста имел место у 27%, нарушение состава толстокишечной микрофлоры с наличием условно-патогенных штаммов бактерий - у 33,8% и их сочетания - у 9,5% больных.
2. У большинства больных ЦП с нарушениями кишечной микрофлоры выявлялись СРК-подобные нарушения, что свидетельствует о роли дисбиоза кишечника в формировании симптомов кишечной диспепсии у данных пациентов.
3. Комплексная терапия с применением антибактериального препарата рифаксимина с последующим назначением пробиотика бифиформа оказалась эффективной в восстановлении кишечной микрофлоры у 73 % и купировании клинических проявлений, связанных с нарушением функций кишечника у 78,9 % больных ЦП с наличием ПГК, что подтверждает наличие патогенетической связи между нарушением состава кишечных бактерий и формированием синдрома кишечной диспепсии у данных пациентов.
СПИСОК ЛИТЕРАТУРЫ
- Агафонова Н.А Невсасывающиеся (кишечные) антибактериальные препараты в гастроэнтерологии: спектр применения рифаксимина// Consilium medicum. - 2009. - №1. С. 61-66.
- Бондаренко В.М., Боев Б.В., Лыкова Е.А., Воробьев А.А. Дисбактериозы желудочно-кишечного тракта. // Рос. журн. гастроэнтерол. гепатол. колопроктол. - 1998. - Т.8, №1. - С.66-70.
- Щеголев А.А., Аль-Сабунчи Щ.А., Гвоздик В.В., Матушкова О.С. Современные подходы к лечению больных с синдромом портальной гипертензии, осложненным кровотечением из варикозно-расширенных вен пищевода. Основные методики консервативного, эндоскопического и эндоваскулярного гемостаза. Вопросы тактики // Хирургия. - T. 6. - 2004.- №2. - С.45.
- Bauer TM, Schwacha H, Steinbruckner B, Brinkmann FE, Ditzen AK, Aponte JJ, Pelz K, Berger D, Kist M, Blum HE. Small intestinal bacterial overgrowth in human cirrhosis is associated with systemic endotoxaemia.// Am J Gastroenterol: 2002, 97: 2364-2370.
- Caly WR, Strauss E: A prospective study of bacterial infections in patients with cirrhosis. J Hepatol 1993, 18:353-358, .
- Cirera I. Bauer TM, Navasa M, Vila J. Grande L, Taura P. et al. Bacterial translocation of enteric organisms in patients with cirrhosis. J Hepatol: 2001, 34:32-37.
- Farrokhyar F., J.K. Marshall, B. Easterbrook, et al. Functional Gastrointestinal Disorders and Mood Disorders in Patients with Inactive Inflammatory Bowel Disease: Prevalence and Impact on Health.// Inflamm Bowel Dis, 2006, 12(1): 38-45.
- Fernandez J, Navasa M, Gomez J, et al.: Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis.// Hepatology. - 2002, 35:140-148.
- Hashimoto N, Ohyanagi H. Effect of acute portal hypertension on gut mucosa.// Hepatogastroenterology. - 2002, 49: 1567- 1570.
- Kenneth R. Lawrence, Pharm.D.; Jacqueline A. Klee, Pharm.D. Rifaximin for the Treatment of Hepatic Encephalopathy Pharmacotherapy. - 2008;28(8): 1019-1032.
- Marzatka Z. Terminology, Definitions and Diagnostic Criteria in Digestive Endoscopy, Third Edition. Bad Homburg: Normed Verlag, 1994.
- Othman M., Agüero R., Lin H.C. Alterations in Intestinal Microbial Flora and Human Disease, Curr Opin Gastroenterol. - 2008, 24(1):11-16.



