Производные пиразолов вызывают повышенный интерес у исследователей как вещества, обладающие широким спектром биологической активности. Сведения о гетероциклах, конденсированных с циклогексеноновым фрагментом, немногочисленны, однако имеются данные о разнообразных видах биологической активности подобных соединений [1-3].
Ранее [4] было установлено, что при конденсации фурановых халконов с ацетоуксусным эфиром в зависимости от условий проведения реакции образуются циклокетолы 1 или циклогексеноны 2 (схема 1).

Схема 1.
Реакцией циклогексенонов 2 с гидразингидратом синтезированы дигидроиндазолы, для которых методом РСА установлена структура 4,5-дигидро-2Н-1-индазолий-3-олатов [5].
С целью получения тетрагидропроизводных индазола осуществлена конденсация b-кетолов 1 с гидразингидратом и синтезированы гетероциклические соединения, для которых можно предположить несколько бициклических структур (схема 2).
Тетрагидроиндазолы 4 - бесцветные кристаллические вещества, ограниченно растворимые в полярных органических растворителях.
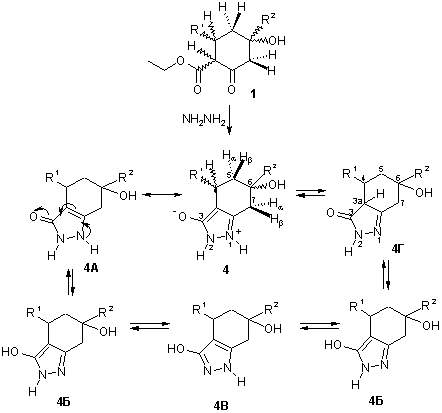
Схема 2.
В ИК спектрах соединений 4 наблюдаются заметные отличия полос поглощения по сравнению с таковыми исходных β-циклокетолов 1, что свидетельствует об изменении структуры синтезированных соединений: в спектрах соединений 4 отсутствуют интенсивные полосы поглощения, принадлежащие валентным колебаниям двух карбонильных групп в области 1740 и 1700 см-1. В то же время, появляются новые полосы поглощения в области 1630 и 1580 см-1, отнесенные нами к полосам поглощения νC=N и νC=C соответственно. В высокочастотной части спектра 3200-3300см-1 присутствует широкая полоса поглощения валентных колебаний групп OH и NH.
В спектрах ЯМР 1Н соединений 4 в слабом поле имеются сигналы ароматических протонов заместителей R1 и R2. Из-за плохой растворимости веществ спектры ЯМР 1Н записаны в CF3COOH, поэтому сигналы ОН и NH групп увидеть было невозможно. Для одного из соединений 4 удалось получить спектр ЯМР 1Н в ДМСО d6, в спектре наблюдается уширенный сигнал ОН или NH группы интенсивностью 1Н при 5,7 м.д.
Отсутствие сигналов этоксигруппы свидетельствует о прохождении переаминирования в ходе реакции.
В среднем поле имеется набор сигналов алифатических протонов алицикла. Три из них резонируют в виде спиновой системы АВХ и могут быть отнесены к протонам в положении 4 и 5. Сигнал в виде уширенного синглета или мультиплета с интенсивностью 2Н принадлежит протонам 7-Нα и 7-Нβ и по величине химического сдвига соответствует сигналам протонов 2-Нα и 2-Нβ исходных β-кетолов 1. Резонансный сигнал алифатического протона 3а-Н в положении 3а таутомерной формы 4Г отсутствует, поэтому ее можно исключить из дальнейшего рассмотрения.
ИК спектры соединений 4 и 3 содержат аналогичные полосы поглощения в области 1580-1630 см -1, поэтому можно предположить, что тетрагидроиндазолы 4 имеют так же бетаиновую структуру, как и дигидроиндазолы 3.
Исследована росторегулирующая активность синтезированных азолов. Показано, что некоторые тетрагидроиндазолы улучшают посевные качества озимой пшеницы, стимулируют рост корневой системы, способствуют повышению устойчивости проростков к подсушиванию.
СПИСОК ЛИТЕРАТУРЫ
- Дайсон Г., Мей П. Химия синтетических лекарственных веществ. М.: Мир.1964.С.114.
- Feid Allan Hassan, Soliman Raafat. Parmazie. 1980.Vol.№12. P.799.
- Pathak R. B., Bahel S. C.// J.Indian Chem. Soc. 1980. Vol.57. №11.Р.1108.
- Усова Е. Б., Лысенко Л. И., Крапивин Г. Д., Кульневич В. Г. Химия гетероцикл. соед.1996. №5. С. 639.
- Усова Е. Б., Лысенко Л. И., Крапивин Г. Д., Заводник В. Е., Кульневич В. Г. Химия гетероцикл. соед.1997. №11. С. 1459.



