Ранее нами синтезирована новая гетероциклическая система пирролоакридона по реакции Ульмана, где в качестве аминосоставляющей был применен индолин и его производные. Биохимический аспект подобного рода конденсированных систем представляет определенный интерес, поскольку в живых организмах p-элект-роноизбыточная система пиррола участвует в процессах, связанных с передачей нервных импульсов и деятельностью центральной нервной системы; некоторые p-элект-ронодефецитные гетероциклы, в том числе и акридин, обладают своеобразным мутагенным действием, что предопределяет поиск среди них противоопухолевых препаратов. Синтезированная система пирролоакридона показала различные виды биологической активности, в связи с чем нами продолжен синтез производных этой гетероциклической системы и изучение физиологической активности этих соединений.
В настоящей работе исследовалась возможность синтеза производных пирролоакридона с заместителями в пиррольном цикле, используя для этого некоторые типичные реакции электрофильного замещения, известные для индола - реакцию Манниха и формилирования, продукты которых, в свою очередь, могут открыть широкие возможности для дальнейших превращений в ряду пирролоакридонов.
При проведении реакции Манниха в условиях, описанных для индола образование 2 - диметиламинометилпирроло [3,2,1-de] акридин - 6 - она (1) можно было наблюдать только хроматографически. Для полного превращения пирроло [3,2,1-de] акридин - 6 - она реакцию следует проводить в более жестких условиях: избыток диметиламина и формальдегида, продолжительность реакции 6 часов, температура 80 - 900.
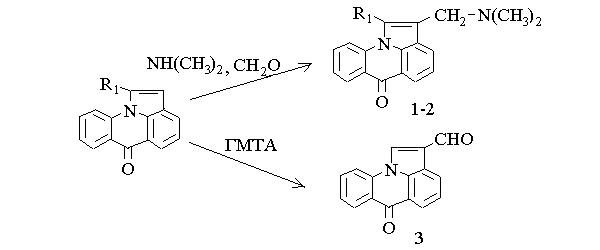
Столь большую разницу в поведении пирролоакридона и индола следует видимо связать с значительным акцепторным влиянием карбонильной группы, которое легко передается через ароматическую систему связей. Донорные же свойства метильной группы в 1-метилпирроло[3,2,1-de]акридин-6-оне значительно облегчают протекание этой реакции и при тех же соотношениях исходных компонентов количественный выход 1 - метил - 2 - диметиламинометилпирроло[3,2,1-de]акридин-6-она (2) был достигнут через 2 часа.
Строение соединений 1 и 2 подтверждено данными ПМР спектра, где присутствуют сигналы протонов Н4, Н8, Н9, с соответствующими константами спин-спинового взаимодействия и низкопольный сигнал протона Н7. Протоны Н3, Н5, Н10, вследствие наложения, дают мультиплет в области 8-8,2 м.д. и 7,92-8,15 м.д. соответственно для соединений 1 и 2. Отсутствие в спектрах сигнала протона Н2 и появление сигналов метиленовой и метильной групп по сравнению с исходными пирролоакридонами, указывает, что аминометильная группа заместила атом водорода в положении 2.
Частота поглощения группы С=О в ИК спектрах оснований Манниха меняется незначительно по сравнению с исходными соединениями.
Данные элементного анализа синтезированных веществ соответствуют вычисленным.
Провести формилирование пирроло [3,2,1-de] акридин - 6 - она в положение 3 пиррольного цикла оказалось значительно более сложной задачей. Получить формильное производное по реакции Вильсмайера не удалось, поскольку в этих условиях хлорокись фосфора взаимодействует с карбонильной группой с образованием соли - дихлорфосфата, которая, видимо, устойчива к атакам электрофилов.
В связи с этим исследована возможность получения альдегида по реакции Даффа, которая широко использовалась для синтеза формильных производных 6 и 7-азаиндола.
Кипячением пирроло [3,2,1-de] акридин - 6 - она в водном растворе уксусной кислоты с избытком уротропина нами получен 2 - формилпирроло [3,2,1-de] акридин - 6 - он (3) с 55% выходом.
Строение соединения 3 подтверждено данными элементного анализа, ИК и ПМР спектров.
В ИК спектре соединения 3 наблюдается две полосы поглощения в области 1675 и 1695 см-1, которые следует отнести к частотам поглощения карбонильной группы акридонового цикла и формильной группы.
В спектре ПМР соединения 3 имеется характерный синглет альдегидного протона с d 10,1 м.д.; отутствие в спектре сигнала протона Н2 и смещение в область слабого поля сигналов протонов Н1 и Н3, за счет дезэкранирующего влияния карбонильной группы, указывает на присутствие заместителя в положении 2.



