Глутаматергические влияния на медиальную септальную область (МС) усиливают гиппокампальный тета-ритм и облегчают процессы памяти, что свидетельствует о существенной роли глутамата в организации активности септогиппокампальных нейронов. Многими исследованиями показано, что МС является пейсмекером гиппокампального тета-ритма [см. обзор 16]. Однако внутренняя организация септального пейсмекера, являющегося комплексным образованием, во многом остается не ясной. В МС, кроме холинергических и ГАМКергических нейронов, описанных в классических работах [12] недавно была обнаружена новая, не известная ранее, популяция глутаматергических клеток [15]. В связи с этим исследование влияний глутамата на активность септальных нейронов представляет особый интерес.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось на срезах мозга якутских длиннохвостых сусликов Citellus undulatus. Основные характеристики септальных нейронов у этого вида животных не отличаются от таковых у морских свинок [1]. Изготовление и инкубация срезов проводились по стандартным методикам [2]. В септальных срезах внеклеточно регистрировали спонтанную активность нейронов в контроле и при аппликации L-глутамата (1mМ, Sigma). С целью выяснения природы нейронной активности, в срезах блокировали синаптическую передачу; для этого использовали инкубационный раствор с повышенным (до 8 мМ) содержанием Mg2SO4 и пониженным (до 0,2 мМ) содержанием CaCl2. При обработке нейронной активности оценивалась средняя частота и степень регулярности фоновых разрядов; для выявления ритмической модуляции применяли автокорреляционный и спектральный анализ. Достоверность изменений активности оценивалась при помощи критерия Стьюдента для парных выборок.
РЕЗУЛЬТАТЫ
На срезах мозга 10 животных было зарегистрировано 54 спонтанно активных нейрона МС. Средняя частота разрядов составляла 12.52 ± 1.30 имп/с. По паттерну спонтанной активности выделяли три группы нейронов: с ритмической залповой (n=24), регулярной (n=14) и нерегулярной активностью (n=16). Часть нейронов с залповой и регулярной активностью (11 и 6 клеток, соответственно) в условиях блокады синаптической передачи сохраняли паттерн разрядов, то есть являлись эндогенными пейсмекерами.
Аппликация L-глутамата приводила к обратимому изменению частоты и паттерна спонтанной активности у 55 % (30/54) септальных нейронов. Бóльшая часть этих клеток активировалась (22 из 30, 73%). При этом средняя частота спонтанной активности повышалась на 1.71 ± 0.33 имп/с (P<0.05). После прекращения подачи глутамата у 9 клеток активность возвращалась к исходному уровню в течение минуты, а у 13 клеток наблюдалась фаза торможения (позднее торможение, см. ниже). Активационные реакции на глутамат были характерны для нейронов с залповой и регулярной активностью, проявляющих свойства эндогенных пейсмекеров (рис.1, А). Глутамат также оказывал влияние на ритмическую компоненту всех регулярных и половины залповых нейронов, повышая частоту ритма на 0.97 ± 0.10 Гц (P<0.05) (рис.1, Б). Однако у части реактивных нейронов (27%, 8/30) этот классический возбуждающий нейромедиатор вызывал тормозные реакции (рис. 2, А), причем у трех клеток активность подавлялась полностью. По сравнению с контрольным уровнем, средняя частота разрядов снижалась на 10.15 ± 3.12 имп/с (P<0.05). Эту группу составляли нейроны с нерегулярной и залповой активностью, не обладающие пейсмекерными свойствами: спонтанная активность этих нейронов полностью подавлялась при блокаде синаптической передачи.
У 43% всех клеток (23/54) наблюдалось позднее торможение спонтанной активности с латентным периодом 4,47 ± 0.32 мин (рис. 2, Б). Следует отметить, что это торможение могло наблюдаться как после начальной активации (13 клеток), так и без нее (10 клеток). Этот эффект наблюдался у нейронов с нерегулярной и залповой активностью, часть этих клеток обладала пейсмекерными свойствами. Средняя частота разрядов снижалась на 6.27 ± 2.63 имп/с (P<0.05); у трех клеток активность подавлялась полностью.
ОБСУЖДЕНИЕ
Основные результаты, полученные в данной работе, заключаются в следующем. (1) Глутамат активировал или тормозил септальные нейроны, в зависимости от характера исходной активности. (2) Возбуждающий эффект наблюдался у клеток с регулярным или залповым паттерном, обладающих пейсмекерными свойствами; у этих клеток повышалась также частота ритмической активности. (3) Тормозное действие выявлялось у нейронов, не обладающих пейсмекерными свойствами.
Роль глутамата в функционировании септальных нейронов. Существует несколько аспектов, указывающих на то, что трансмиссия глутамата в МС может играть существенную роль в организации ритмической активности как в септум, так и в гиппокампе. Во-первых, глутаматергические афференты со стороны неокортикальных [10,13] и подкорковых структур [4,11] могут модифицировать ритмические разряды нейронов МС. Во-вторых (и этот аспект представляется наиболее важным), такая модификация может осуществляться посредством внутрисептальных проекций. Недавними исследованиями в медиальной области септум идентифицирована группа глутаматергических нейронов, контактирующих с ГАМКергическими [6] и, возможно, холинергическими клетками [18]. ГАМКергические нейроны обладают внутриклеточными осцилляторными свойствами [15] и являются предполагаемыми пейсмекерами гиппокампальных тета-осцилляций [5,16]. Холинергические нейроны МС обеспечивают уровень возбудимости гиппокампальных клеток, необходимый для реализации тета-ритма [14]. Часть глутаматергических нейронов МС выявляют эндогенные осцилляторные свойства, хотя они значительно слабее, чем у ГАМКергических [15]; это свойство, а также связи с другими нейронами, свидетельствуют о важной роли глутаматергических септальных элементов во внутриструктурной синхронизации и, следовательно, в генерации/регуляции тета-ритма гиппокампа.
Возможные механизмы различных влияний глутамата на септальные нейроны. В нашей работе впервые на септальных срезах показано, что глутамат может оказывать противоположное влияние на фоновую активность нейронов МС - как возбуждающее, так и тормозное. Очевидно, что активационные эффекты возникают в результате прямого действия глутамата на постсинаптическую мембрану нейронов. О прямом возбуждающем действии глутамата на септальные нейроны свидетельствуют и данные других авторов, полученные in vivo, показавшие, что частичная блокада глутаматных рецепторов в МС снижает частоту нейронных разрядов у большинства реактивных к глутамату септальных клеток [5]. В наших опытах активация под глутаматом наблюдалась лишь у клеток, обладающих регулярной или залповой активностью, сохраняющейся при блокаде синаптической передачи в бескальциевой среде; по-видимому, они являются пейсмекерными нейронами, которые, по имеющимся литературным данным, относятся к ГАМКергической популяции МС (см. выше). У этих клеток под влиянием глутамата повышалась также частота ритмической составляющей, что указывает на модуляцию осцилляторных свойств септальных нейронов этим медиатором.
Тормозные эффекты глутамата, обнаруженные в нашем исследовании, являются достаточно неожиданными Можно предположить, что они являются результатом непрямого, переключенного через ГАМКергические клетки, влияния. Это предположение базируется на фактах, полученных в исследованиях механизмов септо-гиппокампальных взаимодействий с использованием метода микродиализа, где авторы пришли к выводу об активации глутаматом ГАМК-нейронов МС, которые, в свою очередь, тормозят холинергические септальные клетки [9]. В другой работе [5] обнаружено прямое тормозное влияние предполагаемых ГАМКергических клеток на холинергические нейроны. В нашей работе тормозное действие глутамата выявлялось у относительно низкочастотных (не выше 10 имп/с) нейронов, не обладающих пейсмекерными свойствами, что свидетельствует об их не-ГАМКергической природе (возможно, они являются холинергическими или глутаматергическими). Таким образом, наши данные указывают на существование в МС локальных ГАМКергических связей, что косвенно подтверждает данные других авторов [7-9].
Возникновение более позднего торможения, выявленное у нейронов с разным типом активности, могло наблюдаться как после начальной активации, так и без нее. Очевидно, что оно также имеет ГАМКергическую природу, однако, в этом случае, по-видимому, задействованы более сложные нейронные сети. Недавно исследованиями разных авторов с применением иммуноцитохимических методов продемонстрировано существование в МС сложной внутренней сети, образованной глутаматергическими [17], холинергическими [3], и ГАМКергическими [7,8] нервными цепями. По-видимому, именно существование такой сети является причиной длиннолатентного торможения, наблюдающегося как у пейсмекерных клеток, так и у элементов, не обладающих такими свойствами. Выяснение конкретных механизмов тормозных эффектов глутамата является целью наших дальнейших исследований.
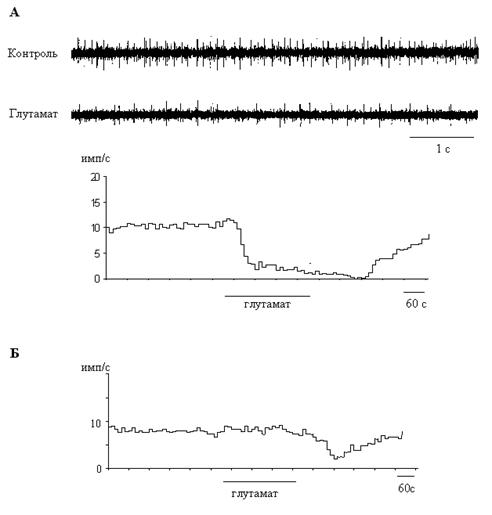
Рисунок 1.
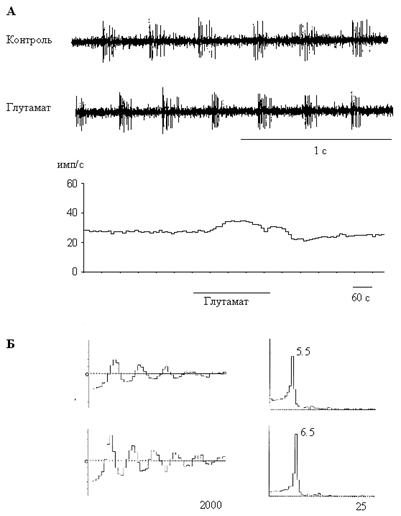
Рисунок 2.
СПИСОК ЛИТЕРАТУРЫ
- Белоусов А.Б. // Диссертация на соискание степени кандидата биологических наук. Институт биофизики клетки РАН. Пущино. 1992. С. 61.
- Зенченко К.И., Кокоз Ю.М., Иванов В.Т. Зиганшин Р.Х., Виноградова О.С. // Журн. высш. нерв. деят. 2000. Т.50. С. 231.
- Alreja M., Wu M., Liu W., Atkins J.B., Leranth C., Shanabrough M. J. Neurosci. 2000. Vol. 20. P.8103.
- Bokor H., Csaki A., Kocsis K., Kiss J. Eur.J. Neurosci. // 2002.Vol. 16. P.1227.
- Brazhnik E.S.,Fox S.E. // Exp.Brain Res.1977. Vol. 114. P. 442.
- Hajszan T., Alreja M., Leranth C. // Hippocampus. 2004. Vol.14. P. 499.
- Henderson Z., Morris N.P., Grimwood P., Fiddler G., Yang H.W., Appenteng K. // J. Comp. Neurol. 2001. Vol. 430. P. 410.
- Henderson Z., Fiddler G., Saha S., Boros A., Halasy K. // Eur. J. Neurosci. 2004. Vol. 19. P. 2753.
- Giovannini M.G., Mutolo D., Bianchi L., Michelassi A., Pepeu G. // J. Neurosci. 1994. Vol. 14. P. 1358.
- Jaskiw G.E.,Tizabi Y.,Lipska B.K., Kolachana B.S. ,Wyatt R.J., Gilad G.M. Brain Res. 1991. Vol. 550 P. 7.
- Kiss J.,Csaki A.,Bokor H., Shanabrough M.,Leranth C. // Neuroscience. 2000. Vol. 97. P. 657.
- Kohler C., Chan-Palay V., Wu J.Y. //Anat. Embryol. (Berl). 1984. Vol. 984. 169:41.
- Leranth C., Carpi D., Buzsaki G., Kiss J. // Neuroscience. 1999. Vol. 88. P. 701.
- Lee M.G., Chrobak J.J., Sik A., Wiley R.G., Buzsaki G. // Neuroscience. 1994. Vol. 62. P. 1033.
- Sotty F., Danik M., Manseau F., Laplante F., Quirion R., Williams S. // J. Physiol. 2003. Vol. 551. P. 927.
- Vinogradova O.S. // Progr. Neurobiol. 1995. Vol.45. P.523.
- Wu M., Hajszan T., Leranth C., Alreja M. // Eur. J. Neurosci. 2003. Vol. 18. P.1155.
- Wu M., Hajszan T., Leranth C., Alreja M. J. Neurophysiol. 2004. Vol. 92. P.1216.



