Эпилепсия является одним из наиболее распространенных нейрологических заболеваний. Височная форма эпилепсии практически не поддается существующим методам лечения и ассоциируется со склерозом полей СА1 и СА3 гиппокампа [5]. До настоящего времени неизвестно, какую роль в развитии этого заболевания играет медиальная септальная область (МС) - главный субкортикальный вход в гиппокамп. Эта область является основным источником холинергических и ГАМКергических афферентов гиппокампа [2,3]. В более ранней работе на модели острой эпилепсии нами было показано, что при возникновении судорожных разрядов септо-гиппокампальная система функционирует как единая нейронная сеть [1]. Целью данных экспериментов было выяснение влияний блокады или активации ГАМКА рецепторов МС на развитие судорожной активности в гиппокампе.
Методы
Эксперименты проведены на бодрствующих, слегка ограниченных в движениях кроликах. За неделю до начала экспериментов проводили операцию по вживлению в поле СА1 гиппокампа электрода для отведения ЭЭГ, а в ангулярный пучок - электрода для раздражения перфорирующего пути (ПП, неокортикальный вход в гиппокамп); над МС устанавливали канюлю, посредством которой во время опытов в МС вводили антагонист ГАМКА рецепторов пикротоксин (1-1.5 нМ/1 мкл) или агонист мусцимол (10-30 нМ/1 мкл). Судорожную активность вызывали стимуляцией ПП (5 Гц, 50-200 мкА, 10-20 сек). Запись ЭЭГ гиппокампа и ее обработку производили на компьютере Pentium-300 с помощью специальной программы. Для анализа ЭЭГ использовали метод быстрого преобразования Фурье. Для каждого теста вычисляли максимальное значение спектральной мощности частот от 0.5 до 30 Гц (шаг 0.5 Гц) в последовательных 1-минутных записях. Эффекты оценивали в процентном отношении к среднему контрольному значению, принимаемому за 100%. Статистическую обработку полученных данных проводили с помощью программы Origin 4.1; достоверность отличий от контроля определяли с помощью однофакторного дисперсионного анализа (one-way ANOVA); p<0.05 принимали за порог значимости различий.
Результаты
На трех кроликах проведено 60 опытов по регистрации активности гиппокампа в контроле (до введения веществ) и в опыте (в разные периоды времени после инъекции препаратов).
В контроле в ЭЭГ гиппокампа бодрствующих кроликов доминировала активность в полосах дельта- и тета-частот: 2-3.5 Гц и 4-6.5 Гц, соответственно. Активность в полосе 7-15 Гц была выражена слабо, а в полосе 15-30 Гц, как правило, отсутствовала (рис. 1, 1).
Инъекция в МС антагониста ГАМКА рецепторов пикротоксина (0.5-1 нМ /1 мкл), вызывала постепенное, в течение 2-4 мин, изменение частотного состава ЭЭГ: возрастание мощности как дельта, так и тета-частот (в среднем на 145"19 и 158"21 %, p<0.05) (рис. 1, 2). Кроме того, в 36 % экспериментов было выявлено постепенное усиление (на 179"20 %, p<0.01) или появление волн с частотой 7-12 Гц (рис. 1, 2-1 - 2-3); в отдельных случаях это сопровождалось дрожью вибрисс и легким беспокойством у животных, что, возможно, свидетельствовало о предсудорожном состоянии. Введение на этом фоне мусцимола (10-15 нМ) приводило к быстрому, в течение 1-3 мин, восстановлению активности (рис. 1, 3). Пикротоксин в указанных дозах резко снижал порог возникновения эпилептиформных разрядов при нанесении тетанизирующей стимуляции на ПП (рис. 2). Пикротоксин в дозах 1.2-1.5 нМ /1 мкл в большинстве случаев вызывал электрографические и поведенческие судороги (рис.3). Характерно, что перед появлением эпилептических разрядов в ЭЭГ гиппокампа наблюдалось резкое возрастание (на 245"21 %, p<0.001) или возникновение осцилляций с частотой 7-15 Гц, которые могли сопровождаться беспокойством и дрожью вибрисс (рис.3, 2-1). Через 3"0.5 мин в 80 % случаев после введения этой дозы пикротоксина развивались электрографические и поведенческие судороги (рис. 3, 2-2). Введение на этом фоне агониста мусцимола (15-30 нМ), как правило, приводило к ослаблению или прекращению судорог уже через 3-5 мин (рис. 3, 3).
Введение в МС агониста ГАМКА рецепторов мусцимола (10-15 нМ /1 мкл) в 89 % проб приводило к незначительному снижению амплитуды гиппокампальной ЭЭГ, без изменения ее спектрального состава. Иногда наблюдалась стабилизация активности на частоте 4-4.5 Гц, при параллельном снижении амплитуды ритмических волн в этом диапазоне. Мусцимол в дозе 20-30 нМ вызывал существенное снижение мощности ритмической активности в тета-диапазоне (на 142 "16 %, p<0.05) (рис. 4, 2), а также некоторое возрастание выраженности дельта-частот (на 129"15 %, p<0.05). Введение пикротоксина (1.25-1.5 нМ) через 5 мин после инъекции мусцимола (20-30 нМ) не приводило к развитию патологической активности (рис. 4, 3). Тетанизация ПП с обычными параметрами также не вызывала развития судорог (рис. 4, 4).
Обсуждение
Итак, нами впервые показана возможность управления гиппокампальной судорожной активностью при локальном воздействии на ГАМКергическую систему медиальной септальной области. Можно полагать, что введение в МС веществ ГАМКергической природы изменяет взаимоотношения между септальными нейронами, что приводит к изменению суммарного выходного сигнала септум, и, как следствие, к изменению активности гиппокампа. Морфологические и электрофизиологические исследования демонстрируют сложные внутрисептальные нейронные коммуникации [4,9]. Недавние работы показали значительное разнообразие биохимических свойств клеток МС, проецирующихся на гиппокамп: кроме холинергических и ГАМКергических проекционных нейронов, обнаруженных в классических работах [2,3,8], выявлены глутаматергические клетки и нейроны, в которых колокализуются ГАМК и ацетилхолин [7]. В МС также выявлены локальные ГАМК-содержащие клетки (интернейроны), образующие баскетные синаптические контакты на проекционных ГАМКергических септальных нейронах, и осуществляющих тормозный контроль их активности [4]. Последние, проецируясь на тормозные нейроны гиппокампа, осуществляют функцию "растормаживания" его основных, пирамидных клеток [8]. Мы предполагаем, что при введении пикротоксина в МС блокируется тормозный контроль растормаживающего ГАМКергического влияния МС на гиппокамп. Это, по-видимому, объясняет снижение порога генерации эпилептической активности в гиппокампе под пикротоксином, обнаруженное в нашей работе. Введение мусцимола может приводить к усилению внутрисептального тормозного контроля. В наших экспериментах это проявлялось в повышении порога генерации судорожной активности.
Работа поддержана фондом "Университеты России" (грант № УР 07.01.055) и фондом президента РФ (грант № НШ-1872.2003.4).
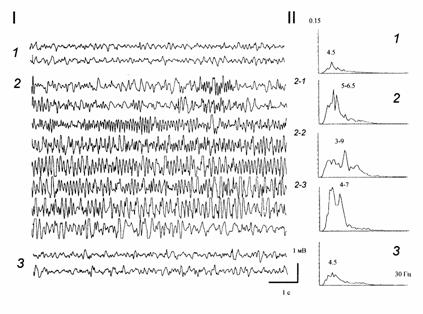
Рисунок 1. Изменение суммарной активности гиппокампа при введении антагониста ГАМКА рецепторов пикротоксина (0.75 нМ) в МС. I - ЭЭГ гиппокампа в контроле (1), после введения пикротоксина (2) и после введения (на фоне действия пикротоксина) агониста ГАМКА рецепторов мусцимола (30 нМ) (3). II - спектральные гистограммы для контрольной ЭЭГ (1), для ЭЭГ под пикротоксином (2) и муцимолом (3). По оси абсцисс - частота, Гц; по оси ординат - мощность ритмического процесса, относительные единицы. Цифры над гистограммами - спектральные максимумы. На I и II: 2-1 - 3 мин, 2-2 - 10 мин, 2-3 - 14 мин после введения пикротоксина.
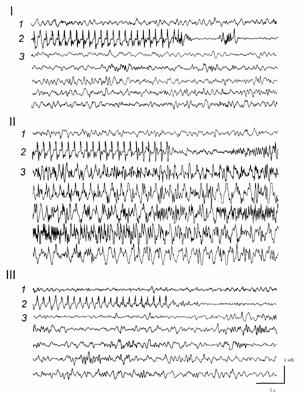
Рисунок 2. Снижение порога развития судорожных послеразрядов в гиппокампе (вызванных стимуляцией перфорирующего пути), после введение пикротоксина в МС. I - Контроль: 1 - фоновая активность. 2 - стимуляция перфорирующего пути, вызывающая единичный послеразряд. 3 - активность после стимуляции; сохраняется исходный паттерн разрядов. II - Введение пикротоксина: 1 - фоновая активность. 2 - стимуляция, вызывающая множественные послеразряды. 3 - развитие судорог. III - Введение мусцимола: 1 - фоновая активность. 2 - стимуляция перфорирующего пути, не вызывающая послеразрядов. 3 - активность после стимуляции; сохраняется исходный паттерн разрядов.
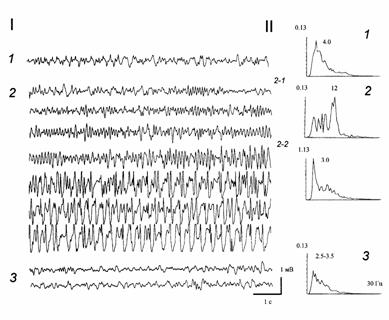
Рисунок 3. Возникновение судорожной активности в гиппокампе при инъекции в МС пикротоксина в дозе 1.5 нМ. I - ЭЭГ гиппокампа в контроле (1), после введения пикротоксина (2) и после введения (на фоне действия пикротоксина) агониста ГАМКА рецепторов мусцимола (3). II - спектральные гистограммы для контрольной ЭЭГ (1), для ЭЭГ под пикротоксином (2) и муцимолом (3). По оси абсцисс - частота, Гц; по оси ординат - мощность ритмического процесса, относительные единицы. Цифры над гистограммами - спектральные максимумы. На I и II: 2-1 - 2 мин, 2-2 - 4 мин после введения пикротоксина.
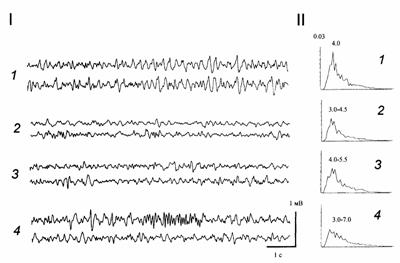
Рисунок 4. Изменение суммарной активности гиппокампа при введении агониста ГАМКА рецепторов мусцимола (30 нМ) в МС. I - ЭЭГ гиппокампа в контроле (1), после введения мусцимола (2), после введения (на фоне действия мусцимола) антагониста ГАМКА рецепторов пикротоксина (1.5 нМ) (3), и после стимуляции перфорирующего пути на фоне действия веществ (4). II - спектральные гистограммы для контрольной ЭЭГ (1), для ЭЭГ под мусцимолом (2), пикротоксином (3) и после стимуляции на фоне действия веществ (4). По оси абсцисс - частота, Гц; по оси ординат - мощность ритмического процесса, относительные единицы. Цифры над гистограммами - спектральные максимумы.
СПИСОК ЛИТЕРАТУРЫ
- Кичигина В.Ф., Брагин А.Г. // Журн. высш. нерв. деят. 2005. В печати.
- Freund T.F., Antal M. // Nature. 1988. Vol.336. P.170.
- Frotscher M., Leranth C. J. // Comp. Neurol. 1985. Vol.239. P.237.
- Henderson Z., Fiddler G., Saha S., Boros A., Halasy K. // European J. Neurosci. 2004. Vol.19. P.2753.
- Lewis D.V. // Curr. Opin. 1999. Vol.12. P.197.
- Petshe H., Stumpf C., Gogolák G. // Electroencephalogr.Clin.Neurophysiol. 1962. Vol.14. P. 202.
- Sotty F., Danik M., Manseau F., Laplante F., Quirion R., Williams S. // J. Physiol. 2003. Vol.551. P.927.
- Toth K., Freund T.F., Miles R. // J. Physiol. 1997. Vol.500. P.463.
- Wu M. Hajszan T., Leranth C., Alreja M. // European J. Neurosci. 2003. Vol. 18. P.1155



