В известной нам литературе данные о растворимости гидроксидов металлов немногочисленны и весьма противоречивы. Известно только, что для большинства ионов металлов соответствующие им гидроксиды являются малорастворимыми соединениями. Расчет минимальной растворимости гидроксидов металлов затруднен отсутствием в большинстве случаев достаточно полных и надежных данных о константах равновесия и произведениях растворимости. Значения рН осаждения гидроксидов металлов также очень противоречивы.
Обычно растворимость малорастворимых соединений рассчитывают по произведению растворимости. Однако, как это экспериментально установлено, для определения растворимости гидроксидов металлов в водных растворах необходимо количественно учитывать процесс гидролиза, который значительно увеличивает растворимость гидроксидов.
Равновесие между гидроксидом состава Me(OH)n(тв.) (Me - ион металла, n - степень его окисления) с насыщенным водным раствором описывается следующим уравнением:
Me(OH)n(тв.) Û Men+ + nOH- (1)
Константа равновесия данной реакции называется произведением растворимости и имеет вид:
ПР = [Men+]·[OH-]n (2)
С другой стороны, помимо реакции (1) над осадком гидроксида металла протекают процессы образования гидроксокомплексов в соответствии со следующим уравнением:
iMеn+ + jOH- Û Mеi(OH)j (3)
Количественной характеристикой равновесий (3) служат общие константы образования соответствующих гидроксокомплексов, которые определяются следующим образом:
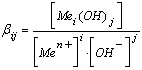 (4)
(4)
Важной характеристикой равновесия осадков гидроксидов с насыщенным водным раствором является растворимость S, которая равна суммарной концентрации всех гидроксокомплексов металла в растворе, образованных в результате растворения осадка:
![]() (5)
(5)
Концентрацию иона металла Men+ можно найти из произведения растворимости (2), а концентрации гидроксокомплексов - из общих констант образования (4). Также для гидроксидов металлов характерно изменение растворимости в зависимости от рН по кривой с минимумом, т.е. при некотором значении рН растворимость гидроксида металла S = Smin.
В данной работе предложен простой метод расчета минимальной растворимости гидроксидов металлов в водной среде, а также значений рН, при которых растворимость минимальна.
Отметим, что разброс литературных данных по значениям произведений растворимости гидроксидов металлов весьма значителен и достигает в некоторых случаях восьми порядков. Причиной таких существенных расхождений может являться изменение состава и свойств гидроксидов вследствие существования нескольких их модификаций, в том числе псевдостабильных, а также процесс старения, который приводит к изменению состава, структуры, свойств и, в первую очередь, уменьшению растворимости. Так, для свежеосажденных гидроксидов произведение растворимости всегда выше, чем для состаренных.
Наблюдаемые расхождения в общих константах образования гидроксокомплексов металлов, приводимых в справочной литературе, могут быть объяснены различием методов и условий проведения эксперимента у разных авторов.
Наиболее достоверные и надежные значения общих констант образования гидроксокомплексов и произведения растворимости гидроксидов, на наш взгляд, представлены в табл.1 и 2.
Если предположить, что в области минимальной растворимости металл находится в водном растворе в виде нейтрального гидроксокомплекса Ме(ОН)n0 и соседних комплексов Ме(ОН)n-1 и Mе(OH)n+1, то в соответствии с уравнением (5) растворимость гидроксидов Ме (II) и Me (III) будет определяться выражениями:
SII = [Mе(OH)+] + [Mе(OH)20] + [Mе(OH)3-] (6)
SIII = [Mе(OH)2+] + [Mе(OH)30] + [Mе(OH)4-] (7)
С учетом выражений для произведения растворимости (2) и общих констант образования (4) уравнения (6), (7) принимают форму:
SII = ПР∙b11∙[ОH-]-1 + ПР∙b12 + ПР∙b13∙[ОH-] (8)
SIII = ПР∙b12∙[ОH-]-1 + ПР∙b13 + ПР∙b14 ∙[ОH-] (9)
Известно, что для ионов металлов растворимость как функция рН проходит через минимум. Значение Smin определяется из условия ![]() .
.
Продифференцировав уравнения (8), (9) по рН, получаем
![]() - ПР∙b11∙[ОH-]-2 + ПР∙b13 (10)
- ПР∙b11∙[ОH-]-2 + ПР∙b13 (10)
![]() - ПР∙b12∙[ОH-]-2 + ПР∙b14 (11)
- ПР∙b12∙[ОH-]-2 + ПР∙b14 (11)
очевидно, что уравнение (10) равно нулю при
![]() (12)
(12)
а уравнение (11) при
![]() (13)
(13)
Приблизительный интервал начальных и конечных значений рН, соответствующих Smin можно найти из предположения, что рНнач. соответствует равенству [Ме(ОН)n0] = [Ме(ОН)n-1], а рНкон. равенству [Ме(ОН)n0]=[Mе(OH)n+1]. Тогда в соответствии с уравнением (4):
для Ме(ОН)2(тв.)
![]()
![]() (14)
(14)
для Ме(ОН)3(тв.)
![]()
![]() (15)
(15)
Таблица 1. Значения рПР гидроксидов тяжелых металлов
|
Гидроксид |
рПР |
Гидроксид |
рПР |
|
Zn(OH)2 |
16,86 (ZnO неакт.) |
Pb(OH)2 |
15,28 (PbO красн.) |
|
Cu(OH)2 |
20,38 (CuO кр.) |
Co(OH)2 |
15,70 (роз.) |
|
Fe(OH)2 |
15,15 (акт.) |
Cd(OH)2 |
14,35 (β) |
|
Ni(OH)2 |
17,20 (кр.) |
Fe(OH)3 |
39,50 (FeOOH аморф.) |
|
Mn(OH)2 |
12,80 (акт.) |
Cr(OH)3 |
30,00 (акт.) |
Таблица 2. Значения общих констант образования гидроксокомплексов металлов (lg βij)
|
Металл |
Комплекс |
lg βij |
Металл |
Комплекс |
lg βij |
|
Zn2+ |
Zn(OH)+ Zn(OH)20 Zn(OH)3- Zn(OH)42- Zn2(OH)3+ Zn2(OH)62- |
5,04 11,10 13,60 14,80 5,00 26,20 |
Pb2+ |
Pb(OH)+ Pb(OH)20 Pb(OH)3- Pb2(OH)3+ Pb3(OH)42+ Pb4(OH)44+ Pb6(OH)84+ |
6,29 10,88 13,94 7,64 32,12 35,12 68,39 |
|
Cu2+ |
Cu(OH)+ Cu(OH)20 Cu(OH)3- Cu(OH)42- Cu2(OH)22+ |
>6,00 >10,70 >14,20 16,40 17,64 |
Co2+ |
Co(OH)+ Co(OH)20 Co(OH)3- Co(OH)42- Co2(OH)3+ Co4(OH)44+ |
4,35 9,20 10,50 9,70 2,80 25,47 |
|
Fe2+ |
Fe(OH)+ Fe(OH)20 Fe(OH)3- Fe(OH)42- |
4,50 7,40 11,00 10,00 |
Cd2+ |
Cd(OH)+ Cd(OH)20 Cd(OH)3- Cd(OH)42- Cd2(OH)3+ Cd4(OH)44+ |
3,92 7,65 >8,70 8,65 4,61 23,15 |
|
Ni2+ |
Ni(OH)+ Ni(OH)20 Ni(OH)3- Ni(OH)42- Ni2(OH)3+ Ni4(OH)44+ |
4,14 9,00 12,00 <12,00 3,30 28,26 |
Fe3+ |
Fe(OH)2+ Fe(OH)2+ Fe(OH)30 Fe(OH)4- Fe2(OH)24+ Fe3(OH)45+ |
11,81 22,33 >30,00 34,40 25,05 49,70 |
|
Mn2+ |
Mn(OH)+ Mn(OH)20 Mn(OH)3- Mn(OH)42- Mn2(OH)3+ Mn2(OH)3+ |
3,41 5,80 7,20 7,70 3,44 18,10 |
Cr3+ |
Cr(OH)2+ Cr(OH)2+ Cr(OH)30 Cr(OH)4- Cr2(OH)24+ Cr3(OH)45+ |
10,00 18,30 24,00 28,60 22,94 47,85 |
От значений [OH-] можно перейти к рН, используя уравнение для ионного произведения воды рН = 14 - рОН.
Подставляя в уравнения (8), (9) соответствующие [ОН-] из (12), (13), получим выражения для минимальной растворимости гидроксидов Ме(ОН)2(тв.) и Ме(ОН)3(тв.):
 (16)
(16)
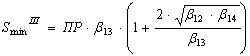 (17)
(17)
Из уравнений (12) - (17) следует, что минимальное значение растворимости гидроксидов зависит не только от величины произведения растворимости и общей константы образования нульзарядного комплекса β12 или β13, но и от значений констант соседних гидроксокомплексов. Величины рН, соответствующие Smin, а также рНнач. и рНкон. определяются только соотношениями между константами образования гидроксокомплексов.
Рассчитанные по уравнениям (16) и (17) значения минимальной растворимости и значения рН, соответствующие им, гидроксидов цинка (II), меди (II), железа (II), марганца (II), никеля (II), кобальта (II), кадмия (II), свинца (II), железа (III) и хрома (III) приведены в табл. 3.
Таблица 3. Интервал рН, соответствующий минимальной растворимости, рНопт. и минимальная растворимость гидроксидов металлов в воде
|
Men+ |
Упрощенный метод расчета |
Полный метод расчета |
||||
|
Интервал рН |
pHопт. |
Smin, моль/л |
Интервал рН |
pHопт. |
Smin, моль/л |
|
|
Zn2+ |
7,9 - 11,5 |
9,7 |
1,8·10-6 |
9,5-10,5 |
10 |
1,8·10-6 |
|
Cu2+ |
9,3 - 10,5 |
9,9 |
3,1·10-10 |
~10 |
10 |
3,2·10-10 |
|
Fe2+ |
10,4 - 11,1 |
10,8 |
1,0·10-7 |
10,5-11 |
11 |
1,1·10-7 |
|
Ni2+ |
9,1 - 11,0 |
10,1 |
8,2·10-9 |
10-10,5 |
10 |
8,4·10-9 |
|
Mn2+ |
11,6 - 12,6 |
12,1 |
1,6·10-7 |
~13 |
13 |
1,1·10-6 |
|
Pb2+ |
9,4 - 10,9 |
10,2 |
5,3·10-5 |
10-10,5 |
10 |
6,0·10-5 |
|
Co2+ |
9,2 - 12,7 |
10,9 |
3,3·10-7 |
10-11,5 |
11 |
3,3·10-7 |
|
Cd2+ |
10,3 - 12,9 |
11,6 |
2,2·10-7 |
11-12 |
11,5 |
2,2·10-7 |
|
Fe3+ |
6,3 - 9,6 |
8,0 |
3,3·10-10 |
7-9 |
8 |
3,3·10-10 |
|
Cr3+ |
8,3 - 9,4 |
8,9 |
1,6·10-6 |
8,5-9 |
9 |
1,6·10-6 |
Из табл. 3 видно, что растворимость гидроксидов изменяется в широких пределах от 5,34·10-5 моль/л для Pb(OH)2 до 3,31·10-10 моль/л для Fe(OH)3.
Проанализировав полученные цифры, гидроксиды металлов по растворимости можно расположить в следующий ряд: Pb2+ > Zn2+ > Cr3+ > Co2+ > Cd2+ > Mn2+ > Fe2+ > Ni2+ > Cu2+ > Fe3+.
Проанализировав табл. 3, можно сделать вывод, что интервал рН, при котором растворимость минимальна, рассчитанный по упрощенному методу более широкий, чем интервал, рассчитанный по полному методу. Однако по упрощенному методу можно более точно определить рНопт. Отметим также, что значения минимальной растворимости практически совпадают для всех металлов, кроме марганца. Причиной расхождений является то, что в области минимальной растворимости вклад в растворимость вносят не только комплексы Mn(OH)20, Mn(OH)3-, Mn(OH)42- но и полиядерный комплекс Mn2(OH)3+ (доля которого составляет 30 %). Итак, для цинка, никеля, свинца, кобальта, кадмия, меди, железа (II) и (III), хрома (III) растворимость гидроксидов в воде можно рассчитывать по упрощенному методу с учетом образования нейтрального гидроксокомплекса и двух соседних. Для марганца же пренебрежение той или иной константой гидроксообразования может привести к значительной ошибке.
Таким образом, предложенный в данной работе метод расчета минимальной растворимости гидроксидов металлов позволяет установить связь между константами образования гидроксокомплексов металлов и значениями рН осаждения гидроксидов, оценить эффективность гидроксидного метода очистки сточных вод от ионов металлов, определить точное значение рН, соответствующее минимальной растворимости гидроксидов в водных растворах, а также оценить приблизительный интервал оптимальных значений рН. Полученные данные позволяют усовершенствовать процессы очистки природных и промышленных вод от ионов тяжелых металлов.



