В опыте использовались белые беспородные мыши весом 20-30 г. При частичной гепатэктомии удаляли левую наружную и левую внутреннюю доли печени (2/3 части). Мышей забивали декапитацией. Ядра выделяли из гомогената печени, ресуспендированного в 0,05 М трис-НСl буфере (рН 9,0), содержащем 0,25 М сахарозы, 5 мМ СаСI2 и 20 мМ NH4CI [1]. Чистоту ядерной фракции контролировали при помощи световой микроскопии. Высокорастворимую фракцию хроматина (Хр-1) получали экстракцией буфером ТМ (10 мМ Tris-HCI (рН 7,5), с 0,2 мМ MgCl2) при 4оС. После повторной экстракции получали вторую фракцию растворимого хроматина (Хр-2). Затем из остатков ядер экстрагировали хроматин в ТМ-буфере, содержащем 2 М NaCl, и получали высокосолевую фракцию хроматина (Хр-ВС). После отмывания ядерного остатка в ТМ-буфере, содержащем 1 %-ный тритон Х-100, получали конечную фракцию хроматина, связанного с ядерным матриксом (Хр-ЯМ). Липиды из изолированных фракций хроматина экстрагировали смесью хлороформ-метанол (1:2, по объему) [3]. Окисленность липидов регистрировали спектрофотометрическим методом и оценивали по величинам индексов окисленности А232/А215 и А275/А215. Малоновый диальдегид (МДА) определяли с помощью ТБК-теста. Концентрацию белка определяли методом Бредфорд, ДНК с реактивом Дише, РНК орциновым методом [2]. Полученные данные обрабатывали методами вариационной статистики с использованием t-критерия Стьюдента.
Биохимический анализ нуклеиновых кислот и белка показал, что в регенерирующей печени мышей пик транскрипционной активности приходится на 3 час, а репликативной активности на 21,5 час после гепатэктомии.
В липидах хроматина в динамике процесса регенерации печени содержание начальных продуктов пероксидации, определяемое по величинам индексов окисленности липидов А232/А215 (диеновые коньюгаты) и А275/А215 (триеновые коньюгаты), максимально возрастало во фракции растворимого хроматина во время пика транскрипционной активности (рис. 1; 2). В липидах, входящих в состав высокорастворимого хроматина, напротив, отмечено уменьшение окисленности липидов как во время транскрипционной, так и репликативной активностей. В хроматине, прочно связанным с ядерным матриксом, накопление окисленных липидов происходило во время пика репликации ДНК.
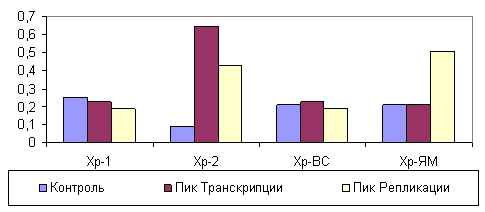
Рисунок 1. Изменение ИОДК во фракциях хроматина, различающегося степенью прикрепления к ядерному матриксу.
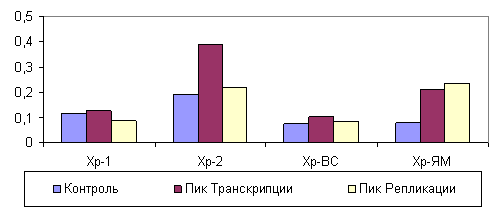
Рисунок 2. Изменение ИОТК во фракциях хроматина, различающегося степенью прикрепления к ядерному матриксу.
Уровень вторичного продукта пероксидации липидов малонового диальдегида, определяемого в сумме ТБК-реактивных продуктов, максимально накапливался во второй фракции растворимого хроматина и хроматина, связанного с ядерным матриксом, в период высокой транскрипционной активности (рис. 3). При репликации ДНК уровень МДА в хроматине оставался высоким, но при этом формировалась тенденция понижения содержания ТБК-реактивных продуктов.
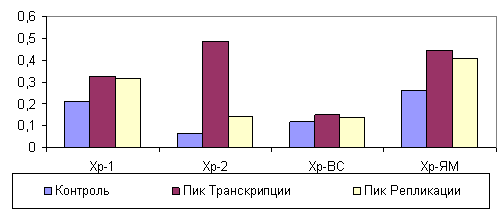
Рисунок 3. Изменение содержания ТБК - активных продуктов во фракциях хроматина, различающегося прочностью прикрепления к ядерному матриксу
Наличие в печени большого запаса антиоксидантов, обладающих различным механизмом действия, высокого репаративного потенциала, подчинение метаболизма строгой гормональной регуляции определяет относительно небольшой подъем уровней продуктов пероксидации липидов хроматина во время регенерации. В тоже время, интенсивность перекисного окисления липидов хроматина, различающегося прочностью прикрепления к ядерному матриксу и структурной организацией, может изменяться под влиянием качественных особенностей и количественного состава липидов, принимающих важное участие в структурно-функциональной организации ДНК на разных ее уровнях.
- Бойков П. Я., Костюк В. Г., Терентьев А. А., Шевченко Н. А. Концентрирование протоонкогенов в ядрах гепатоцитов / Молекулярная биология. 1995.- Т.29. №5. с. 1137-1144.
- Досон Р., Элиот Д..Элиот У., Джонс К. Справочник биохимика. М: Мир.- 1991. 544с.
- Кейтс М. Техника липидологии. Выделение, анализ и идентификация липидов.-М.: Мир.- 1975.- 322 с.
- Стручков В.А., Стражевская Н.Б. Структурные и функциональные аспекты ядерных липидов нормальных и опухолевых клеток / Биохимия. 2000.- Т.65.- №5. с. 620-643.



