В последние десятилетия в связи с улучшением условий труда и снижением радиационной нагрузки на персонал предприятий атомной промышленности и энергетики основной причиной заболеваемости и инвалидизации работников, контактирующих с ионизирующим излучением, становятся не профессиональные (лучевая болезнь), а общесоматические заболевания, одно из ведущих мест среди которых принадлежит сердечно-сосудистой патологии [4].
Результаты многочисленных экспериментальных и клинических исследований в области радиационной медицины не выявляют стимулирующего воздействия «малых доз» ионизирующей радиации на процессы атерогенеза и развитие сердечно-сосудистых заболеваний (ССЗ) [9, 11]. Однако, данные динамических эпидемиологических наблюдений за состоянием здоровья ликвидаторов последствий аварии (ЛПА) на Чернобыльской АЭС, подвергшихся облучению в «малых» и «средних» дозах, свидетельствуют о статистически достоверном росте общей заболеваемости данной категории лиц, обусловленным, в первую очередь, более высокой частотой ССЗ и психических расстройств [18]. И хотя большинство исследователей считают, что основной причиной выявленных сдвигов в структуре заболеваемости ЛПА является хронический нервно-эмоциональный стресс [6, 16], имеются литературные источники [1, 17], указывающие на наличие взаимосвязи между полученной дозой внешнего облучения и более ранним, по сравнению с возрастными нормами, развитием у ЛПА атеросклероза и ишемической болезни сердца.
Исходя из вышеизложенного, чрезвычайно важным представляется изучение состояния липидного обмена и вероятности риска развития атеросклероза у практически здоровых мужчин, контактирующих с ионизирующим излучением в условиях нормальной работы реактора АЭС.
Материал и методы исследования.
Под нашим наблюдением находилось 226 практически здоровых (не имеющих в анамнезе хронических заболеваний и не предъявляющих жалоб во время профосмотра) мужчин в возрасте от 30 до 50 лет с индивидуальными накопленными эффективными дозами (НЭД) облучения от 0,012 до 10 сЗв, работающих в контакте с ионизирующим излучением (Балаковская АЭС) от 1 до 15 лет. В зависимости от возрастного статуса все обследованные были разделены на две группы. В группу 1 вошли мужчины в возрасте от 30 до 39 лет (средний возраст 35,1±0,3 года); группу 2 составили работники в возрасте от 40 до 50 лет (средний возраст 44,3±0,3 года). Для оценки возможного влияния величины НЭД на основные показатели системы холестеринового гомеостаза [19] в данных возрастных группах дополнительно были выделенные четыре подгруппы: A - НЭД менее 0,5 сЗв, B - НЭД от 0,5 до 1,5 сЗв, C - НЭД от 1,5 до 4,5 сЗв и D - НЭД от 4,5 до 10 сЗв. Подгруппы 1А и 2А рассматривались в качестве групп сравнения, так как в соответствии с «Концепцией проживания населения в районах, пострадавших от аварии на Чернобыльской АЭС» годовая эффективная доза 0,5 сЗв установлена в качестве предельно допустимой, не вызывающей негативного воздействия на здоровье населения, проживающего на загрязненных территориях [3].
Показатели липидного обмена - содержание общего холестерина (ХС), ХС липопротеидов высокой плотности (α-ХС) и триацилглицеридов (ТГ) определяли унифицированными ферментативными методами, концентрацию ХС липопротеидов очень низкой и низкой плотности (β-ХС) рассчитывали по Rifkind [7], коэффициент атерогенности (КА) по А.Н. Климову [8], тип дислипопротеидемии (ДЛП) определяли по Fredrickson [12]. При фенотипировании ДЛП и оценки вероятности развития атеросклероза использовали общепринятые референтные значения показателей липидного обмена [7, 8, 15].Концентрацию тестостерона (Т) исследовали стандартизированным иммуноферментным методом. Статистическая обработка полученных данных проводилась на IBM PC с использованием программ "EXCEL-2000"Результаты исследования и их обсуждение.Общеизвестно, что показатели липидного обмена и уровня половых гормонов имеют свои возрастные значения нормы, обусловленные изменениями нейрогормональной регуляции метаболизма и снижением ряда физиологических функций организма в процессе его старения [7, 8]. Результаты исследования влияния возраста на значения основных показателей системы холестеринового гомеостаза выявили (табл.1) статистически достоверное различие по уровню ХС (р < 0,01), β-ХС (р < 0,001) и КА (р < 0,05) среди обследованных лиц разных возрастных групп. При этом возраст находился в слабой положительной корреляционной связи только с концентрацией общего ХС (+0,28) сыворотки крови. Несмотря на то, что в обеих группах средние значения концентрации ХС и β-ХС соответствовали нижним пределам возрастной нормы, в группе 2 отмечался повышенный (по сравнению с референтными величинами) средний уровень КА, что могло свидетельствовать о наличии в старшей возрастной группе лиц с атерогенными нарушениями по типу первичных гипоальфалипопротеинемий [15]. На это указывали и результаты корреляционного анализа, выявившего наиболее значимую отрицательную связь между уровнем α-ХС и величиной КА: α-ХС (-0,79), β-ХС (+0,58), ХС (+0,52) и ТГ (+0,49).
Таблица 1. Показатели липидного обмена и уровень тестостерона у работников АЭС.
|
Группы |
ХС (млмоль/л) М±d |
α-ХС (млмоль/л) М±d |
β-ХС (млмоль/л) М±d |
КА М±d
|
ТГ (млмоль/л) М±d |
Т (нмоль/л) М±d |
НЭД (сЗв) М±d |
|
Группы 1+2 |
4,93±0,06 |
1,53±0,03 |
2,77±0,07 |
2,4±0,1 |
1,34±0,06 |
20,14±0,49 |
2,61±0,19 |
|
Группа 1 п=111 |
4,72±0,07
|
1,53±0,04
|
2,50±0,12
|
2,3±0,1
|
1,29±0,08
|
19,67±0,65 |
2,23±0,24 |
|
Возраст. норма |
5,09±0,16 |
1,59±0,09 |
3,44±0,22 |
2,2±0,2 |
1,24±0,08 |
> 12 |
|
|
Группа 2 п=115 |
5,16±0,09 ** |
1,58±0,03 |
3,00±0,09 *** |
2,6±0,1 * |
1,38±0,07
|
20,60±0,71 |
2,95±0,32 * |
|
Возраст. норма |
5,32±0,17 |
1,66±0,09 |
3,88±0,18 |
2,4±0,2 |
1,47±0,19 |
> 12 |
|
Примечание. * - p < 0,05; ** - p < 0,01; *** - p < 0,001 - различия достоверны по сравнению с группой 1.
Проведенное исследование продемонстрировало высокую вариабельность уровня свободного тестостерона в сыворотке крови мужчин обеих возрастных групп.. В отсутствии какой-либо зависимости между возрастом обследованных лиц и уровнем этого гормона., обращала на себя внимание отрицательная корреляционная связь между содержанием Т, концентрацией ТГ (-0,32) и β-ХС (-0,39), а также величиной КА (-0,35). Причем, у лиц обеих групп с КА выше 4-х практически всегда отмечались пониженные (менее 12 нмоль/л) значения уровня тестостерона. И хотя до настоящего времени вопрос антиатерогенного действия тестостерона остается дискуссионным [14], полученная закономерность позволяет рассматривать снижения уровня данного гормона ниже физиологической нормы в качестве дополнительного предиктора риска развития атеросклероза у мужчин молодого и среднего возраста.
Достоверное различие (табл. 1) в средних уровнях НЭД (p < 0,05) между выбранными группами обследованных лиц позволяло предположить, что характерные для группы 2 атерогенные изменения липидного спектра, могли быть обусловлены не только возрастным фактором, но и более высокой дозовой нагрузкой радиационного облучения мужчин старше 40 лет. В отличие от ожидаемого негативного воздействия хронического ионизирующего облучения на продукцию половых гормонов и состояние липидного обмена, результаты проведенного исследования продемонстрировали низкую корреляционную связь между величиной НЭД, уровнем a-ХС (+0,24) и КА (-0,15), направленность которой могла свидетельствовать об антиатерогенном действии «малых доз» облучения.
Для уточнения характера дозо-зависимых эффектов ионизирующего излучения была проведена сравнительная оценка влияния четырех выбранных градаций НЭД на показатели липидного обмена и уровень тестостерона у обследованных лиц разных возрастных групп.
Таблица 2. Влияние накопленной эффективной дозы облучения на показатели липидного обмена и уровень тестостерона у работников АЭС разных возрастных групп
|
Группы |
ХС (млмоль/л) М±d |
α-ХС (млмоль/л) М±d |
β-ХС (млмоль/л) М±d |
КА М±d
|
ТГ (млмоль/л) М±d |
Т (нмоль/л) М±d |
НЭД (сЗв) М±d |
|
Группа 1А п=29 |
4,66±0,22 |
1,40±0,06
|
2,50±0,26 |
2,5±0,1
|
1,31±0,11
|
17,19±1,67 |
0,20±0,03 |
|
Группа 1В п=27 |
4,71±0,13 |
1,55±0,06 |
2,57±0,14 |
2,2±0,2 |
1,40±0,22 |
18,96±1,82 |
0,91±0,05 |
|
Группа 1С п=38 |
4,76±0,20 |
1,62±0,08 ** |
2,45±0,18 |
2,1±0,2 * |
1,17±0,13 * |
20,83±1,91 * |
2,92±0,14 |
|
Группа 1Д п=17 |
4,78±0,18 |
1,57±0,10 |
2,47±0,07 |
2,2±0,2 |
1,39±0,24 |
24,73±2,55 ** |
7,11±0,60 |
|
Группа 2А п=24 |
5,18±0,21 |
1,42±0,07
|
3,10±0,17 |
2,8±0,2
|
1,45±0,15 |
19,93±2,81 |
0,17±0,03 |
|
Группа 2В п=33 |
5,01±0,17 |
1,53±0,09 |
2,81±0,15 |
2,5±0,2 |
1,29±0,11 |
19,6±1,92 |
0,91±0,04 |
|
Группа 2С п=30 |
5,20±0,19 |
1,70±0,08 ** |
2,96±0,20 |
2,4±0,3 * |
1,32±0,14 |
21,42±2,01 |
2,69±0,15 |
|
Группа 2Д п=28 |
5,26±0,23 |
1,47±0,07 |
3,20±0,26 |
2,7±0,2 |
1,44±0,13 |
21,44±2,07 |
7,22±0,39 |
Примечание. * - p < 0,05; ** - p< 0,01 - внутригрупповые различия достоверны по сравнению с группами 1А и 2А.
Как видно из представленных данных (табл. 2), в обеих группах по мере возрастания средних значений НЭД до уровня 3 сЗв прослеживалась общая тенденция снижения вероятности риска развития атеросклероза, что подтверждалось статистически достоверным снижением КА в подгруппах 1С и 2С (р < 0,05) до значений, соответствующих возрастной норме.
Выявленные позитивные сдвиги в липопротеиновом спектре, в первую очередь, были связаны с достоверным увеличением пула α-ХС (р < 0,01) у лиц обеих возрастных групп. Причем у мужчин моложе 40 лет повышение концентрации α-ХС сопровождалось сочетанным снижением содержания сывороточных ТГ (р < 0,05) и ростом уровня свободного тестостерона, значения которого в группах 1С и 1Д возрастали в среднем на 21,1 и 43,8 %, соответственно, что, по нашему мнению, могло свидетельствовать о комплексном действии «малых доз» ионизирующего излучения на ключевые параметры липидного обмена и связанный с ним метаболизм стероидных гормонов.
Наиболее наглядно данная закономерность прослеживалась при анализе влияния величины НЭД на степень риска развития атеросклероза у находившихся под наблюдением практически здоровых мужчин, которую в соответствии с общепринятыми методами [8, 12] рассматривали на фоне гипертриглицеридемии (>1,6 млмоль/л) как умеренную при КА больше 3-х и как высокую при КА выше 4-х. Результаты исследования показали (рис.1), что частота распространения нарушений липидного обмена у работников АЭС, контактирующих с ионизирующим излучением, составляла в среднем 23,3% и соответствовала медико-статистическим данным по Российской Федерации (20-30%) [15].
Фенотипирование ДПЛ, проведенное среди всех лиц с вероятностью риска развития атеросклероза, выявило преимущественное наличие ДЛП типа IIа (40,7 %), IV (29,5 %) и гипоальфалипопротеинемии (29,5 %). Причем для подгрупп 1С и 2С был характерен только последний тип. Среди обследованных подгруппы 1С как умеренный, так и высокий риск развития атеросклероза определялся в два раза реже, чем у персонала АЭС с НЭД ниже 0,5 сЗв. Для подгрупп 2А и 2С это различие было менее значимым и составляло, соответственно, 1,7 и 1,3 раза, что, на наш взгляд, могло быть связано как с возрастным фактором, так и с более длительным производственным контактом с ионизирующим излучением.
Общеизвестно, что дозозависимые эффекты радиационного воздействия носят кинетический характер и во многом определяются мощностью поглощенной дозы излучения, то есть временным периодом, в течение которого происходит накопление организмом эффективной дозы облучения [3]. Учитывая, что у обследованных лиц величина НЭД находилась в положительной корреляционной связи (+0,43) с длительностью работы в контакте с ионизирующим излучением, было проведено дополнительное сочетанное исследование влияния стажа работы и величины НЭД на наиболее значимые показатели липидного обмена. Для чего, все находившиеся под наблюдением лица, исходя из стажа работы с источниками радиации, были разделены на следующие группы: группа I - стаж работы от 1 до 5 лет, группа II - стаж работы от 5 до 10 лет, группа III -стаж работы от 10 до 15 лет. Дополнительно в зависимости от величины НЭД в каждой группе были выделены подгруппы: A - НЭД менее 0,5 сЗв, B - НЭД от 0,5 до 1,5 сЗв, C - НЭД от 1,5 до 4,5 сЗв и D - НЭД от 4,5 до 10 сЗв. В исследование не вошли подгруппы IД и IIIА, так как в группе I отсутствовали лица с НЭД выше 4 сЗв, а среди работников со стажем более 10 лет минимальная суммарная эффективная доза составляла 0,59 сЗв.
Анализ дозовых нагрузок работников Балаковской АЭС показал (табл. 3), что практически у всех, находившихся под наблюдением лиц, индивидуальные НЭД были значительно ниже установленных в Российской Федерации дозовых пределов для персонала АЭС (до 2 сЗв/г и не более 10 сЗв за любые последовательные 5 лет) и в среднем составляли 0,9, 2,9 и 3,9 сЗв для групп I, II и III, соответственно.
Несмотря на бесспорное различие средних значений НЭД, в группах, сформированных в зависимости от стажа работы в контакте с ионизирующим излучением, отмечалась высокая вариабельность индивидуальных дозовых нагрузок и показателей липидного обмена, не связанная с возрастным фактором. Статистически достоверное различие было выявлено только по уровню общего ХС между группами I и III (р < 0,05). В то же время, судя по средним абсолютным значениям КА и уровню ТГ, у лиц со стажем работы на АЭС свыше 5 лет прослеживалась некоторая тенденция к снижению вероятности риска развития атеросклероза.
Для уточнения влияния на липидный обмен мощности поглощенной дозы излучения был проведен сравнительный анализ уровня ХС, ТГ и КА в подгруппах, в которые вошли лица, имевшие равноценные дозовые нагрузки при разном стаже работы на АЭС. Полученные результаты не выявили достоверного различия между показателями липидного обмена в данных подгруппах. Самые низкие, практически совпадающие по своим средним значениям, величины КА отмечались во всех подгруппах С. Данная закономерность характеризовалась резким снижением вероятности риска развития атеросклероза у работников АЭС с НЭД в пределах 2,5 - 3,0 сЗв. Причем в подгруппе IC присутствовало наименьшее число лиц (9,9%) с нарушениями липидного обмена.
Таблица 3. Влияние стажа работы и НЭД облучения на показатели липидного обмена у работников АЭС
|
Группы |
Возраст (годы) М±d |
ХС (млмоль/л) М±d |
КА М±d |
КА > 3 (%) |
ТГ (млмоль/л) М±d |
Стаж (годы) М±d |
НЭД (сЗв) М±d |
|
Группа I п= 61 |
37,2±0,7 |
4,82 ± 0,15
|
2,55 ±0,19 |
26,9 |
1,44 ±0,11 |
3,2 ± 0,2 |
0,89±0,14 |
|
Группа IА п= 28 |
36,9±1,0 |
4,89 ± 0,23 |
2,70 ± 0,26 |
30,2 |
1,39 ± 0,11 |
3,1 ± 0,2 |
0,16±0,03 |
|
Группа IВ п= 18 |
36,6±1,3 |
4,85 ± 0,24 |
2,45 ± 0,35 |
25 |
1,57 ± 0,30 |
3,1 ± 0,3 |
0,98±0,07 |
|
Группа IС п= 15 |
38,5±1,5 |
4,59 ± 0,27 |
2,08 ± 0,33 |
9,9 |
1,40 ± 0,24 |
3,8 ± 0,3 |
2,62±0,26 |
|
Группа II п= 100 |
39,4±0,6 |
4,89 ± 0,11 |
2,35 ± 0,12 |
23,2 |
1,31 ± 0,08 |
8,8 ± 0,2 |
2,85±0,26
|
|
Группа IIА п=20 |
39,1±0,8 |
5,01 ± 0,23 |
2,46 ± 0,26 |
22,5 |
1,41 ± 0,21 |
8,4 ± 0,4 |
0,27±0,04 |
|
Группа IIВ п= 25 |
40,5±1,2 |
4,77 ± 0,21 |
2,37 ± 0,27 |
22,6 |
1,26 ± 0,15 |
8,7 ± 0,3 |
0,90±0,05 |
|
Группа IIС п= 34 |
38,2±0,9 |
4,73 ± 0,15 |
2,06 ± 0,19 |
17,5 |
1,25 ± 0,14 |
8,7 ± 0,2 |
2,95±0,15 |
|
Группа IIД п= 21 |
40,4±1,4 |
5,21 ± 0,26 |
2,53 ± 0,23 |
25 |
1,44 ± 0,15 |
9,3 ± 0,3 |
6,56±0,35 |
|
Группа III п= 65 |
42,7±0,6 |
5,13 ± 0,11 * |
2,35 ± 0,14 |
23,3 |
1,26 ± 0,08 |
12,3 ± 0,1 |
3,83±0,47
|
|
Группа IIIВ п= 22 |
43,7±1,2 |
5,19 ± 0,22 |
2,48 ± 0,31 |
22,2 |
1,24 ± 0,15 |
12,1 ± 0,3 |
0,89±0,07 |
|
Группа IIIС п= 23 |
40,9±0,9 |
5,37 ± 0,14 |
2,08 ± 0,20 |
15,7 |
1,16 ± 0,10 |
12,5 ± 0,2 |
2,82±0,19 |
|
Группа IIIД п= 20 |
43,4±1,3 |
4,97 ±,20 |
2,50 ± 0,26 |
29,8 |
1,49 ±,20 |
12,2 ± 0,2 |
7,86±0,49 |
Примечание. * - p < 0,05 - различие достоверно по сравнению с группой I.
Выявленные особенности взаимосвязи между средними значениями НЭД, длительностью контакта с ионизирующим излучением и КА (рис. 2) позволяют сделать вывод, что в случае внешнего хронического облучения в диапазоне «малых доз» (до 10 сЗв) у мужчин молодого и среднего возраста имеет место нелинейная зависимость между величиной дозовой нагрузки и частотой выявления атерогенных сдвигов в липидном обмене, не зависящая от мощности НЭД. При этом в отношении основного интегрального показателя состояния липидного обмена - коэффициента атерогенности, зависимость «доза - эффект» приближается к U-образной кривой, характерной для явлений гермезиса, сопровождающегося парадоксальной активацией защитных функций организма при действии токсических веществ и радиации в субингибирующих дозах [20]. Последнее согласуется с данными литературы о стимулирующем действии «малых доз» ионизирующего излучения на развитие растений [10], повышение радиорезистентности и компесаторно-приспособительных возможностей животных и человека [5].
Таким образом, проведенное исследование позволило не только оценить вероятность риска развития атеросклероза у практически здоровых мужчин, работающих на АЭС в контакте с ионизирующим излучением, но и впервые выявить дозо-зависимый антиатерогенный характер влияния «малых доз» радиационного воздействия на липопротеиновой спектр сыворотки крови, биохимические механизмы которого требуют дальнейшего уточнения.
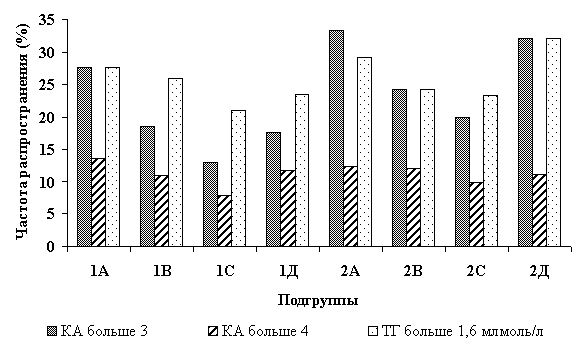
Рисунок 1.. Влияние НЭД облучения на риск развития атеросклероза у работников АЭС. (Ось Х - подгруппы обследованных лиц, ось Y - частота распространения риска развития атеросклероза (в процентах)).
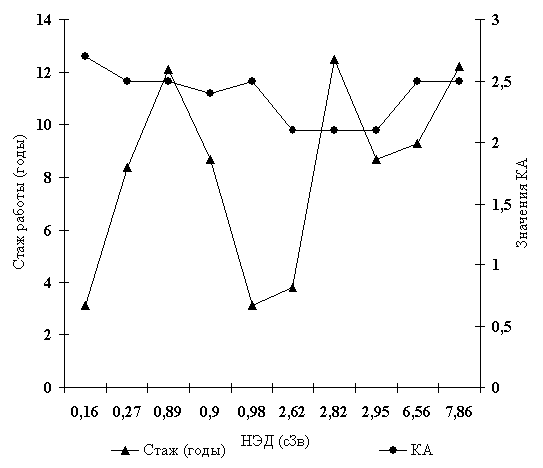
Рисунок 2. Влияние стажа работы и НЭД на значения КА у работников АЭС. (Ось Х - НЭД (сЗв), ось Y1 - стаж работы (годы), осьY2 - значения КА.)
СПИСОК ЛИТЕРАТУРЫ.
- Бабкин А. П., Чопоров О. Н., Куралесин Н. А. Особенности заболевания сердечно-сосудистой системы у ликвидаторов последствий аварий на Чернобыльской АЭС и проживающих на загрязненных радионуклеотидами территориях // Мед. труда и промыш. эколог. - 2002. - № 7. - С. 22-25.
- Белова Л.А., Оглобина О.Г., Белов А.А. Процессы модификации липопротеинов, физиологическая и патогенетическая роль модифицированных липопротеинов //Вопр. мед. химии. - 2000. - № 1. - С. 8-21.
- Беляев С.Т., Демин В.Ф., Книжников В.А. // Концепция минимизации ущерба здоровью и благополучию населения в результате аварии на Чернобыльской АЭС. 54 вопроса и ответа. - Мед. радиол. - 1992. - № 1. - С. 20-35.
- Гуськова А.К., Селидовкин Г.Д. Состояние здоровья персонала предприятий атомной промышленности и энергетики: основные итоги и задачи на будущее // Актуальные вопросы клинической медицины: Тез. докл. VI науч-практ. конф. терапевтов учрежд. фед. упр. «Медбиоэкстрем». - Саратов, 2000. - С. 40-47.
- Домшлак М.Г. Современные проблемы количественной оценки генетического и канцерогенного рисков химических мутагенов и ионизирующих излучений // Бюл. Науч. Совета Медико-экологич. пробл. работающих. - 2003. - № 1. - С. 67-77.
- Зубовский Г.А. Заболеваемость населения Брянской области РСФСР, проживающего на территории загрязненной радиоактивными веществами вследствие аварии на Чернобыльской АЭС //Мед. радиолог. - 1992. - № 1. - С.35-37.
- Камышников В.С. Справочник по клинико-биохимической лабораторной диагностике. - Мн.: Белорусь, 2000. - Т. 2. - С. 106-188.
- Климов А.Н., Никульчева Н.Г. Обмен липидов и липопротеидов и его нарушения. - СПб.: Питер Ком., 1999. - 512 с.
- Книжников В. А. Радиационная безопасность на территориях, загрязненных в результате Чернобыльской аварии: порочный круг проблем // Мед. радиолог. - 1992. - № 1. - С. 4-8.
- Кузин А.М., Копылов В.А. Радиотоксины. - М.: Наука, 1983. - 174 с.
- Кутузова А.Б., Лелюк В.Г. Влияние ионизирующего излучения в «малых дозах» на структурные и гемодинамические показатели функции сердца // Актуальные вопросы клинической медицины: Тез. докл. VI науч-практ. конф. терапевтов учрежд. фед. упр. «Медбиоэкстрем». - Саратов, 2000. - С. 89-92.
- Медицинская лабораторная диагностика (программы и алгоритмы)/ Под ред. А.И. Карпицкого. - СПб.: Интермедика, 1997. - С. 8-20.
- Панасенко О.М., Сергеенко В.И. Гипохлорид, окислительная модификация липопротеинов крови и атеросклероз// Бюл. эксп. биол. и мед. - 2001. - № 5. - С. 484-494.
- Поляков Л.М., Панин Л.Е. Липопротеиновая регуляция метаболических процессов // Усп. совр. биол.- 2000. Т.- 120, № 3. - С. 265-272.
- Рожкова Т.А. Проблемы диагностики гиперлипопротеидемии // Росс. мед. ж. - 2000. - № 3. - С. 14-16.
- Романенко А.Е. Состояние здоровья населения Украины, подвергшегося радиационному воздействию в результате аварии на Чернобыльской АЭС //Мед. радиолог. - 1992. - № 1. - С. 37-40.
- Туков А. Р., Шафранский И. П. Оценка относительного риска заболевания и смерти у лиц, принимавших участие в ликвидации последствий аварии на Чернобыльской АЭС. (на основе индекса DALY). - Мед. труда и промыш. экология. - 2001. - № 2. - С. 24-28.
- Цыб А.Ф., Иванов В.К., Айрапетов С.А. и др. Государственный регистр лиц, подвергшихся облучению в результате аварии на чернобыльской АЭС: дозометрические, прогностические и эпидемиологические возможности // Мед. радиол. - 1992. - № 1. - С. 46-51.
- Mahley R.W., Innerarity T.L. Lipoprotein receptors and cholesterol homeostasis // Biochim. Biophys. Acta. - 1983. - V. 737. - P. 197-222.
- Rozman K. K. Delayed acute toxicity of 1,2,3,4,6,7,8-heptachiorodibenzo-p-dioxin (HpCDD), after oral administration, Obeys Haber Rule of Inhalation Toxicology // Toxicol. Science. - 1999. - V. 468. - P. 102-109.



