Расстройство мозгового кровообращения является одной из наиболее частых причин нарушения структуры и функции головного мозга.
Как известно, нарушения церебрального кровотока могут быть следствием системных или локальных сдвигов гемодинамики, таких как гипертензия и гипотензия, тромбоз, эмболия, кровоизлияние, отек и спазм сосудов. Причем, ангиоспазм в сосудах головного мозга имеет типичную локализацию, развивается главным образом в магистральных артериях, в то время как более мелкие ветвления пиальных артерий реагируют на ишемию мозга компенсаторной вазодилатацией [2,3]. Механизмы компенсаторной вазодилатации, также как и характер метаболических сдвигов в динамике реперфузии предварительно ишемизированного мозга, остаются в значительной мере не изученными.
Несмотря на различие этиологических факторов и пусковых механизмов развития ишемии головного мозга, одним из эфферентных звеньев нарушения структуры и функции нейронов, является образование активных форм кислорода с последующей индукцией свободнорадикальных реакций дестабилизации биологических мембран клеток [2,6].
Образование активных форм кислорода идет непрерывно и в условиях нормы, а процессы свободнорадикального окисления являются необходимым этапом различных метаболических процессов (Зайцев В.Г., Закревский В.И., 1998). Причем, образование активных форм кислорода может происходить в процессе переноса электронов в митохондриальной дыхательной цепи, в реакциях, катализирующих оксидацию, в реакциях микросомального окисления с участием цитохром Р-450, в реакциях неферментативного окисления веществ (гемоглобина, адреналина и др.), в биологических системах с наличием ионов металлов с переменной валентностью и т.д. (Казимирко В.К., Мальцев В.И., 2004).
Тем не менее, чрезмерное образование активных форм кислорода приводит к активации перекисного окисления липидов (ПОЛ) и соответственно к развитию дезинтеграции биологических мембран - цитоплазматических, лизосомальных, митохондриальных, дефициту АТФ, подавлению энергозависимых реакций в клетках, окислению SH-групп ферментов, инактивации глутатиона и дезорганизации нуклеиновых кислот и белков [3,6].
В связи с этим очевидна значимость экспериментальных исследований, направленных на изучение состояния процессов липопероксидации и активности антиоксидантных систем ишемизированного головного мозга, а также на изыскание новых эффективных способов медикаментозной коррекции указанных метаболических расстройств.
Цель
Изучение содержания промежуточных продуктов липопероксидации - малонового диальдегида (МДА) и диеновых конъюгатов (ДК), а также активности супероксиддисмутаза (СОД) и уровня восстановленного глутатиона в гомогенатах ишемизированного мозга и в процессе его реперфузии.
Материалы и методы исследования
Эксперименты поставлены на 50 беспородных белых крысах - самцах массой 250 - 300г. Ишемическое повреждение мозга моделировали частичным пережатием общих сонных артерий. Под эфирным наркозом проводили разрез кожи на передней поверхности шеи, освобождали от окружающих тканей общие сонные артерии и накладывали на них металлические зажимы, частично ограничивая мозговой кровоток в течение 90 мин. Затем зажимы снимали, обеспечивая реперфузию мозга.
Изучение метаболических сдвигов проведено в тканях коры головного мозга спустя 90 мин. с момента развития ишемии мозга, а также в условиях реперфузии головного мозга спустя 24 и 72 часа после снятия зажимов.
О состоянии процессов липопероксидации судили по содержанию в гомогенатах коры головного мозга МДА [5] и ДК [7].
О состоянии свободнорадикального окисления и активности антиоксидантной системы судили по уровню восстановленного глутатиона [1,4] - активного перехватчика гидроксильных радикалов, и по активности СОД [1], ускоряющей в десятки раз спонтанную дисмутацию супероксидного анион-радикала.
Результаты исследований были подвергнуты статистическому анализу с помощью программ Statistica 99 (Версия 5.5 А, «Statsoft, Inc», г. Москва, 1999); «Microsoft Excel, 97 SR-1» (Microsoft, 1997). Проведен расчет коэффициентов линейной корреляции (Реброва О.Ю., 2003).
Результаты и их обсуждение
Как показали результаты исследований, уже спустя 90 мин с момента развития ишемии возникала активация процессов липопероксидации в структурах коры головного мозга, о чем свидетельствовало избыточное накопление ДК (р<0.001, рис. 1) и МДА (р<0.001, рис. 1).
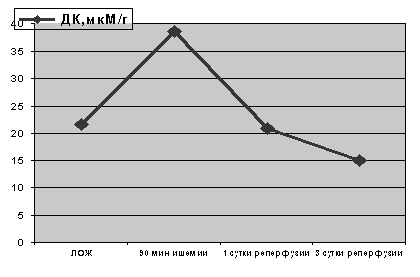
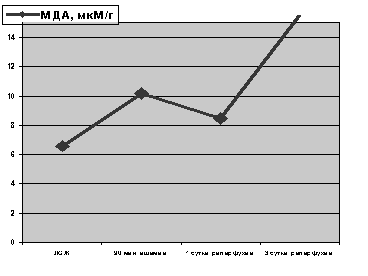
Рисунок 1. Содержание ДК и МДА в гомогенатах ишемизированного мозга и на фоне его реперфузии
Примечание: ЛОЖ - ложнооперированные животные. Степень достоверности полученных данных указаны в тексте.
Касаясь механизмов развития этого явления, следует отметить, что в условиях гипоксии АФК вступают во взаимодействие с полиненасыщенными жирными кислотами (ПНЖК) - важнейшими компонентами фосфолипидов биологических мембран. Причем, легче всего подвергается свободнорадикальному окислению арахидоновая кислота, имеющая наибольшее количество двойных связей. Отрыв ионов водорода от ПНЖК легче всего происходит в α - положении по отношению к двойной связи, что приводит к перемещению этой двойной связи с образованием ДК (Фархутдинов Р.Ф., Бикбулишов Н.Г., 1983; Иванов И.И., 1984; Петрович Ю.А., Гуткин Д.В. 1986).
В процессе дальнейшей окислительной дегенерации гидроперекисей липидов в клетке образуются высокотоксичные продукты ПОЛ - альдегиды, кетоны, спирты, накопление которых приводит к гибели клеток [6].
В последующих наблюдениях исследовано содержание промежуточных продуктов липопероксидации в процессе реперфузии головного мозга.
Как оказалось, спустя 24 часа с момента развития реперфузии содержание ДК в гомогенатах мозга нормализовалось (р>0.1, рис. 1), в то время как уровень МДА заметно превышал показатели контроля (р<0.001, рис. 1).
Спустя 3 суток с момента реперфузии мозга уровень ДК в гомогенатах мозга продолжал снижаться не только по отношению к показателям предыдущего периода наблюдения (р<0.01, рис. 1), но и по отношению к показателям контроля. В тоже время, уровень МДА продолжил значительно возрастать (р<0.001, рис. 1) как по отношению к показателям предыдущей группы наблюдения (1 сутки реперфузии), так и к уровню МДА на фоне экспериментальной ишемии мозга через 90 мин.
Таким образом, в процессе реперфузии предварительно ишемизированного мозга прогрессировали интенсификация ПОЛ и избыточное накопление высокотоксичного продукта МДА. Последнее убедительно свидетельствует о целесообразности использования в условиях реперфузии предварительно ишемизированных структур мозга антиоксидантов.
Касаясь механизмов активации процессов липопероксидации в ишемизированном мозге, а также в процессе его реперфузии, необходимо остановиться на динамике изменений показателей активности СОД и уровня восстановленного глутатиона при изучении патологии.
Как оказалось, спустя 90 мин с момента развития ишемии мозга активность СОД резко снижалась (р<0.001, рис. 2), спустя 1 сутки с момента реперфузии активность этого фермента оставалась низкой по сравнению с показателями контроля (р<0.001, рис. 2), как и в группе животных с 90 мин ишемией мозга. Лишь к 3 суткам реперфузии активность СОД нормализовалась (р>0.1, рис. 2).
Таким образом, прогрессирующая активация ПОЛ и избыточное накопление МДА в гомогенатах мозга к 3 суткам наблюдения не связаны с недостаточностью дисмутации супероксидного анион-радикала. Как известно, универсальной ловушкой свободных радикалов является восстановленный глутатион, так называемый «тиоловый щит», оберегающий SH - группы структурных и ферментных белков клеток от повреждающего действия окислителей, в том числе и свободных радикалов.
Как оказалось, спустя 90 мин с момента развития ишемии уровень восстановленного глутатиона в гомогенатах мозга резко снижался по сравнению с показателями контроля (р<0.001, рис. 2), оставаясь на таком же низком уровне и спустя 1 сутки с момента реперфузии (р<0.001, рис. 2). Спустя 3 суток после начала реперфузии уровень восстановленного глутатиона еще более снижался (р<0.001, рис. 2) по сравнению с показателями контроля и предыдущих серий наблюдений. Причем, была обнаружена отрицательная корреляция между возрастанием уровня МДА и снижением содержанием восстановленного глутатиона в гомогенатах мозга. Полученные данные свидетельствуют о целесообразности включения в комплексную терапию при ишемическом повреждении головного мозга и его реперфузии донаторов SH - групп.
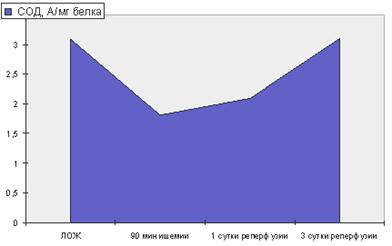
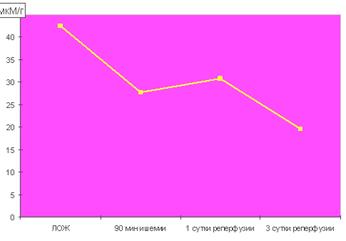
Рисунок 2. Содержание СОД и восстановленного глутатиона
в гомогенатах ишемизированного мозга и на фоне его реперфузии
Примечание: ЛОЖ - ложнооперированные животные. Степень достоверности полученных данных указаны в тексте.
Выводы:
- Характерными метаболическими сдвигами в ишемизированных структурах коры головного мозга является избыточное накопление МДА, ДК при одновременном снижении активности СОД и восстановленного глутатиона.
- В процессе реперфузии предварительно ишемизированного мозга возникает прогрессирующая к 3 суткам наблюдения активация процессов липопероксидации, о чем свидетельствует избыточное накопление МДА, а также истощение системы антирадикальной защиты клеток, на что указывает низкий уровень восстановленного глутатиона.
- В комплексной терапии патологических состояний, характеризующихся нарушением кровообращения головного мозга, последовательной сменой реакций ишемии и реперфузии, целесообразно использование эффективных мембранопротекторов, антиоксидантов, антиагрегантов, донаторов SH - групп.
СПИСОК ЛИТЕРАТУРЫ.
- Дубинина Е.Е., Сальникова Л.А., Ефимова Л.Д. Лабораторное дело, №10, 1983. - с. 30-33.
- Зайчик А.Ш., Гурилов Л.П. Основы общей патологии. Часть 2. / А.Ш. Зайчик, Л.П. Гурилов. - Основы патохимии. - СПб.: ЭЛБИ, 2000. - 687с. - с.363-364.
- Патологическая физиология и биохимия: Учебное пособие для ВУЗов / - М.: Издательство «Экзамен». 2005. - 480с. - с.140-151.
- Путилина Ф.Е. Методы биохимических исследований - ЛГУ, Ленинград, 1982. - с.183-187.
- Стальная И.Д., Гаришвили Т.Г. Современные методы в биохимии. - М.: Москва, 1977. - с.66-68.
- Типовые патологические процессы / Н.П. Чеснокова: Монография / - Издательство Саратовского медицинского университета. 2004. - 400 с. - с. 132-136.
- Ennor A. and H.Rosenberg. Biochem J. 51, 1952. - 606- 610.



