Функциональная интеграция трансплантатов с мозгом реципиента осуществляется за счет реципрокных аксональных связей между ними. Существуют противоречивые мнения о степени специфичности таких взаимодействий. Ранее на примере гетеротопической трансплантации зубчатой фасции гиппокампа в соматосенсорную область неокортекса мы показали, что при отсутствии адекватных мишеней трансплантированные нейроны могут формировать синаптические взаимодействия с отделами мозга, с которыми в норме ни анатомически, ни функционально не связаны. Врастающие в неокортекс реципиента аксоны гранулярных нейронов (мшистые волокна) зубчатой фасции не только занимают освободившиеся в результате операции трансплантации нейрональные и дендритные поверхности, но и индуцируют образование дополнительных локусов для контактирования [2, 14]. Важным структурным и функциональным признаком синапсов мшистых волокон является то, что помимо малых синаптических везикул с аминокислотными медиаторами они содержат большие электронно-плотные гранулы с нейропептидами [8, 10]. Целью настоящей работы было изучение ультраструктурных особенностей окончаний мшистых волокон и распределения в них пептид-содержащих гранул при формировании контактов с несвойственными им нейрональными элементами в мозге реципиента.
Методы
Эксперименты проведены на крысах породы Вистар. В качестве донорского материала использовали эмбриональную закладку зубчатой фасции гиппокампа 20-дневных плодов. Для трансплантации взрослым крысам самцам (n = 5) той же породы по стереотаксическим координатам производили трепанацию черепа над соматосенсорной зоной неокортекса и отсасывали небольшой объем ткани мозга. В полученную ямку с помощью стеклянного капилляра помещали эмбриональную ткань, прижимали ее кровоостанавливающей губкой и закрывали костью черепа. Все процедуры проводили под нембуталовым наркозом (40 мг/кг, внутрибрюшинно) и местной новокаиновой анестезией. Через 5 мес после операции животных перфузировали фиксирующим раствором (2,5%-ный раствор глутарового альдегида на 0,1 М фосфатном буфере), выделяли область мозга с трансплантатом и дорсальный гиппокамп для контроля. Далее материал дофиксировали 1%-ной осмиевой кислотой и обрабатывали для электронной микроскопии по стандартной методике [1, 2]. Для точной ориентации при электронно-микроскопических исследованиях проводили предварительный гистологический анализ полутонких срезов, содержащих как ткань трансплантата, так и ткань прилежащего неокортекса реципиента. Для количественного анализа использовали микроизображения гигантских синапсов мшистых волокон, имеющих диаметр профиля не менее 3-4 мкм. Производили подсчет всех синаптических пузырьков и везикул с электронно-плотной сердцевиной, а также активных зон, содержащих пептидергические гранулы. При этом пептид-положительными активными зонами считали те из них, в которых присутствовало не менее двух пептидных гранул. Было обработано по 100 случайно выбранных профилей гигантских синапсов из экспериментального материала и контрольного гиппокампа. Полученные результаты выражали в процентах. Достоверность различий определяли по критерию Стьюдента.
Результаты
Во всех оперированных животных были обнаружены трансплантаты, которые, как правило, занимали весь объем трансплантационной ямки. Трансплантаты содержали типичные для зубчатой фасции гранулярные клетки с хорошо дифференцированными дендритными и аксональными отростками, активно участвующими в синаптических взаимодействиях. Большинство гранулярных клеток было сгруппировано в плотно упакованные кластеры, которые иногда напоминали фрагменты клеточного слоя. Между трансплантатом и мозгом происходило свободное проникновение нервных и глиальных отростков в обоих направлениях, среди которых идентифицировались тонкие (0,1 - 0,2 мкм в диаметре) немиелинизированные аксоны (мшистые волокна) гранулярных клеток зубчатой фасции.
Анализ соседнего с трансплантатом неокортекса был направлен на идентификацию синаптических окончаний мшистых волокон по известным ультраструктурным признакам [1, 7]. Принцип строения гигантских синапсов и субмикроскопическая организация функциональных контактов сохранялись в условиях трансплантации. Они, как и в мозге in situ, одновременно формировали синаптические активные зоны с дендритными шипиками и адгезивные десмосомоподобные соединения с поверхностью дендритов. Их пресинаптические компоненты, достигающие 4 - 5 мкм в диаметре, были заполнены массой малых (20 - 40 нм в диаметре) синаптических пузырьков, которые образовывали плотные скопления около активных зон. Помимо этого, в них присутствовало относительно небольшое количество пептидергических везикул (80 - 100 нм), имеющих электронно-плотную сердцевину разной величины (рис.1).
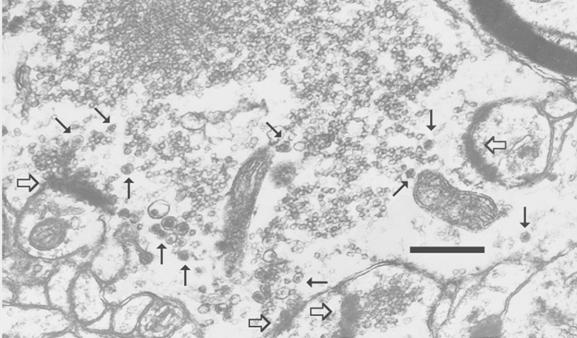
Рисунок 1. Гигантское синаптическое окончание (фрагмент) гранулярной клетки трансплантата зубчатой фасции, формирующее синаптические активные зоны с дендритными шипиками соматосенсорной области неокортекса.
Обозначения: толстые контурные стрелки - синаптические активные зоны; обычные стрелки - большие пузырьки с электронно-плотной сердцевиной. Масштаб - 0,5 мкм.
Сравнительный визуальный анализ экспериментального и контрольного материала показал, что содержание и распределение пептидергических гранул по синаптоплазме резко различается. В синапсах контрольного гиппокампа они обычно располагались вне активных зон и, как правило, были приближены к плазматической мембране пресинаптического бутона. При этом только изредка встречались активные зоны, в составе которых помимо малых светлых везикул, присутствовали единичные крупные гранулярные пузырьки. В трансплантационном материале число пептидергических гранул было значительно выше в целом, и, что особенно важно, многие из них располагались в области синаптических контактов. Около некоторых активных зон наблюдалось до 10-15 гранул, и часть из них была встроена в пресинаптическую решетку синапса, что свидетельствует об участии нейропептидов в функциональном акте. Электронно-плотная осмиофильная сердцевина в разных пептидергических везикулах сильно различалась по консистенции и размеру, но никогда не заполняла полностью весь объем. Следует отметить, что возле адгезивных соединений синаптической терминали с дендритом никогда не присутствовали ни малые, содержащие глутамат, везикулы, ни крупные пептидергические гранулы.
Количественный анализ везикулярного состава гигантских синапсов в норме и в условиях трансплантации подтвердил различия, выявленные при визуальных наблюдениях. Доля пептидсодержащих гранул от общего числа пузырьков в синапсах, образованных трансплантированными нейронами с несвойственных им мишенями в неокортексе, была в 1,7 раз выше, чем в гиппокампе in situ (5.8 ± 0,6 % и 3.3 ± 0,6 %, соответственно; p < 0,01). Еще более значимые различия были обнаружены при подсчете синаптических активных зон, в состав которых входили большие электронно-плотные пузырьки. Если в контроле гигантские синапсы формировали такие активные зоны лишь в 7,9 ± 1,6 % случаев, то в условиях эксперимента число таких функциональных сайтов возрастало до 62,3 ± 3,4 %, т.е. почти в 7,8 раз (p < 0,001).
Обсуждение
Эмбриональная нервная ткань, развиваясь в условиях трансплантации в зрелом организме, реализует высокий потенциал морфо - функциональных пластических преобразований. Трансплантированные нейроны не только приживаются и дифференцируются, но и формируют афферентные и эфферентные связи с клеточными элементами мозга реципиента. Ультраструктурный анализ позволяет выявить субклеточные механизмы, обеспечивающие адаптацию синаптического аппарата к новому микроокружению. Гигантские окончания мшистых волокон гранулярных клеток зубчатой фасции являются удобным микрообъектом для этих целей. Они обладают рядом уникальных анатомических и функциональных характеристик: гигантские размеры терминали, формирующие синаптические активные зоны с разветвленными дедритными шипами и десмосомоподобные адгезивные соединения с дендритами, а также сложный везикулярный состав, отражающий нейромедиаторное разнообразие [1, 7, 8]. Благодаря таким ярким особенностям эти синапсы легко идентифицируются в условиях трансплантации при их контакте с неспецифическими нейрональными мишенями неокортекса. Ранее мы показали, что мшистые волокна трансплантированных нейронов, заканчиваясь на атипичных мишенях в соматосенсорной области коры мозга, хотя и воспроизводят основной принцип формирования синапсов, подвергаются некоторой структурной модификации. Они имеют более мощные адгезивные соединения с поверхностью дендритов, с пресинаптической стороны которых наблюдается концентрация митохондрий, а со стороны дендрита располагаются цистерны эндоплазматического ретикулума [2, 14]. В данной работе обнаружено, что при контакте с неспецифическими мишенями изменяется и нейромедиаторный статус синаптических окончаний. Известно, что основным медиатором в гигантских синапсах является глутамат, содержащийся в малых светлых везикулах и оказывающий возбуждающее воздействие [8]. С этим же типом везикул связывают и недавно обнаруженный в них тормозный нейротрансмиттер - гамма аминомасляную кислоту [6]. Кроме того, большие гранулярные пузырьки этих синапсов являются вместилищем нескольких нейропептидов, главным образом, динорфина, энкефалина, холецистокинина [4, 5]. При иммуноцитохимическом исследовании обнаружено, что динорфин-положительные большие гранулярные пузырьки располагаются вдоль внутренней поверхности гигантской терминали и освобождают свое содержимое вне активных зон [10]. Проведенный нами качественный и количественный анализ везикулярного состава показал, что именно нейропептидный пул подвергается наибольшим изменениям при формировании неспецифических синаптических контактов в условиях трансплантации. При этом выявлено не только достоверное возрастание числа гранулярных везикул, но и их перераспределение из периферийных областей синаптоплазмы к местам функциональных контактов. Значительное увеличение количества активных зон, имеющих в своем составе большие гранулярные пузырьки, свидетельствует об их антероградном воздействии на постсинаптический нейрон через синаптические контакты. Существуют литературные данные об участии эндогенных нейропептидов в изменении функциональной активации нейронов. Так, описано увеличение количества нейропептидных гранул, усиление их подвижности и секреции в межклеточное пространство при долговременной посттетанической потенциации и развитии эпилептических разрядов [3, 10, 11, 12]. Считается, что эндогеᘽнᙋе нейропептиды, в отличие от классических трансмиттеров, оказывают экстрасинаптическое модуляторное влияние на синаптическую передачу и служат для восстановления баланса между возбуждением и торможением [9, 13]. Полученные нами данные показывают, что при организации функциональных связей в условиях трансплантации нейропептиды осуществляют эффективное воздействие на постсинаптический нейрон через синаптические активные зоны. По-видимому, они необходимы для адаптации рециптивных областей мозга к синаптическим контактам с несвойственными им в норме аксональными системами трансплантата.
Работа поддержана Российским фондом фундаментальных исследований (грант № 03-04-48782).
СПИСОК ЛИТЕРАТУРЫ
- Журавлева З.Н. //Онтогенез. 1998. Т.29. № 2. С.85.
- Журавлева З.Н. //Онтогенез. 2002. Т.33. № 3. С.230.
- Мокрушин А.А. //Известия АН. Серия биологическая. 2002. №1. С.74.
- Chavkin C. //Prog. Brain Res. 2000. V.125. P.363.
- Commons K.G., Milner T.A. //Brain Res. 1996. V.758. P.181.
- Gutiérrez R., Romo-Parra H., Maqueda J., Vivar C., Ramirez M. et al. //J. Neurosci. 2003. V.23. P.5594.
- Hamlyn L.H. //J. Anat. (Lond). 1962. V.96. P.112.
- Henze D.A.,Urban N.N., Barrionuevo G. //Neurosci. 2000. V.98. No.3. P.407.
- Mazarati A.M. //Neuropeptides. 2004. V.38. No.6. P.331.
- Pierce J.P., Kurucz O.S., Milner T.A. //Hippocampus. 1999. V.9. P.225.
- Shakiryanova D., Tully A., Hewes R., Deitcher D.L., Levitan E.S. //Nature Neurosci. 2005. V.8. No.2. P.173.
- Torrealba F., Carrasco M.A. //Brain Res. Rev. 2004. V.47. P.5.
- Wasterlain C.G., Mazarati A.M., Naylor D. et al. //Epilepsia. 2002, No.5. P.20.
- Zhuravleva Z.N., Vinogradova O.S. //J. Neural Transpl. Plasticity. 1994. V. 5. No.3. P.169.



