Ишемическое повреждение миокарда является одной из наиболее частых причин развития инфаркта миокарда, аритмий, острой или хронической сердечной недостаточности, приводя к развитию печального исхода болезни.
Естественно, что в многочисленных клинических и экспериментальных исследованиях предпринимаются попытки медикаментозной коррекции системных метаболических и функциональных расстройств, предшествующих и сопутствующих развитию коронарной недостаточности [9].
В клинической терапии ишемической болезни сердца давно утвердилось использование препаратов, улучшающих коронарный кровоток и соответственно доставку основных субстратов синтеза макроэргов в миокарде: жирных кислот, лактата, глюкозы, кислорода и др. В этих целях применяют коронародилататоры, антикоагулянты, антиагреганты. Одновременно подавляются энергетические потребности миокарда β - адреноблокаторами, обеспечивается нормализация липидного спектра крови, углеводного обмена [10]. Между тем, в ишемизированном миокарде возникают глубокие метаболические расстройства, приводящие к усугублению структурных изменений в предварительно ишемизированном миокарде на фоне его реперфузии при использовании вышеуказанных способов медикаментозной коррекции.
В последние годы широкое распространение в комплексной терапии ишемии миокарда получило использование цитофлавина [2,5,6,7,8]. Как известно, цитофлавин комплексный препарат, разработанный научно-технологической фармацевтической фирмой «Полисан» (Санкт-Петербург, 2000 г), включающий рибоксин, рибофлавин мононуклеотид, никотинамид, янтарную кислоту. Каждый из указанных препаратов довольно широко применяется в клинической практике при различных формах патологии. Естественно предположить, что использование указанных препаратов в комплексе может обеспечить новые метаболические эффекты в условиях ишемии.
Установлено, что рибоксин реализует свои метаболические эффекты на миокард, будучи агонистом пуринэргических рецепторов, при участии которых происходит активация гликолиза - важнейшего процесса для поддержания энергетического пула в миокарде в условиях гипоксии. Кроме того, рибоксин потенцирует эффекты аденозина, участвующего в образовании NO и развитии вазодилатации [1].
Другим компонентом цитофлавина является рибофлавина мононуклеотид, обеспечивающий высокую активность глютатионпероксидазы, а также ряда дыхательных ферментов митохондрий. Отметим, что флавиновые ферменты участвуют и в реализации активности сукцинатдегидрогеназы и потреблении сукцината через метаболические шунты [1].
Никотинамид - прекурсор коферментов дегидрогеназ (НАД+ и НАДФ+) (Gilman et al,.1985) [1], и тем самым обладающий эффектами антигипоксанта.
Последний компонент цитофлавина янтарная кислота - эндогенный субстрат клетки, метаболизируется в цикле трикарбоновых кислот (ЦТК), улучшает тканевое дыхание за счет усиления транспорта электронов в митохондриях, ускоряет оборот дикарбоновой части ЦТК (сукцинат - фумарат - малат) и тем самым усиливает энергообеспечение клетки [1].
В связи с этим целью настоящего исследования явилось патогенетическое обоснование целесообразности использования указанного препарата на основе изучения его метаболических эффектов в ишемизированном миокарде.
Материалы и методы. Эксперименты по изучению метаболических особенностей миокарда в норме и при патологии проведены на 60 беспородных белых крысах самцах массой 250-300 г.
В гомогенатах миокарда изучено содержание АТФ и креатинфосфата с помощью наборов Био-Ла-Тест чешской фирмы «Лахема». Одновременно проведена оценка активности ряда ферментов гомогенатов миокарда, участвующих в процессах энергообеспечения миокарда - сукцинатдегидрогеназы (СДГ), лактатдегидрогеназы (ЛДГ) [3,4], а также аспартатаминотрансферазы (АсАТ) (с помощью наборов Био-Ла-Тест чешской фирмы «Лахема»).
Сравнительные серии экспериментов проведены в группе интактных животных, ложнооперированных животных и:
● в группе животных с экспериментальной ишемией миокарда, достигаемой окклюзией коронарной артерии по методу H.Selye. в модификации Саидова А.Б. и соавторов [11,12] без медикаментозной коррекции;
● в группе животных с экспериментальной ишемией миокарда на фоне внутривенного введения цитофлавина сразу после окклюзии коронарной артерии в дозе 1.5 мл/кг и далее в течение трех суток наблюдения (1 раз в сутки внутривенно в указанной дозе).
Влияние гипоксии и соответственно цитофлавина на метаболизм миокарда исследовано в динамике: спустя 60 мин и 72 часа после окклюзии.
Результаты исследований были подвергнуты статистическому анализу с помощью программ Statistica 99 (Версия 5.5 А, «Statsoft, Inc», г. Москва, 1999); «Microsoft Excel, 97 SR-1» (Microsoft, 1997). Проведен расчет коэффициентов линейной корреляции (Реброва О.Ю., 2003).
Результаты и их обсуждение. Как оказалось в группе животных с экспериментальной ишемией миокарда возникали выраженные метаболические расстройства в миокарде в динамике патологии.
Так, спустя 60 мин с момента развития окклюзии коронарной артерии возникало снижение содержания в гомогенатах миокарда креатинфосфата примерно на 25 % и уровня АТФ - на 20 %. Полученные нами результаты соответствуют общепринятым представлениям нарушения энергообеспечения миокарда в условиях ишемии. Касаясь значимости выявленного феномена, следует отметить возможность одномоментного развития реакций адаптации и дезадаптации в условиях энергодефицита, требующих определенной медикаментозной коррекции. С одной стороны, в условиях ишемии усиливается дефосфорилирование АТФ при участии 5-нуклеотидазы с образованием аденозина, обеспечивающего при определенных условиях коронародилатирующий эффект. С другой стороны, дефицит АТФ и креатинфосфата в ишемизированном миокарде приводит к подавлению всех энергозависимых реакций: трансмембранного переноса ионов, сопряжения процессов возбуждения и сокращения актомиозинового комплекса в миокарде, всех этапов синтеза белка.
Высказывается точка зрения о том, что наименее чувствительной к развитию ишемии миокарда является система окисления янтарной кислоты (Г.Н. Копылов, 2005). В связи с эти представляется интерес сопоставить состояние активности ЛДГ и СДГ гомогенатов миокарда в динамике ишемии.
Результаты проведенных нами исследований свидетельствовали о том, что уже через 60 мин с момента развития ишемии возникало подавление активности СДГ гомогенатов миокарда (р<0.01, рис. 1а) в то время, как активность ЛДГ (р<0.001, рис. 3а) гомогенатов миокарда не отличалась от показателей контроля; одновременно отмечалось снижение активности АсАТ гомогенатов миокарда (р<0.001, рис. 2а).
Как известно, подавление активности трансаминаз может служить косвенным показателем нарушения окислительных процессов в цикле Кребса, поскольку необходимые для переаминирования альфа-кетокислоты (α-кетоглутаровая, щавелевоуксусная) обеспечиваются реакциями ЦТК. Прямым доказательством подавления цикла Кребса является угнетение активности СДГ - флавопротеина сукцината с образованием фумарата.
Сравнительная серия экспериментов по изучению влияния цитофлавина на энергетическое обеспечение миокарда в те же сроки наблюдения (60 мин с момента развития ишемии) позволила обнаружить положительные метаболические эффекты. Так, содержание креатинфосфата гомогенатов миокарда (р<0.01, рис. 4а) достоверно возрастало, а АТФ (р<0.01, рис. 5а) не изменялось по сравнению с соответствующими показателями группы контроля. Это свидетельствует об активации под влиянием цитофлавина креатинфосфокиназной реакции. Одновременно возрастала активность СДГ (р<0.01, рис. 1а) и АсАТ (р<0.001, рис. 2а) гомогенатов миокарда, что свидетельствует об активации окисления субстратов в цикле Кребса, усилении переаминирования аминокислот с α-кетокислотами - продуктами цикла Кребса.
Спустя 72 часа с момента развития ишемии миокарда возникало прогрессирующее снижение содержания АТФ (р<0.01, рис. 5б) и креатинфосфата (р<0.01, рис. 4б) в гомогенатах миокарда. При этом активность СДГ гомогенатов миокарда (р<0.01, рис. 1б) оставалась низкой, как и в предыдущий период наблюдения, а активность ЛДГ (р<0.01, рис. 3б) и АсАТ (р<0.001, рис. 2б) гомогенатов миокарда заметно снижалась по отношению к таковым показателям контрольной группы животных и более раннему периоду ишемии миокарда.
Сравнительные исследования с внутривенным введением цитофлавина, спустя 72 часа с момента развития ишемии миокарда, свидетельствовали о положительных метаболических эффектах указанного препарата. Наблюдалось резкое увеличение содержания АТФ (р<0.01, рис. 5б) и креатинфосфата (р<0.01, рис. 4б) гомогенатов миокарда по отношению к таковым показателям группы сравнения без медикаментозной коррекции в соответствующий период ишемии миокарда. При этом уровень указанных макроэргов достигали показателей нормы. Многократное применение цитофлавина в динамике ишемии миокарда приводило и к нормализации показателей активности СДГ (р<0.01, рис. 1б), ЛДГ (р<0.01, рис. 3б), АсАТ (р<0.01, рис. 2б) гомогенатов миокарда.
Таким образом, использование комплексного препарата цитофлавина обеспечивало ускорение нормализации энергетического обеспечения миокарда за счет активации гликолитической реакции и окисления субстратов в цикле трикарбоновых кислот, а также реакций перефосфорилирования с участием креатинфосфокиназы.
Выводы.
- В динамике экспериментальной ишемии миокарда возникает прогрессирующее снижение уровня АТФ и креатинфосфата в миокарде, сочетающееся с подавлением активности СДГ, ЛДГ, АсАТ.
- Подавление активности СДГ опережает по времени снижение активности ЛДГ. Последнее имеет место лишь на поздних стадиях ишемии миокарда.
- Достигнута положительная коррекция метаболических сдвигов в ишемизированном миокарде, более выраженная на поздних стадиях ишемии миокарда при использовании комплексного препарата цитофлавина, включающего янтарную кислоту, никотинамид, рибоксин и рибофлавин.
- Цитофлавин обеспечивает противоишемический эффект за счет активации сукцинатдегидрогеназного окисления, окислительно - восстановительных процессов, поскольку никотинамид является простетической группой ферментов - кодегидрогеназы I (НАД) и кодегидрогеназы II (НАДФ) - переносчиков водорода.
- Усиление энергообеспечения ишемизированного миокарда на фоне введения цитофлавина достигается и за счет рибоксина - предшественника АТФ, активатора ряда ферментов цикла Кребса, а также за счет рибофлавина мононуклеотида. Последний, как известно, входит в состав ферментов, регулирующих окислительно-восстановительные процессы.
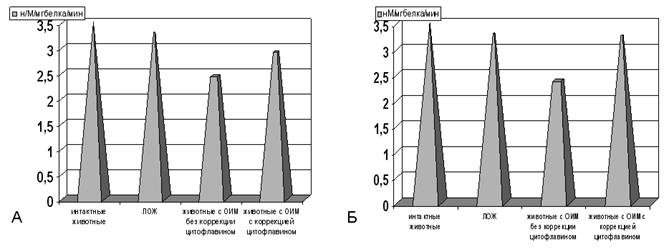
Рисунок 1. Содержание СДГ в гомогенатах миокарда на фоне острой ишемии миокарда с медикаментозной коррекцией цитофлавином.
Примечание: А - через 60 мин, Б - через 72 часа. ЛОЖ- ложнооперированные животные, ОИМ- острая ишемия миокарда. Степень достоверности полученных данных указана в тексте.
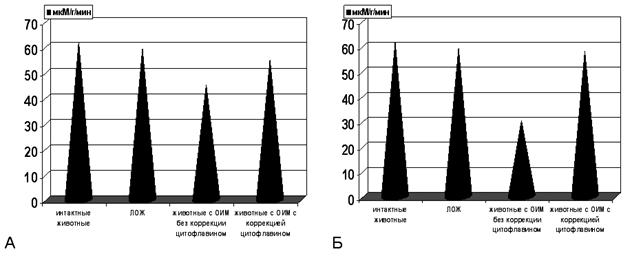
Рисунок 2. Содержание АсАТ в гомогенатах миокарда на фоне острой ишемии миокарда с медикаментозной коррекцией цитофлавином.
Примечание: А - через 60 мин, Б - через 72 часа. ЛОЖ- ложнооперированные животные, ОИМ- острая ишемия миокарда. Степень достоверности полученных данных указана в тексте.
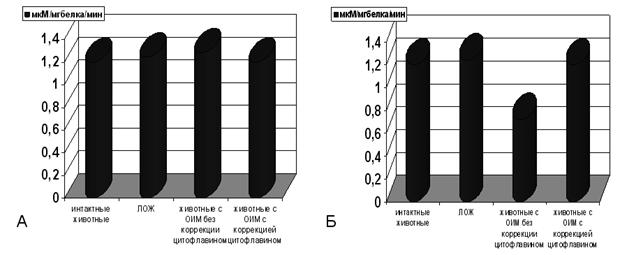
Рисунок 3. Содержание ЛДГ в гомогенатах миокарда на фоне острой ишемии миокарда с медикаментозной коррекцией цитофлавином.
Примечание: А - через 60 мин, Б - через 72 часа. ЛОЖ- ложнооперированные животные, ОИМ- острая ишемия миокарда. Степень достоверности полученных данных указана в тексте.
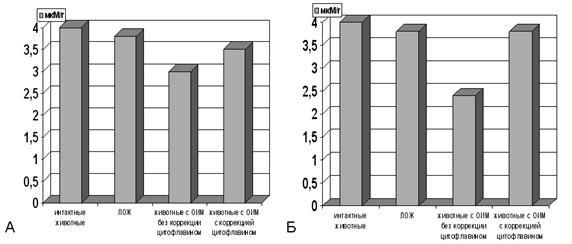
Рисунок 4. Содержание КФ в гомогенатах миокарда на фоне острой ишемии миокарда с медикаментозной коррекцией цитофлавином.
Примечание: А - через 60 мин, Б - через 72 часа. ЛОЖ- ложнооперированные животные, ОИМ- острая ишемия миокарда. Степень достоверности полученных данных указана в тексте.
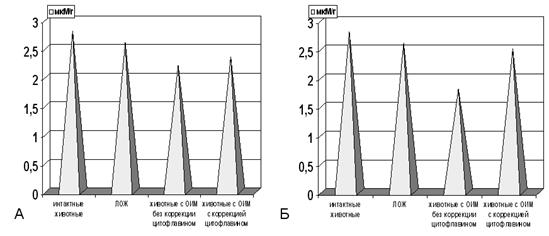
Рисунок 5. Содержание АТФ в гомогенатах миокарда на фоне острой ишемии миокарда с медикаментозной коррекцией цитофлавином.
Примечание: А - через 60 мин, Б - через 72 часа. ЛОЖ- ложнооперированные животные, ОИМ- острая ишемия миокарда. Степень достоверности полученных данных указана в тексте.
СПИСОК ЛИТЕРАТУРЫ
- Афанасьев В.В. Цитофлавин в интенсивной терапии: Пособие для врачей. - СПб. - 2005.- 36 с. - с. 9-30.
- Бульон В.В., Хныченко Л.К., Сапронов Н.С., Коваленко А.Л., Алексеева Л.Е. Использование цитофлавина для коррекции последствий ишемического повреждения миокарда //Экспериментальная и клиническая фармакология. - 2002. - Том 65, №1. с. 27-29.
- Ещенко Н.Д., Прохорова М.И. Методы биохимических исследований - ЛГУ, Ленинград, 1982. - с.224-226
- Ещенко Н.Д., Вольский Г.Г., Прохорова М.И. Методы биохимических исследований - ЛГУ, Ленинград, 1982. - с. 210-212.
- Коваленко А.Л., Белякова Н.В. Янтарная кислота - фармокологическая активность и лекарственные формы. //Фармацея. - 2000. - №5-6. - с. 40-44.
- Лычаков А.В., Шевчук М.К., Саватеева Т.Н., Колбасов С.Е., Коваленко А.Л. Эффективность цитофлавина при лечении экспериментальной алкогольной кардиомиопатии //Токсикологический вестник. - 2002.-№2. - с.21-25.
- Моисеева О.М., Селиванова Г.В., Власова Т.Д., Коваленко А.Л., Алексеева Л.Е., Семенова Е.Г. Изучение защитного влияния метаболических лекарственных препаратов на кардиомиоциты в их первичной культуре при острой и хронической ишемии //Цитология. - 1999. - №3-4. - с.294.
- Оболенский С.В., Николаев А.А., Аббясов И.Г., Сливин О.А., Николаев А.В., Еремина М.В. Интраоперационная защита миокарда в коронарной хирургии на работающем сердце //Вестник академии им И.И. Мечникова. - 2003. - № 4(4). с. 114-117.
- Окороков А.И. Диагностика болезней сердца и сосудов /А.И. Окороков //Диагностика болезней внутренних органов: Т. 6. - М.: Мед. лит., 2002. - 464 с.: ил. - с. 92-114.
- Окороков А.И. Лечение болезней внутренних органов: Т. 3, кн.1. Лечение болезней сердца и сосудов: - М.: Мед. лит., 2002 - 464.: ил. - с. 48 - 130.
- Саидов А.Б., Каримов Х.Я., Юлдашев Н.М., Саидов С.А. //Успехи современного естествознания. - 2006. - №3. с. 33-35.
- Selye H., Bayusz E., Crasso, and Mendell, Angiologia, 11, 1960. - 398-407.



