Осаждение металлов в виде гидроксидов используется в гидроэлектрометаллургии [1], в аналитической химии [2] и при очистке сточных вод [3,4].
Определение рН начала и конца осаждения гидроксидов осуществляется на основании [5]. Если под «рН полного осаждения» понимается такое значение рН при котором, в растворе над осадком концентрация ионов металла не превышает концентрацию 10-5 моль/л, то понятие «рН начала осаждения» четкого определения не имеет [5].
В [6] предлагается под «рН начала осаждения гидроксидов металлов» понимать такое значение рН, при котором в растворе над осадком гидроксида концентрация ионов металла равна 1 моль/л. Однако, остается неизвестной начальная концентрация ионов металла в растворе, которая должна быть больше 1 моль/л и, следовательно, не известно, какая часть исходного количества ионов металла перешла в осадок. В [6] не показана зависимость рН начала осаждения гидроксидов металлов от исходной концентрации соли в растворе, тогда как в [5] такая зависимость имеет место.
Таким образом, приведенные значения рН начала осаждения гидроксидов [5,6], из-за указанных соображений, затруднительно использовать в практической деятельности. Это обстоятельство и послужило целью выполнения данной работы.
Концентрацию ионов металла в разбавленном растворе ([Me+z]) над осадком гидроксида металла Me(OH)z можно определить, зная произведение растворимости гидроксида металла (ПР) по уравнению:
[Me+z] = ПР/[OH-]z. (1)
Согласно материальному балансу, сумма количества ионов металла в осадке и в растворе равна исходному количеству ионов металла в растворе:
См · V = m/M + [Me+z] ·V, (2)
где z - валентность металла, V- объем раствора, m и M - масса осадка и молярная масса гидроксида металла соответственно, См - исходная концентрация ионов металла в растворе.
Подставляя (2) в (1) и учитывая, что [OH-] = Kw/[H+], где Kw - ионное произведение воды, получим уравнение:
См · V = m/M + (ПР · V · [H+]z)/(Kw)z. (3)
Разделив левую и правую часть последнего уравнения на исходное количество ионов металла в растворе (См · V), получим уравнение, которое позволяет определять относительную долю гидроксида металла (α), которая равна ![]() и относительную долю ионов металла (100 - α) в растворе в зависимости от рН раствора:
и относительную долю ионов металла (100 - α) в растворе в зависимости от рН раствора:
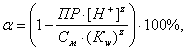 (4)
(4)
Данное уравнение применимо только в случае, когда m/M ≤ См· V. Как следует из уравнения (4), относительная доля ионов металла, перешедших в осадок в виде гидроксида, зависит от ионов металла, исходной концентрации соли в растворе и рН, что отмечено в [5].
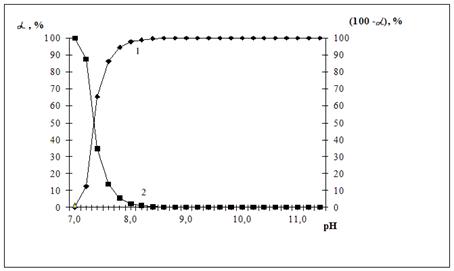
Рисунок 1. Относительные доли ионов кадмия в осадке (1) и в растворе (2) и в зависимости от величины рН при исходной концентрации ионов кадмия 1 моль/л.
На рис. 1 приведены зависимости относительной доли ионов кадмия, находящихся виде нерастворимого гидроксида (кривая 1) и в виде ионов в растворе (кривая 2) от рН раствора при исходной концентрации ионов кадмия в растворе 1 моль/л, вычисленные по уравнению (4) на ПЭВМ по специально разработанной программе. Произведение растворимости гидроксида кадмия и других гидроксидов заимствовано из [5].
Аналогичные кривые получаются и для других металлов, которые не образуют гидроксокомплексов.
На основании изложенного, за рН начала осаждения гидроксидов металлов, по-видимому, может быть приято то значение рН, при котором в осадок перешла определенная доля исходного количества ионов металла, например, 10 %. Рассчитанные по уравнению (4) данные значения рН и значения рН начала осаждения гидроксидов металлов, имеющиеся в [5,6], приведены в таблице 1.
Сравнение данных, приведенных в таблице, показывает, что рассчитанные по уравнению (4) значения рН начала осаждение гидроксидов и приведенные в [5] практически совпадают, но значительно отличаются от значений, приведенных в [6]. Последнее обусловлено отмеченным выше обстоятельством неопределенности исходной концентрации иона металла в растворе.
Таблица 1. Значения рН начала осаждения гидроксидов металлов
|
Гидроксид |
Исходная концентрация ионов металла 1 моль/л |
Исходная концентрация ионов металла 0,01 моль/л |
||
|
Гидроксида металла 10% |
Данные по [5] |
Гидроксида металла 10% |
Данные по [5] |
|
|
Значения рН |
||||
|
Cd(OH)2 |
7,2 |
7,2 |
8,2 |
8,2 |
|
Ni(OH)2 |
6,7 |
6,7 |
7,7 |
7,7 |
|
Fe(OH)2 |
6,5 |
6,5 |
7,5 |
7,5 |
|
Mn(OH)2 |
7,7 |
7,8 |
8,66 |
8,8 |
|
Pb(OH)2 |
6,47 |
6,4 [6] |
7,47 |
- |
|
In(OH)3 |
1,7 |
2,07 [6] |
2,37 |
- |
|
Cu(OH)2 |
4,5 |
3,8 [6] |
5,5 |
- |
Таким образом, приведенные в [5] значения рН начала осаждения гидроксидов, по-видимому, относятся к такому состоянию, при котором в осадок переходит 10% от исходного количества ионов металла в растворе.
Уравнение (4) можно использовать и для ориентировочного определения рН начала осаждения гидроксидов металлов, которые образуют гидроксокомплексы, если предположить, что при данном значении рН образование последних практически не происходит.
СПИСОК ЛИТЕРАТУРЫ
- Вольдман Г.М., Зеликман А.Н. Теория гирометаллургических процессов. - М.: Металлургия, 1993. - 400 с.
- Крешков А. П. Основы аналитической химии. Теоретические основы. Качественный анализ. Изд. М.: Химия, 1965 г. Т.1. - 472 с.
- Проскуряков В.А., Шмидт Л.И. Очистка сточных вод в химической промышленности. Л. «Химия», 1977. - 464 с.
- Виноградов С.С. Экологически безопасное гальваническое производство. - М.: Производственно-издательское предприятие "Глобус", 1998. - 302 с.
- Лурье Ю.Ю. Справочник по аналитической химии.- М.:- «Химия» 1965. - 390 с.
- Семин В.Д./Металлургия цветных металлов: Научные труды /Красноярский институт Цветмет. - Красноярск: Книж. Изд-во, 1971. №4. С.190 - 196.




 .
.