Гипоксия - типовой патологический процесс, осложняющий течение различных заболеваний инфекционной и неинфекционной природы. Несмотря на различие инициирующих механизмов развития гипоксии при тех или иных формах патологии, приводящих к расстройствам системной гемодинамики, регионарного кровотока, микроциркуляции, изменениям качественного и количественного состава крови, активности ферментов тканевого дыхания, результирующим метаболическим сдвигом при гипоксии является недостаточность окислительно-восстановительных процессов и энергообеспечения тканей (5,6).
Как известно, характерными особенностями гипоксического синдрома являются избыточное накопление промежуточных продуктов гликолиза, липолиза, протеолиза, развитие метаболического ацидоза с последующими вторичными неспецифическими метаболическими и функциональными сдвигами, усугубляющими течение основного заболевания (6). Под влиянием избытка ионов Н+ в условиях гипоксии возникает повышение проницаемости лизосомальных мембран и соответственно развитие деструктивных процессов в тканях под влиянием лизосомальных гидролаз. Последние инициируют образование эйкозаноидов и простаноидов, в процессе взаимного превращения которых возникают свободные радикалы (2).
Причиной избыточного образования свободных радикалов при гипоксии являются блокада конечного звена дыхательной цепи в митохондриях, утечка электронов по пути следования к цитохромоксидазе, что приводит к одноэлектронному восстановлению кислорода с образованием его активных форм. Как известно, в условиях гипоксии усиливается трансформация ксантиндегидрогеназы в ксантиноксидазу, инициирующей образование супероксидного анион-радикала (2,6). В то же время активация симпато-адреналовой системы, формирующаяся при гипоксии различного генеза также сопровождается усилением образования активных форм кислорода при аутоокислении адреналина (4,6).
В последние годы высказывается точка зрения, что высоко активные радикалы, такие как NO, супероксид и продукт их реакции - пероксинитрит играют важную роль в патогенезе различных заболеваний, являясь медиаторами воспаления, модифицируя белки и повреждая нуклеиновые кислоты (1,3). Мутагенный эффект избыточных концентраций пероксинитрита при хронических формах инфекционного воспалительного процесса может инициировать развитие канцерогенеза (Маеда Х., Акаике Т., 1998). И, наконец, в условиях ишемии, на фоне антигенной стимуляции макро- и микрофагами, неизменно включается лейкоцитарный механизм активации перекисного окисления липидов (ПОЛ) (Глоба А.Г., Демидова В.С., Темяков В.Г., 1991),(5,6).
Вышеизложенное указывает на то, что эфферентным звеном системных функциональных и метаболических расстройств при гипоксиях различного генеза является активация свободно-радикального окисления, в частности, липопероксидация. В связи с этим очевидна значимость экспериментальных исследований, направленных на изучение метаболических эффектов различных видов антиоксидантов, антигипоксантов, мембранопротекторов в условиях острой гипоксии.
Целью настоящего исследования являлась сравнительная оценка действия цитофлавина и оксибутирата натрия на состояние процессов липопероксидации и активности антиоксидантной системы в тканях коры головного мозга в условиях острой гипоксической гипоксии.
Материалы и методы. Эксперименты выполнялись на 60 белых беспородных мышах, самцах массой 16 - 18 г. Гипоксическую гипоксию моделировали согласно методике, предложенной научно-технологической фармацевтической фирмой «Полисан», Санкт-Петербург в 2000г. Об активности процессов липопероксидации судили по уровню малонового диальдегида (МДА) и гидроперекисей липидов (ГПЛ) в тканях коры головного мозга, определяемых общепринятыми спектрофотометрическими методами исследования (Супланов С.Н., Баркова Э.Н.,1985г, Гаврилов В.Б., Мишкорудная М.И., 1983г.). О состоянии ферментного звена антиоксидантной системы головного мозга судили по активности каталазы гомогената мозга (Conen S.,Denbuc D.,Marses S.,1970).
Проведена сравнительная оценка состояния процессов свободно-радикального окисления в четырех сериях экспериментов:
- на фоне развития гипоксической гипоксии без медикаментозной коррекции;
- в группе животных с экспериментальной гипоксией, развивающейся на фоне предварительного внутривенного введения физиологического раствора (контроль);
- в группе животных с экспериментальной гипоксией, развивающейся на фоне предварительного внутривенного введения антиоксиданта оксибутирата натрия (500мг/кг);
- в группе животных с гипоксической гипоксией на фоне предварительного внутривенного введения цитофлавина(1.2мл/кг). Метаболические эффекты цитофлавина и оксибутирата натрия проводили спустя 30 мин. с момента развития острой гипоксической гипоксии, также как и оценка состояния расстройств метаболизма в экспериментах на животных с острой гипоксической гипоксии без медикаментозной коррекции.
Результаты и их обсуждение. Результаты проведенных исследований позволяют установить, что в условиях экспериментальной острой гипоксической гипоксии продолжительность жизни животных составляет около 32 мин. (рис. 1).
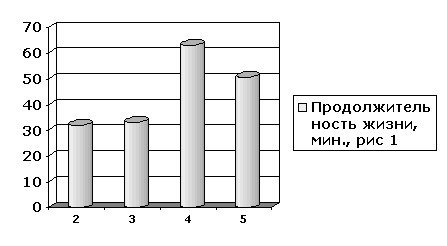
Рисунок 1. Продолжительность жизни животных (мин) в условиях гипоксической гипоксии: 2 - интактные животные, 3 - при введении физиологического раствора, 4 - при введении оксибутирата натрия, 5 - при введении цитофлавина.
Примечание: в рис. приведены статистически достоверные данные Р- в тексте.
Острая гипоксическая гипоксия сопровождалась нарастанием ГПЛ (рис. 2) и МДА (рис.3) в тканях коры головного мозга экспериментальных животных и снижением активности каталазы (рис.4).
В сравнительной серии экспериментов с предварительным введением плацебо (физиологический раствор) и последующим развитием гипоксической гипоксии выявлено достоверное снижение продолжительности жизни животных, как и в группе сравнения животных с гипоксической гипоксией без введения физиологического раствора (рис. 1). Одновременно имело место возрастание уровня ГПЛ (р<0.001) и МДА (р< 0.02) в тканях коры головного мозга по сравнению с таковыми показателями в группе животные с гипоксической гипоксией без введения физиологического раствора (рис. 2 и 3 соответственно). Активность каталазы (р<0.001) оставалась низкой, как и в группе животных с гипоксической гипоксией без введения физиологического раствора (рис.4).
Таким образом, введение физиологического раствора без фармакологических препаратов не привносило сколько-нибудь существенных изменений в интенсивность ПОЛ и состояние активности каталазы гомогената мозга.
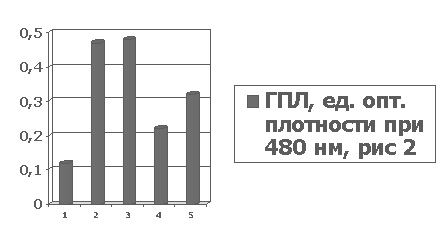
Рисунок 2. Значение величины гидроперекиси липидов (ГПЛ) 1 - у интактных животных, 2 - при гипоксической гипоксии, 3 - в условиях гипоксической гипоксии при введении физиологического раствора, 4 - в условиях гипоксической гипоксии при введении оксибутирата натрия, 5 - в условиях гипоксической гипоксии при ввдении цитофлавина.
Примечание: в рис. приведены статистически достоверные данные Р- в тексте.
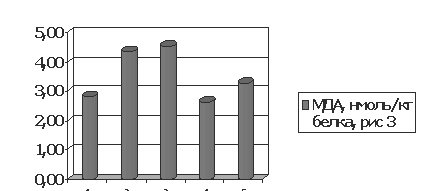
Рисунок 3. Содержание малонового диальдегида (МДА) 1 - у интактных животных, 2 - при гипоксической гипоксии, 3 - в условиях гипоксической гипоксии при введении физиологического раствора, 4 - в условиях гипоксической гипоксии при введении оксибутирата натрия, 5 - в условиях гипоксической гипоксии при введении цитофлавина.
Примечание: в рис. приведены статистически достоверные данные Р- в тексте.
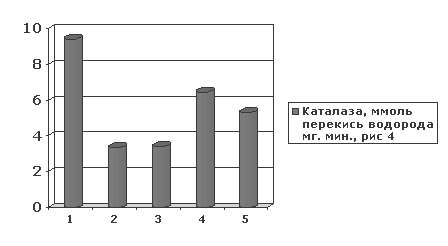
Рисунок 4. Значение активности каталазы 1 - у интактных животных, 2 - в условиях гипоксической гипоксии, 3 - в условиях гипоксической гипоксии при введении физиологического раствора, 4 - в условиях гипоксической гипоксии при введении оксибутирата натрия, 5 - в условиях гипоксической гипоксии при введении цитофлавина.
Примечание: в рис. приведены статистически достоверные данные Р- в тексте.
Целью последующих экспериментов являлось исследование возможности фармакологической коррекции метаболических сдвигов в тканях мозга в условиях гипоксической гипоксии на фоне предварительного введения антиоксидантов оксибутирата натрия и цитофлавина. Причем экспериментальные исследования проводились, как и в группе животных без медикаментозной коррекции, спустя 30 мин. с момента развития гипоксической гипоксии.
Оксибутират натрия - препарат, обладающий противосудорожной активностью, улучшающий микроциркуляцию, предотвращающий невротические расстройства и вегетативные реакции на стрессовые воздействия, повышает устойчивость организма к гипоксии.
Как показали проведенные исследования, в условиях предварительного введения оксибутирата натрия и последующего развития гипоксии отмечалось резкое увеличение продолжительности жизни животных (р<0.001, рис.1). При этом содержание ГПЛ (р<0.001, рис. 2) и МДА (р<0.02, рис. 3) в тканях мозга было значительно ниже, чем в группе животных с гипоксической гипоксией без медикаментозной коррекции. В то же время, введение оксибутирата натрия приводило к частичной реактивации ключевого фермента антиоксидантной системы: активность каталазы (р<0.001) возрастала по сравнению с соответствующим показателем группы животных с гипоксической гипоксии без медикаментозной коррекции, не достигая, однако, показателя группы интактных животных (рис. 4).
В последующих сериях экспериментов изучены метаболические эффекты другого антиоксиданта - цитофлавина.
Цитофлавин новый метаболический препарат, предложенный научно-технологической фармацевтической фирмой «Полисан», Санкт-Петербург,2000 г, обладает свойствами антиоксиданта. Активными компонентами цитофлавина являются: янтарная кислота, никотинамид, рибоксин, рибофлавин мононуклеотид. Вспомогательные вещества: N-метилглюкамин, натрия гидроокись. Основа: вода для инъекций. Янтарная кислота представляет собой универсальный внутриклеточный метаболит, участвующий в обменных реакциях организма и обладающий рядом биологических эффектов таких как:
- антигипоксическим действием за счет влияния на транспорт медиаторных аминокислот и увеличения содержания в мозге ГАМК,
- противоишемическим эффектом, обусловленным не только активацией сукцинатдегидрогеназного окисления, но и восстановлением цитохромоксидазы,
- интенсификация диффузии кислорода в различные ткани и органы, стимуляцией клеточного дыхания, усилением утилизации кислорода, тканями на фоне восстановления НАД - зависимого клеточного дыхания
- ингибированием процессов перекисного окисления липидов.
Никотинамид улучшает углеводный обмен и оказывает сосудорасширяющее действие, являясь простетической группой ферментов - кодегидрогеназы I (НАД) и кодегидрогеназы II (НАДФ).
Рибоксин - производное пурина, рассматривается как предшественник АТФ. Стимулирует обменные процессы в миокарде, улучшая коронарное кровообращение, повышает энергетический баланс миокарда.
Рибофлавина мононуклеотид - входит в состав ферментов, регулирующих окислительно-восстановительные процессы, участвуя в процессах белкового и жирового обмена.
Как оказалось, метаболические эффекты цитофлавина в условиях гипоксической гипоксии были менее выраженными по сравнению с эффектами оксибутирата натрия. Так, продолжительность жизни животных также увеличивалась (р<0.001), однако, в меньшей степени, чем при введении оксибутирата натрия (рис.1). На фоне предварительного введения цитофлавина уровень ГПЛ (р<0.001) значительно снижался по сравнению с таковым показателем в группы контроля (животные с гипоксической гипоксией на фоне предварительного внутривенного введения физиологического раствора) и не достигал показателя группы интактных животных (рис. 2 и 3 соответственно). Содержание МДА в гомогенате головного мозга на фоне предварительного внутривенного введения цитофлавина оставалось в пределах нормы. В то же время имела место частичная реактивация каталазы (р<0.02), не достигающая показателей нормы (рис. 4) .
Полученные результаты позволяют сделать следующие выводы:
- в ранние сроки наблюдения (спустя 30 мин. с момента развития острой гипоксической гипоксии) метаболические расстройства, свойственные острой гипоксической гипоксии в виде активации процессов липопероксидации и недостаточности антиоксидантной системы, носят обратимый характер и могут быть в значительной мере депотенцированы при использовании антиоксидантов: оксибутирата натрия и цитофлавина.
- Метаболические эффекты оксибутирата натрия в условиях острой гипоксической гипоксии более выражены по сравнению с влияниями цитофлавина.
СПИСОК ЛИТЕРАТУРЫ
- Дубинина В.В, Шугалей И.В. Окислительная модификация белков /В.В. Дубинина, И.В. Шугалей // Успехи современной биологии. - 1993. - Т.113, вып. 1 - с.71-81.
- Зайчик А.Ш., Гурилов Л.П. Основы общей патологии. Часть 2. / А.Ш. Зайчик, Л.П. Гурилов. - Основы патохимии. - СПб.: ЭЛБИ, 2000. - 687с. - с.363-364.
- Игнарро Л. Дж. Физиология и патофизиология оксида азота /Л. Дж. Игнарро //Актуальные проблемы анестезиологии и реаниматологии: Сб. науч. тр. - Архангельск: Тромсе, 1997. - с.266-269.
- Логинов А.С., Б.Н. Матюшин. Цитотоксическое действие активных форм кислорода и механизм развития хронического процесса в печени при ее патологии / А.С. Логинов, Б.Н. Матюшин // Патологическая физиология и экспериментальная терапия. - 1996. - №4 - с. 3-6.
- Патологическая физиология и биохимия: Учебное пособие для ВУЗов / - М.: Издательство «Экзамен». 2005. - 480с. - с.140-151.
- Типовые патологические процессы / Н.П. Чеснокова: Учебное пособие / - Издательство Саратовского медицинского университета. 2004. -с. 132-136.



