Лимфатическое русло является частью единой сердечно-сосудистой системы (рис. 1). На его протяжении меняется строение его стенок адекватно возрастающей функциональной нагрузке: эндотелиальные стенки у лимфатических капилляров (ЛК), в лимфатических посткапиллярах (ЛПК) появляются клапаны, в лимфатических сосудах (ЛС) - миоциты, в лимфатических узлах (ЛУ) - лимфоидная ткань (рис. 2). ЛК с кровеносными микрососудами рассматривают в составе «функциональных модулей» микроциркуляторного русла, организующих дифференциальное всасывание веществ [1]. ЛУ изучают главным образом как вторичные лимфоидные органы [2,3]. Наибольшее внимание уделяется экстраорганным ЛС как наиболее доступным звеньям транспорта лимфы. В 80-90-е годы минувшего столетия широкое распространение в нашей стране получили представления E..Horstmann [4] и H..Mislin [5] о том, что главной движущей силой лимфотока служат сокращения лимфангионов - клапанных сегментов ЛС, в их состав входят дистальный клапан и проксимальная мышечная манжетка, створки клапанов не содержат миоциты и движутся пассивно, по градиенту лимфотока. Но лимфангионы с одним клапаном не сокращаются. И я предложил рассматривать лимфангион как межклапанный сегмент: мышечная сеть из мышечной манжетки распространяется на клапаны (связана посредством мышечных пучков и с входным, и с выходным клапанами), в результате чего возникает единая структурно-функциональная система лимфангиона [6].
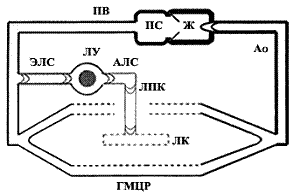
Рис. 1. Схема строения сердечно-сосудистой системы человека: ПС, Ж - предсердия и желудочки сердца; Ао - аорта и ее ветви; ГМЦР - гемомикроциркуляторное русло; ПВ - полые вены и их притоки; ЛК, ЛПК - лимфатические капилляры и посткапилляры; АЛС, ЭЛС, ЛУ - афферентные и эфферентные лимфатические сосуды лимфоузлов.
Использовав комплекс методов макромикро-, микро- и ультрамикроскопии, гисто- и иммуногистохимии, я доказал, что клапаны ЛС содержат гладкие миоциты, которые увеличивают резистентность клапанных створок к давлению лимфотока и допускают их активное участие в его регуляции. Мышца лимфатического клапана находится не только в основании, валике клапана, но продолжается и в его створки, соединяется посредством мышечных пучков с сосудистой стенкой, мышечными манжетками соседних лимфангионов и даже другими клапанами. Такие мышечные связи допускают координацию сокращений разных частей одного лимфангиона и разных лимфангионов. Мышца лимфатического клапана служит не только его напрягателем, но способна также изменять положение его створок, активно регулировать таким образом лимфоток между лимфангионами.
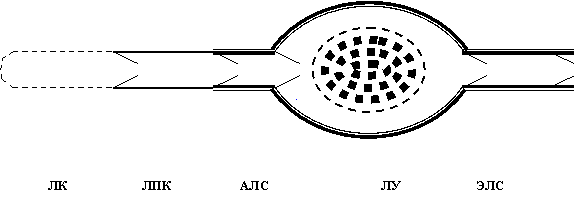
Рис. 2. Схема сегментарного строения лимфатического русла (обозначения рис. 1).
Клапаны с разным строением и положением - постоянные и ключевые структуры лимфатического русла, разделяют его на неодинаковые межклапанные сегменты. Их вариабельные движения определяются окружающими тканями: 1) избыточная тканевая жидкость фильтруется в просвет ЛК и ЛПК - лимфообразование, первичная лимфодвижущая сила (поршень тканевого насоса); 2) механическое давление тканей на сосудистые стенки (наружная манжетка тканевого насоса) (рис. 3, 4); 3) при недостаточности энергии лимфообразования возникает обратный лимфоток, он закрывает клапаны; в полости межклапанного сегмента скапливается лимфа и растягивает его стенки, что приводит к деформации и деполяризации мембран гладких миоцитов - так включается механизм сократительной активности ЛС. Клапанные сегменты представляют собой полуоткрытые системы с бесконечно большой емкостью, не способны сокращаться самостоятельно, обеспечивать эффективный транспорт лимфы. Сократившиеся (пассивно, активно) сегменты при расслаблении присасывают жидкость из предшествующего компартмента - важный фактор пассивного лимфотока. Пограничный клапан лимфангионов принадлежит им обоим, объединяет их стенки, но разделяет при закрытии их полости (компартментализация). Соседние лимфангионы сокращаются чаще раздельно, при поступлении в них критической порции лимфы, но могут сокращаться вместе: в крупных ЛС выражены надклапанные пучки миоцитов, они напрямую, минуя клапаны, соединяют мышечные манжетки соседних лимфангионов - короткий путь распространения волны мышечного сокращения на протяжении ЛС.
Новая концепция о строении лимфангиона позволила мне объяснить участие ЛУ в организации активного лимфооттока: они имеют строение комплексных (с лимфоидной тканью в стенках) лимфангионов, которые одновременно регулируют объем и состав лимфы в синусах. Мышечная сеть капсулы ЛУ (мышечная манжетка нодального лимфангиона) посредством мышечных пучков связана с лимфангионами ЛС непрерывного лимфатического русла. ЛУ являются его частью с момента закладки, когда в расширяющийся просвет первичных ЛС вместе с их тонкими эндотелиальными стенками инвагинируют кровеносные сосуды с толстыми и дифференцированными стенками. Лимфоток приносит в рыхлую межсосудистую соединительную ткань инвагинации обломки эмбриональных структур, они вызывают миграцию из кровеносных сосудов клеток крови (макрофагов и лимфоцитов). В результате инвагинация / стромальный зачаток ЛУ превращается в лимфоидный, он окружается сужающимся и искривляющимся просветом матричного ЛС (краевой синус ЛУ) и его утолщающейся стенкой (капсула ЛУ) [7].
|
|
 |
|
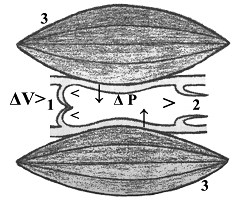
Рис. 3. Схема пассивного сокращения межклапанного сегмента лимфатического русла: 1,2 - входной и выходной клапаны сегмента; 3 - скелетная мышца; ΔV - градиент объема тканевой жидкости (поршень тканевого насоса); ΔP - градиент трансмурального давления (наружная манжетка тканевого насоса). |
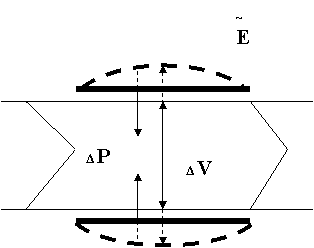
Рис. 4. Схема активного сокращения межклапанного сегмента (лимфангиона): ΔV - градиент объема лимфы (~ гидростатического давления); ΔP - градиент трансмурального давления (как результат сокращения мышечной манжетки ~ Ε).
|
Сегментарный принцип строения и функционирования я распространил на микроскопическую часть лимфатического русла. Из сети ЛК выходят ЛПК [8]. Первый клапан появляется в ЛПК, который обычно сопровождает венулу. ЛПК выходят из лакун сети ЛК и быстро или постепенно сужаются. Соединительнотканные клетки дублируют эндотелиальный слой в стенке ЛПК, гладкие миоциты отсутствуют. Стенка его настолько тонкая, что на тотальном препарате удается проследить эндотелиальный контур, что невозможно сделать в стенке ЛС. Резкий переход в строении, плотности стенок ЛК и ЛПК, ЛПК и ЛС не обнаружен. Однако разница между ними ясно видна при сопоставлении коллектора на протяжении с его притоком, звеном лимфатического русла более низкого порядка. ЛС имеют разное строение в разных оболочках органа. В субсерозном слое тонкой кишки быка, например, ЛС имеют наиболее толстую стенку и среднюю оболочку в виде сплошного мышечного слоя с (косо)поперечной ориентацией миоцитов, который может быть дополнен непостоянным, более рыхлым слоем миоцитов с более пологой ориентацией. ЛС с более тонкой стенкой и очень рыхлым мышечным слоем определяются в подслизистом слое, в котором лучше всего наблюдать переход ЛПК в ЛС. Клапаны ЛПК очень тонкие, едва различимые сквозь его тонкую стенку, в ЛПК первого порядка имеют вид небольшого сгущения клеток. Вокруг клапана ЛС первого порядка и в его основании находятся единичные мелкие миоциты, как и на протяжении мышечной манжетки. ЛПК состоит из межклапанных сегментов, но без миоцитов в их стенках, а потому может участвовать в организации только пассивного лимфоотока из органов с использованием энергии экстравазальных факторов.
Подвижные межэндотелиальные контакты в стенках ЛК давно рассматривают как интрамуральные миниклапаны [9]. Они регулируют фильтрацию тканевой жидкости в полость ЛК - отток из интерстициальных каналов в лимфатическое русло. Края эндотелиоцитов свободны и лишь частично заходят друг за друга. Наружная створка такого клапана фиксирована стропными филаментами, они препятствуют ее продавливанию тканевой жидкостью. Внутренняя створка не имеет стропных филаментов, подвижна и пропускает жидкость в просвет ЛК. Интрамуральные клапаны эндотелия находятся на входе в сегменты ЛК, а истинные клапаны ЛПК или ЛС - на выходе из (сети) ЛК. Роль наружной манжетки для сегментов ЛК и ЛПК играют окружающие их ткани, в том числе мышечные.
Заключение
В условиях дефицита собственной энергии лимфотока межклапанные сегменты лимфатического русла с разным строением организуют парциальное продвижение лимфы от органов к венам. В безмышечных звеньях лимфатического русла лимфоотток происходит под влиянием экстравазальных факторов (давление тока тканевой жидкости и окружающих тканей). В мышечных звеньях лимфатического русла при недостаточности энергии экстравазальных факторов включается механизм сократительной активности ЛС и ЛУ.
СПИСОК ЛИТЕРАТУРЫ:
- Бородин Ю.И., Сапин М.Р., Этинген Л.Е. и др. Общая анатомия лимфатической системы. Новосибирск: Наука СО, 1990, 243 с.
- Бородин Ю.И., Сапин М.Р., Этинген Л.Е. и др. Функциональная анатомия лимфатического узла. Новосибирск: Наука СО, 1992, 257 с.
- Сапин М.Р., Этинген Л.Е. Иммунная система человека. М.: Медицина, 1996, 406 с.
- Horstmann E. // Morphol.Jarb.- 1951.- Bd. 91.- № 4.- S. 483.
- Mislin H. // Lymphangiology.- Stuttgart - New York: Schaffauerverlag, 1983.- P.. 165.
- Петренко В.М. Функциональная морфология лимфатических сосудов. Второе издание. СПб: СПбГМА, ДЕАН, 2008, 400 с.
- Петренко В.М. Эволюция и онтогенез лимфатической системы. СПб: СПбГМА, ДЕАН, 2003, 336с.
- Куприянов В.В. Пути микроциркуляции (под световым и электронным микроскопом). Кишинев: Картя Молдовеняскэ, 1969, 260 с.
- Leak L.V., Burke J.F. // Cell..Biol.- 1968.- V. 36.- P. 129.