С давних пор процессы дубления кожи проводят в присутствии соединений хрома, которые, наряду со многими положительными качествами, обладают рядом недостатков экологического характера. Так, стоки отработанных растворов после хромового дубления загрязняют токсичными веществами природные водоемы, подземные воды и соответственно почвы, делая их непригодными для использования. Не представляется возможной и переработка обрезков кожи, большое количество которых образуется при изготовлении кожаных изделий. Для снижения остроты экологической ситуации в кожевенном производстве целесообразно использовать менее токсичные материалы, в частности дубитель на основе соли титана (IV) – аммоний титанил сульфат (СТА). Однако при растворении соли в воде титан (IV) подвергается гидролизу с образованием коллоидных частиц, которые не усваиваются кожей, что резко снижает эффективность дубления и качество кожи. В этой связи интерес представляют комплексные дубители, в которых один из компонентов подавляет гидролиз титана (IV) за счет связывания его в виде сульфатного комплекса [1]. Таким комплексоном может служить соль алюминия [2]. Кроме того, комбинация дубящих компонентов создает синергический эффект, заключающийся в повышении термостойкости кож при сохранении эластичности, присущей титановым кожам [3, 4]. Все это позволяет расширить области использования дубителя для производства как жестких, так и мягких кож, а также для меха с получением кожевенной продукции высокого качества.
Цель данной работы заключается в разработке нового варианта технологии двойной соли титана (IV) и алюминия – эффективного дубителя кож и меха, проведение физико-химических исследований фазообразования в поликомпонентной сульфатной системе.
Материалы и методы исследования
Известны публикации по получению дубящей композиции путем механического смешивания сульфатной титановой соли и сульфата алюминия [5]. Однако твердофазный процесс не позволяет получить гомогенную смесь и физико-химическое взаимодействие компонентов не происходит. Более эффективным способом получения комплексных дубителей является выделение их из титано-алюминиевых растворов методом кристаллизации.
Для получения сульфатных титано-алюминиевых растворов использовали модельные смеси, приготовленные из титанитового (состав мас. %: TiO2 – 37,1; P2O5 – 0,1; Al2O3 – 1,06; Fe2O3 – 1,37) и нефелинового (состав Al2O3 – 28,5; Na2O – 14,0; K2O – 7,25) концентратов. Массовое отношение титанит:нефелин = 1:1–10 мас. %. Смесь измельчали в шаровой мельнице и проводили сульфатизацию (разложение) минеральной смеси серной кислотой концентрации 500–600 г×л-1 H2SO4, при отношении Т:Vк-ты = 1:3,5. Продолжительность разложения – 7 ч. Процесс протекает в режиме кипения (температура 108–112 °С). В указанных условиях происходит выщелачивание из титанита и нефелина кислоторастворимых компонентов в жидкую сернокислотную фазу, обладающую высокой агрегативной стабильностью [6]. По истечению заданного времени реакционную массу охлаждали, фильтрованием отделяли жидкую фазу. Кристаллизацию из растворов композиционного соединения проводили путем введения в них высаливателя – кристаллического сульфата аммония. Методика включает периоды дозировки высаливателя, «вызревания» формирующейся твердой фазы с ростом кристаллов и образованием агрегатов, отделение осадка от жидкой фазы, его промывку насыщенным раствором сульфата аммония с целью стабилизации структуры. Фазовый состав полученных солей определяли с помощью рентгенофазового анализа на дифрактометре Shimadzu XRD-6000. Термограммы снимали с помощью NETZSCHSTA 409, размер частиц и морфологию их поверхности изучали на растровом электронном микроскопе SEM LEO 420. Для определения форм Ti (IV) в сульфатных растворах использовали известную методику [7]. Методика основана на различной скорости взаимодействия активных и пассивных форм Ti (IV) с пероксидом водорода – Н2O2 с образованием окрашенного пероксидно-титанового комплекса. Содержание форм Ti (IV) устанавливали по изменению оптической плотности раствора, выдержанного с Н2О2 от 5 минут до 24 ч (фотоколориметр КФК-3-01). Реакционно-активные формы Ti (IV) – РА, находящиеся в молекулярно-дисперсном состоянии, быстро реагируют с Н2О2. Пассивные формы Ti (IV) – П вступают во взаимодействие с пероксидом водорода постепенно по мере разрушения гидроксо-оксокомплексов Ti (IV). Содержание коллоидного Ti (IV) – К рассчитывали по формуле К = О – (РА + П), где О (общий титан) устанавливали по методике, предусматривающей кипячение аликвоты анализируемого раствора с серной кислотой.
Из технических свойств, максимальным образом характеризующих качество получаемого дубящего соединения, выбран показатель его основности (Х), который по требованию потребителей должен равняться 39–42 %. Величина основности связана с размером дубящего комплекса в растворе и скоростью образования при дублении коллоидных частиц, а следовательно, со степенью эффективного использования дубителя. Для определения основности использовали формулу
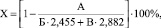
где А – содержание активной Н2SО4 в соли, %; Б – содержание TiO2 в соли; В – содержание Al2O3 в соли, %; 2,455 и 2,882 – коэффициенты пересчёта.
Результаты исследования и их обсуждение
При исследовании условий разложения смеси концентратов установлено, что с повышением содержания нефелина наблюдается снижением степени извлечения титана (IV) в жидкую фазу (рис. 1).
Выявленную зависимость можно объяснить ростом концентрации солевой массы в сернокислотной жидкой фазе за счет приоритетного выщелачивания из нефелина кислоторастворимых соединений (натрия, калия, алюминия), что приводит к снижению скорости выщелачивания титана (IV). Приемлемым содержанием нефелина в смеси следует считать 5–8 мас. % по отношению к массе титанита. Это условие позволяет провести процесс с выходом титана (IV) на уровне 93–96 % по TiO2.
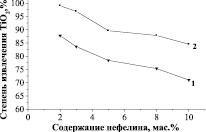
Рис. 1. Влияние содержания нефелина в смеси на степень извлечения титана (IV) в жидкую фазу. Условия сульфатизации при Т:Vк-ты – 1:3,5: 1 – H2SO4 – 500 г×л-1; 2 – H2SO4 – 600 г×л-1
Данные по состоянию титана (IV) в сульфатной жидкой фазе свидетельствуют о том, что практически весь титан (IV) находится в реакционно-активном состоянии (табл. 1) в виде мономерных и низкополимерных комплексов сульфатооксотитана (IV). Этот факт обуславливает высокую устойчивость системы в течение длительного времени к формированию твердой фазы [8], что способствует достижению концентрации титана в жидкой фазе примерно 100 г·л-1 по TiO2. При этом содержание серной кислоты составляет 450–550 г·л-1, в том числе в свободном состоянии – 325–425 г·л-1.
Как правило, кристаллизация солей из растворов происходит при условии «пересыщения» системы, которое вызывает массовое формирование твердой фазы [9]. В исследуемом случае «пересыщение» в системе достигается добавкой сульфата аммония до суммарного количества [H2SO4 + (NH4)2SO4]своб. равного 550 г·л-1 [10]. В указанных условиях в системе формируются две фазы – аммоний титанил сульфат (NH4)2TiO(SO4)2•H2O и алюмоаммонийные квасцы NH4Al(SO4)2·12H2O (ААК) [11]. Для обоснования влияния концентрационных параметров процесса на свойства композиции (основность) и выбора для оптимальных условий синтеза продукта проведены исследования фазообразования в одном из разрезов системы TiO2(Al2O3) – H2SO4 – (NH4)2SO4 – H2O, реализуемой в условиях, приближенных к равновесию. При этом концентрации H2SO4 и TiO2 были фиксированными, равными соответственно 400 г×л-1 и 70 г×л-1. Для проведения экспериментов использовались растворы, полученные из модельных смесей титанита и нефелина. Концентрацию сульфата аммония изменяли в пределах 80–320 г×л-1 (NH4)2SO4своб.. Содержание алюминия (Al2O3) варьировалось от 1 до 16 г×л-1 (0,01–0,16 моль·л-1). Выбор реперных точек обусловлен технологическими особенностями процесса. В частности, содержание в исходном растворе свободной серной кислоты более 400 г×л-1 делает их агрегативно нестабильными – может формироваться твердая фаза в виде Al2(SO4)3·18H2O (рис. 2). Добавка сульфата аммония выше 320 г×л-1 нерациональна, так как это практически не сказывается на степени высаливания компонентов, а лишь повышает содержание сульфата аммония в конечном продукте.
Полученные результаты обрабатывали с использованием компьютерной программы «Статистика». Данные представлены в виде диаграммы (рис. 2), на которой изображена поверхность основностей твердых фаз, полученных из растворов сульфата титана (IV), содержащего алюминий.
Таблица 1
Изменение содержания титана (IV) в жидкой фазе при сернокислотном разложении смеси минеральных частиц различной крупности. Исходная концентрация серной кислоты 550 г·л-1
|
Фракция частиц смеси, мкм |
Содержание титана (IV) по TiO2, г·л-1 через …ч |
||||||
|
0,5 |
2,0* |
3,0 |
4,0* |
5,0 |
7,0 |
24,0* |
|
|
<28 |
19,6 |
57,8/57,0 |
69,5 |
81,0/80,3 |
86,2 |
97,2 |
97,0/96,8 |
|
<63 |
6,4 |
26,9/26,5 |
38,0 |
47,8/47,5 |
56,0 |
75,5 |
78,2/78,0 |
|
63–100 |
5,6 |
20,8/20,4 |
27,6 |
35,0/34,3 |
42,0 |
52,4 |
50,1/50,0 |
Примечание. * Числитель – содержание общего титана (IV) – О, знаменатель – содержание реакционно-активного титана (IV) – РА.
При низкой концентрации свободного сульфата аммония 80–130 г×л-1, равно как и при его концентрации более 300 г×л-1 (NH4)2SO4своб., во всем изученном диапазоне изменения концентрации алюминия (Al2O3) при высаливании формируются твердые фазы, показатель основности которых не превышает 28 %. В интервале изменения концентрации сульфата аммония от 200 до 280 г×л-1 и при изменении содержания в растворе алюминия от 1 до 12 г×л-1 (0,01–0,12 моль·л-1) показатель основности твердых фаз изменяется от 38,5 до 42 %. Дальнейшее повышение концентрации алюминия при этом же диапазоне изменения содержания сульфата аммония сопровождается снижением основности до 30 %, что может быть связано с повышением количества в составе твердой фазы более «кислых» солей, в частности ААК. Чем больше ААК в составе фаз, тем формирующиеся твердые фазы содержат большее количество серной кислоты и, соответственно, тем ниже показатель основности. Лишь небольшая концентрационная область в системе – (NH4)2SO4своб. 220–270 г×л-1 и Al2O3 1–12 г×л-1 обеспечивает показатель основности формирующихся в процессе высаливания твердых фаз 39–42 %.
Механизм формирования композиции протекает в несколько последовательных стадий. На первой стадии введения сульфата аммония из-за высокой растворимости образуются лишь наноразмерные зародыши титановой фазы. Фаза алюмоаммонийных квасцов с более низкой растворимостью образует при этом более крупные частицы – размером 25–40 мкм. Повышение количества вводимого высаливателя ускоряет фазообразование, и процесс переходит на вторую стадию, когда на макрочастицах квасцов происходит формирование второй фазы – аммоний титанилсульфата (NH4)2TiO(SO4)2×H2O. Третья стадия - это «вызревание» композиционной твердой фазы с уменьшением поверхностного заряда частиц, что ослабляет связь жидкой и твердой фаз и обеспечивает хорошее разделение при фильтровании суспензии. Твердая фаза, выделенная в оптимальной области (NH4)2SO4своб. 200–220 г×л-1; Al2O3 – 10 г×л-1, исследована с помощью физико-химических методов.
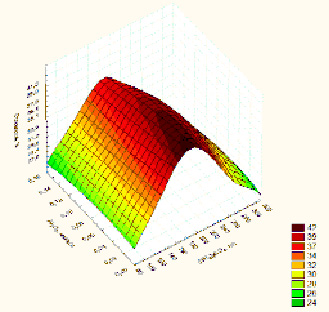
Рис. 2. Фазообразование в системе TiO2 – Al2O3 – H2SO4 – (NH4)2SO4 – H2O (исходные концентрации, г×л-1: H2SO4своб. – 400, TiO2 – 70) при получении композиционного дубителя


а) б)
Рис. 3. SEМ-изображение частиц твердых фаз: а) СТА; б) СТА + ААК
Таблица 2
Содержание форм титана (IV) в растворах и их стабильность
|
Соль |
Содержание титана (IV) по TiO2, г·л-1 / % к исходному |
||||
|
О |
РА |
П |
К |
Стабильность, л |
|
|
СТА |
50 |
17,8/35,6 |
26,1/52,2 |
6,1/12,2 |
2,6 |
|
СТА + АКК |
50 |
35,7/71,4 |
14,0/28,0 |
1,3/2,6 |
4,2 |
Согласно данным электронной микроскопии (рис. 3, а) кристаллы «чистой» титановой соли относятся к кубической сингонии и представляют собой изотропные тетрагонтритетраэдры с показателем преломления Nср = 1,580. Поверхность кристаллов покрыта неравномерной оболочкой, что деформирует их грани. Кристаллы титано-алюминиевой композиции хорошо раскристаллизованы в кубической сингонии, изотропные октаэдрические и имеют показатель преломления Nср = 1,459 (рис. 3, б).
Данные по состоянию различных форм титана (IV) в растворах исследуемых кристаллических соединений и по их стабильности приведены в табл. 2. Стабильность раствора определялась визуально. Её показатель соответствует количеству воды, израсходованному на 1 мл анализируемого раствора, вызывающему гидролиз Ti (IV). При растворении солей в воде их расход соответствует содержанию в растворе TiO2 50 г·л-1 [12–14].
Судя по показателям, более высокую агрегативную стабильность проявляют растворы, полученные из композиционного титано-алюминиевого соединения. Превышение составляет 1,6 раза. Это связано с тем, что алюминий образует с титаном (IV) комплекс, что повышает устойчивость системы к гидролизу. Так, содержание коллоидного титана в растворе СТА + АAК примерно в 6 раз меньше, чем в растворе СТА. Этот факт крайне важен для использования полученного композиционного соединения в качестве дубящего средства. Полученные результаты явились основой для разработки технологии титано-алюминиевого дубителя [15].
Выводы
Предложен механизм кристаллизации титано-алюминиевой композиции, основанный на различной растворимости её компонентов. На первой стадии приоритет в фазообразовании принадлежит алюмо-аммонийной фазе – АAК, активные частицы которой являются базовой основой для осаждения наноразмерных кристаллитов титано-аммонийной фазы с последующим ростом её частиц. Такой порядок формирования твердой фазы сопровождается физико-химическим взаимодействием между активными солевыми компонентами (титан и алюминий) с образованием между ними метастабильной связи. В результате проведенных исследований разработан новый вариант технологии комплексного титано-алюминиевого дубителя из титанитового концентрата, содержащего минерал нефелин.
Для обоснования влияния концентрационных параметров процесса на свойства композиции (основность) и для выбора оптимальных условий синтеза продукта проведены исследования фазообразования в одном из разрезов системы TiO2(Al2O3) – H2SO4 – (NH4)2SO4 – H2O с фиксированным содержанием H2SO4 и TiO2 соответственно 400 г×л-1и 70 г×л-1, реализуемой в условиях, приближенных к равновесию. Концентрацию сульфата аммония изменяли в пределах 80–320 г×л-1 (NH4)2SO4своб., алюминия 1–16 г×л-1 по Al2O3. Полученные результаты обработаны с использованием компьютерной программы «Статистика», что позволило наглядно выделить концентрационную область – (NH4)2SO4своб. 220–270 г×л-1 и Al2O3 1–12 г×л-1, в которой обеспечивается формирование композиционных твердых фаз с показателем основности 39–42 %.
Исследование выполнено за счет средств гранта Российского научного фонда (проект № 17-19-01522).



