В связи с истощением запасов богатых магнетитовых руд развиваются исследования по технологии переработки титаномагнетитовых руд для получения железа, титана, хрома и ванадия [1, 2]. Присутствие в титаномагнетитовых рудах V2O3 и V2O5 сделало их главным источником в мировой промышленности для получения ванадия.
В работе [3] термодинамическими расчетами и экспериментально показана принципиальная возможность одностадийной переработки ильменитового концентрата в искусственный рутил товарного качества. Метод основан на селективной хлоридовозгонке железа и примесей магния, хрома, марганца, серы, ванадия хлором без использования восстановителя. Установлено, что основная масса железа и ванадия извлекается из титановых концентратов за 10 мин при температуре 1373 K и атмосферном давлении. В работе [4] представлены результаты исследований по оценке влияния минерального состава титаномагнетитовой руды Северной залежи Гусевогорского месторождения, содержащие диоксид титана (ТiO2) и пентаоксид ванадия (V2O5). Выявлено, что на распределение ильменита по магнитным фракциям в основном влияет форма нахождения данного минерала в руде – в виде зерен или ламелей. При выбранной схеме магнитной сепарации руды ильменит в виде зерен попадает главным образом в слабомагнитные фракции (хвосты), большая же часть ильменита в ламелях сосредотачивается в ферромагнитной фракции, т.е. концентрате, что приводит к повышенному содержанию в последнем TiO2 (2–2,5 %) и V2O5 (0,8–1 %). В обзорной статье [5] проанализированы технологии для обработки титаномагнетитов, содержащих ванадий. Каждый процесс разработан на основе относительных количеств титана, ванадия и железа. Для руд с малым содержанием титана и ванадия сталеплавильное производство является основной целью, за которой следует вторичное извлечение ванадия. Для руд с относительно высоким содержанием титана и ванадия TiO2 (2–3 %) и V2O5 (1–1,5 %) основным продуктом является ванадий. Работа [6] посвящена экстракции пентаоксида ванадия из титаномагнетитового шлака, содержащего менее 1 % V2O5. В частности, в [6] сообщается, что при добавке 15 % Na2CO3 к титаномагнетитовому шлаку, содержащему около 0,9 % V2O5, при обжиге шлака в 1100 °С в течение 60 минут из него извлекается 27 % V2O5. В работе [7] была проведена комплексная переработка труднообогатимых титансодержащих руд методами карбохлорирования и гидрометаллургии. Сопоставление результатов комплексной переработки трех минералов (ильменита, сфена и рутила) показало, при использовании карбохлорирования (800 °С, время 60 мин) степень извлечения титана составляет 99 %, железа – 98 %, в то же время при использовании гидрометаллургического метода степень извлечения этих металлов не превышает 47 %. Высокая эффективность метода карбохлорирования показывает, что этот метод может быть использован для извлечения ванадия. В работах [8, 9] при обработке офлюсованных содой титаномагнетитовых концентратов в качестве восстановителя был использован природный газ. В работе [10] объектами исследования явились концентраты ванадистых титаномагнетитов юго-западного побережья Каспия в Азербайджане, содержащих наряду с V2O5 оксид V2O3.
В этой работе объектами исследования являются Аджинаурские песчаники Азербайджана, которые содержат: Feобщ – в пределах 6–12 %, иногда до 22–38,5 %; TiO2 – в пределах 0,7–1,7 %, иногда до 3,2–5,9 %; Mn – до 0,5–0,7 %; V – до 0,3–0,5 %; Cr – 0,01–0,1 %; Al2O3 – 10–18 %; SiO2 – 23–60 %; CaO – 5–10 %; MgO – 4–6 %; P2O5 – 0,1–0,3 %; SO3 – 0,07–0,2 %; CoO – 0,005–0,01 %. Обогащением Аджинаурских песчаников Азербайджана получаются титаномагнетитовые концентраты, в которых содержание целевых компонентов железа Feобщ – 51–54 мас. %, TiO2 – мас. 5–7 % и 1–1,5 мас % V2O5 и V2O3. Для полного вскрытия и перехода ванадия в ванадатный раствор в первую очередь необходимо определить термодинамические условия окисления V3+ до V5+.
Целью этой работы является определение равновесных и неравновесных термодинамических условий прямого восстановления магнетита до свободного железа и окисления V3+ до V4+ и V5+ в гранулах офлюсованных содой ванадистых титаномагнетитовых концентратов с участием природного газа.
Объектами исследования являются гранулы концентратов Аджинаурских титаномагнетитовых песчаников Азербайджана с флюсовыми добавками 25 % мас. доли соды. На основе теории гранулирования в барабанном аппарате, по методике, описанной в [11], получены гранулы с флюсовыми добавками 25 % соды с оптимальным диаметром, влажностью, прочностью и пористостью.
Термодинамические функции окислительно-восстановительных реакций
Суммарные реакции окисления оксида ванадия (3) и восстановления магнетита метаном без участия соды и с участием соды имеют следующий вид:
без участия соды:
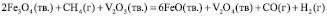 , (1)
, (1)
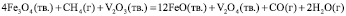 , (2)
, (2)
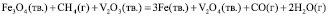 (3)
(3)
и с участием соды:
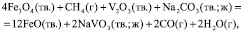 (4)
(4)
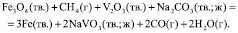 (5)
(5)
Диоксид титан TiO2, не участвующий в окислительно-восстановительном процессе [9], не включен в уравнения реакций (1–5).
Для определения температурных зависимостей свободной энергии Гиббса реакций (1–5) в интервале температур 500–1400 К использовано уравнение Улиха [12], модифицированное с учетом термодинамических функций образования твердых растворов и значений давления пара летучих компонентов:
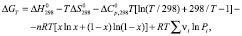 (6)
(6)
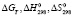 – свободные энергии, стандартные энтальпии и энтропии реакций (1–5),
– свободные энергии, стандартные энтальпии и энтропии реакций (1–5), 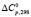 – суммарное изменение теплоемкости веществ, участвующих в реакциях (1–5), ni – cтехиометрические коэффициенты, Pi – парциальные давления компонентов в неравновесном состоянии. Третье слагаемое в уравнении (6) представляет собой свободную энергию образования твердых растворов вследствие замещения ионов V3+ в кристаллической ячейке Fe3O4 ионов Fe3+ с образованием твердых растворов
– суммарное изменение теплоемкости веществ, участвующих в реакциях (1–5), ni – cтехиометрические коэффициенты, Pi – парциальные давления компонентов в неравновесном состоянии. Третье слагаемое в уравнении (6) представляет собой свободную энергию образования твердых растворов вследствие замещения ионов V3+ в кристаллической ячейке Fe3O4 ионов Fe3+ с образованием твердых растворов 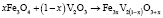 , n – общее число разноименных катионов в твердом растворе.
, n – общее число разноименных катионов в твердом растворе.
Первые четыре слагаемые в уравнении (6) относятся к состоянию равновесия химических реакций. Следовательно, нижеприведенное уравнение представляет собой температурную зависимость стандартной свободной энергии Гиббса:
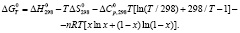 (7)
(7)
Термодинамические параметры соединений и простых веществ, участвующих в реакциях, заимствованы из [13]. В расчетах были использованы величины:
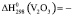 1218,7 ± 2,5 Дж/моль;
1218,7 ± 2,5 Дж/моль; 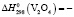 1426,7 ± 2,5;
1426,7 ± 2,5; 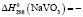 1148,6 ± 2,5;
1148,6 ± 2,5; 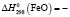 264,8 ± 0,6;
264,8 ± 0,6; 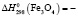 1117,2 ± 2,5;
1117,2 ± 2,5; 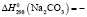 1129,4 ± 2,5;
1129,4 ± 2,5; 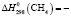 74,8 ± 0,5;
74,8 ± 0,5; 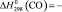 110,5 ± 0,5;
110,5 ± 0,5; 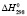 (H2O, газ) = – 241,8 ± 0,5,
(H2O, газ) = – 241,8 ± 0,5, 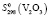 = 98,32 ± 1,5 Дж/(моль, K);
= 98,32 ± 1,5 Дж/(моль, K); 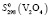 = 96,61 ± 1,5;
= 96,61 ± 1,5; 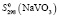 = 99,98 ± 1,5;
= 99,98 ± 1,5; 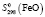 = 60,82 ± 1,2;
= 60,82 ± 1,2; 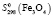 = 146,21 ± 2,5;
= 146,21 ± 2,5; 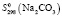 = 134,97 ± 2,;
= 134,97 ± 2,; 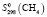 = 186,19 ± 2,5;
= 186,19 ± 2,5; 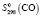 = 197,69 ± 0,5;
= 197,69 ± 0,5; 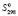 (H2O, газ) = 188,74 ± 2,5,
(H2O, газ) = 188,74 ± 2,5, 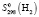 = 130,61 ± 1,5,
= 130,61 ± 1,5, 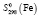 = 27,15 ± 0,5,
= 27,15 ± 0,5, 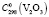 = 103,2 ± 0,5 Дж/(моль, K);
= 103,2 ± 0,5 Дж/(моль, K); 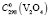 = 114,6 ± 0,5;
= 114,6 ± 0,5; 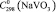 = 97,6 ± 0,5;
= 97,6 ± 0,5; 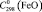 = 49,9 ± 0,5;
= 49,9 ± 0,5; 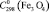 = 150,8 ± 1,0;
= 150,8 ± 1,0; 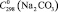 = 112,3 ± 1,5;
= 112,3 ± 1,5; 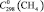 = 35,8 ± 0,5;
= 35,8 ± 0,5; 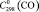 = 29,2 ± 0,5;
= 29,2 ± 0,5; 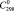 (H2O, газ) = 33,6 ± 0,5,
(H2O, газ) = 33,6 ± 0,5, 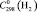 = 28,8 ± 0,5,
= 28,8 ± 0,5, 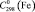 = 25,2 ± 0,5.
= 25,2 ± 0,5.
В рассматриваемом температурном интервале карбонат натрия и метаванадат натрия плавятся: Тпл(Na2CO3) = 1137 K, Тпл(NaVO3) = 963 K. Поэтому при определении температурной зависимости свободных энергий Гиббса реакций (4, 5) по уравнению (6, 7) использовали энтальпию и энтропию плавления этих соединений:
ΔНпл(Na2CO3) = 28080 Дж/моль,
ΔНпл(NaVO3) = 28310 Дж/моль,
ΔSпл(Na2CO3) = 24,77 Дж/(моль, К),
ΔSпл(NaVO3) = 31,38 Дж/(моль, К).
Результаты исследования и их обсуждение
На рис. 1 и 2 представлены результаты расчетов по уравнениям (6 и 7).
Реакция 1 во всем температурном интервале (рис. 1) имеет положительные значения свободной энергии Гиббса. Это объясняется тем, что полученный водород стимулирует восстановление иона железа Fe+3 в магнетите до Fe+2 с получением молекул воды и окисление иона ванадия V+3 до V+4. Следовательно, реакция (2) протекает в большей степени. Начиная примерно с 1280 К имеет отрицательные значения свободной энергии Гиббса (рис. 1). Свободная энергия реакции (3) с получением металлического железа также приобретает отрицательные значения начиная примерно с 1280 К. Более эффективно проходят окислительно-восстановительные реакции 4, 5 с участием соды (рис. 1, зависимости 4 а, b, c и 5 a, b, c). Отрицательные значения стандартной свободной энергии Гиббса этих реакций наблюдаются, начиная, примерно с 1160 К. Учет энтальпии и энтропии плавления карбоната и ванадата натрия мало влияет на ход зависимости стандартной свободной энергии Гиббса от температуры (рис. 1, зависимости 4 а, b, c и 5 a, b, c). Это объясняется тем, что эти величины в виде разности их значений входят в уравнениях (6 и 7), при этом сода является исходным веществом, а ванадат натрия продуктом реакций 4 и 5.
На основе наших экспериментальных данных выявлено, что реакции (1–3) с отсутствием соды, несмотря на высокую термодинамическую вероятность протекания, имеют невысокую продуктивность. Это объясняется тем, что сода существенно уменьшает энергию активности и выступает в роли катализатора в реакциях (4, 5). На рис. 2 приведены зависимости свободных энергий Гиббса реакций (4 и 5) от температуры как для равновесного состояния (линии 4/, 5/, расчет по уравнению (6)), так и неравновесного состояния (линии 4//, 5//, расчет по уравнению (7)). Рассматривается температурный интервал с 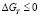 . При проточной системе, когда непрерывно подается метан и удаляются газообразные продукты реакции, равновесие не достигается:
. При проточной системе, когда непрерывно подается метан и удаляются газообразные продукты реакции, равновесие не достигается:
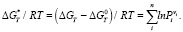 (8)
(8)
ΔGТ* в (8) является мерой отклонения системы от равновесного состояния. В равновесном состоянии суммарное давление пара 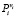 равно единице – 1 атм. В неравновесном состоянии, когда удаляются газообразные продукты, эта величина уменьшается. В частности в реакции (5) в неравновесном состоянии величина
равно единице – 1 атм. В неравновесном состоянии, когда удаляются газообразные продукты, эта величина уменьшается. В частности в реакции (5) в неравновесном состоянии величина 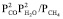 меняется от величины 0,001 (зависимость 5// на рис. 2) до 1 атм. (зависимость 5/ на рис. 2). Из рис. 2 следует, что реакция 5 в равновесном состоянии направляется в сторону продуктов начиная с 1150 К, а при суммарном давлении 0,001 атм – начиная с 1000 К. Реакция 4 в равновесном состоянии направляется в сторону продуктов при 1050 К, а при суммарном давлении 0,001 атм – начиная с 950 К.
меняется от величины 0,001 (зависимость 5// на рис. 2) до 1 атм. (зависимость 5/ на рис. 2). Из рис. 2 следует, что реакция 5 в равновесном состоянии направляется в сторону продуктов начиная с 1150 К, а при суммарном давлении 0,001 атм – начиная с 1000 К. Реакция 4 в равновесном состоянии направляется в сторону продуктов при 1050 К, а при суммарном давлении 0,001 атм – начиная с 950 К.
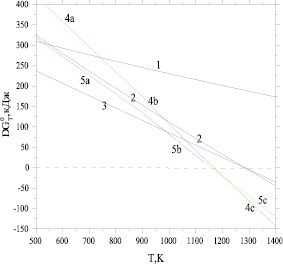
Рис. 1. Зависимости стандартных свободных энергий Гиббса реакций (1–5) от температуры (расчет по уравнению (6)). Зависимости 1–5 относятся к реакциям 1–5, при этом зависимости 4 а, 5а относятся к температурному интервалу от 500 К до Тпл(NaVO3) = 963 K, зависимости 4 b, 5 b – от 963 К до Тпл(Na2CO3) = 1137 K, зависимости 4 с, 5 с – от 1137 К до 1400 К
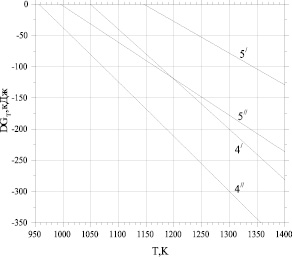
Рис. 2. Зависимости свободных энергий Гиббса реакций (4 и 5) от температуры в равновесном состоянии (линии 4/, 5/, расчет по уравнению (6)) и неравновесном состоянии (линии 4//, 5// , расчет по уравнению (7))
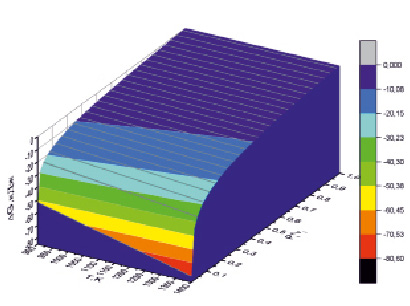
Рис. 3. 3D модель зависимости разности свободной энергии Гиббса реакций (4) и (5) от суммарного отношения парциальных давлений в проточном режиме метана при восстановлении железа и окислении ванадия
Для выявления характера зависимости отклонения от равновесного состояния проведено 3D моделирование зависимости величины ΔGТ* для реакций (4 и 5) от суммарного отношения парциальных давлений в проточном режиме восстановления железа и ванадия метаном (рис. 3). Для 3D моделирования величины ΔGТ* использован аналитический метод, апробированный в работе [14].
Заключение
Для определения равновесных и неравновесных термодинамических условий прямого восстановления магнетита до свободного железа и окисления V3+ до V4+ и V5+ в гранулах офлюсованных содой ванадистых титаномагнетитовых концентратов с участием природного газа необходимо учитывать свободные энергии образования твердых растворов замещения на основе магнетита и значения давления пара компонентов в проточной системе, когда непрерывно подается метан и удаляются газообразные продукты реакции.
3D модель (рис. 3) свободной энергии отклонения системы от равновесного состояния в зависимости от суммарного отношения парциальных давлений в проточном режиме восстановления железа и окисления ванадия метаном показывает, что наибольший эффект уменьшения температуры окислительно-восстановительных реакций наблюдается в области малых значений давления пара продуктов реакции.
На основе проведенного термодинамического анализа был выбран температурный интервал 1070–1170 для осуществления реакции (4) и температурный интервал 1170–1270 для осуществления реакции (5) в проточном режиме, когда непрерывно подается метан и удаляются газообразные продукты реакции. Выбранный температурный режим позволил нам успешно решить задачу получения железа и ванадата натрия.
Работа выполнена при поддержке гранта Фонда развития науки Президента Азербайджана EIF/MQM/ Наука и образование-1-2016-1(26).



