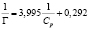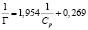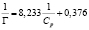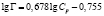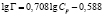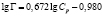Промышленные сточные воды современных производственных предприятий отличаются содержанием в них значительного количества органических соединений, таких как нефтепродукты, фенолы, ароматические углеводороды, масла, смолы, аминопродукты и многие другие [1]. Состав органических загрязнителей в сточных водах разных предприятий весьма различен и колеблется в широких пределах даже на предприятиях и цехах одного и того же производственного профиля [2].
Особого внимания заслуживают предприятия различных отраслей органического синтеза, таких как производство красителей, агротехнологические производства (фунгицидов, ветеринарных антигельминтных препаратов и др.), предприятия по производству ингибиторов коррозии, металлургические предприятия, заводы по производству полимеров. Указанные производства способствуют попаданию в сточные воды такого сильного токсиканта, как орто-фенилендиамин.
Для очистки стоков от о-фенилендиамина было предложено использование адсорбционных фильтров с бентонитовыми загрузками, включающими бентониты различных модификаций [3]. Для установления наиболее предпочтительных вариантов модификаций бентонита по отношению к о-фенилендиамину необходимо было экспериментально проверить эффективность адсорбции органических катионов на нескольких модифицированных сорбентах в статических условиях.
Материалы и методы исследования
Лабораторные исследования сорбционных характеристик бентонитов по отношению к о-фенилендиамину выполнялись на следующих сорбентах: немодифицированном гранулированном бентоните; бентоните, модифицированном углеродными нанотрубками; бентоните, модифицированном глицерином и углеродными нанотрубками.
В процессе проведения лабораторного эксперимента навеску, содержащую 10–100 мкг 1,2-фенилендиамина, растворяли в 0,5 мл концентрированной Н2S04 и разбавляли водой до объема 2 мл. После охлаждения осторожно добавляли 2 мл 6,5 н раствора NaОН и 1 мл 2 %-ного раствора ацетилацетона. Красный раствор через 3 мин фотометрировали при 560 нм [4].
Оценка параметров эффективности сорбции проводилась путем установления равновесных концентраций Ср о-фенилендиамина. В каждом эксперименте равновесная концентрация о-фенилендиамина определялась по установившимся значениям концентрации загрязнителя во времени.
Величина адсорбции определялась по зависимости
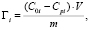 (1)
(1)
где С0i – исходная концентрация органического вещества в растворе, Сpi – равновесная концентрация органического вещества в растворе (мг/л); V – объем раствора (л); m – масса навески бентонита (г).
Значения статической обменной емкости СОЕ (мг-экв/г) в соответствии с литературой [5] определялись, как 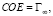 где величина Г∞ – предельное значение величины адсорбции (мг-экв/г) [6].
где величина Г∞ – предельное значение величины адсорбции (мг-экв/г) [6].
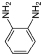
Коэффициент межфазного распределения Kd (мг/л) о-фенилендиамина между фазой сорбента и водной фазой определялся по формуле [7]:
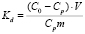 . (2)
. (2)
Решая совместно выражения (1) и (2), получили зависимость, использованную для расчета коэффициента межфазного распределения:
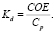 (3)
(3)
Для расчета степени адсорбционного извлечения использовалась формула [7, 8]:
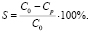 (4)
(4)
Для изучения особенностей взаимодействия катионов о-фенилендиамина с изучаемыми сорбентами были выбраны три подхода, а именно изотермы Ленгмюра, Фрейндлиха и Бронауэра-Эммета-Тейлера (изотермы БЭТ) [9]. По результатам расчетов были построены изотермы адсорбции, отвечающие требованиям каждой из этих моделей.
Результаты исследования и их обсуждение
Установленные экспериментально значения равновесной концентрации Сp о-фенилендиамина в растворе при разных значениях его начальной концентрации приведены в табл. 1.
Общая изотерма адсорбции о-фенилендиамина представлена на графике (рис. 1).
Значения СОЕ при адсорбции о-фенилендиаминана исследуемых немодифицированном и модифицированных бентонитах приведены в табл. 2.
Значения Kd для адсорбции о-фенилендиамина на изучаемых сорбентах приведены в табл. 3.
Значения степени адсорбционного извлечения S для адсорбции о-фенилендиаминана изучаемых сорбентах приведены в табл. 4.
Характеристики эффективности изучаемых сорбентов по отношению к о-фенилендиамину, приведенные в табл. 2–4, свидетельствуют о том, что наибольшей эффективностью по отношению к исследуемому токсиканту обладает бентонит, модифицированный нанотрубками.
При дальнейшем теоретическом анализе механизма адсорбции о-фенилендиамина на изучаемых сорбентах в статических условиях были построены изотермы адсорбции типа Г = f(Cp).
Для изучения особенностей взаимодействия катионов о-фенилендиамина с изучаемыми сорбентами построены изотермы адсорбции о-фенилендиамина на бентоните с углеродными нанотрубками, как наиболее эффективном из рассматриваемых сорбентов. Таким образом, изотерма адсорбции о-фенилендиамина на бентоните, модифицированном углеродными нанотрубками, в линеаризованной по Ленгмюру форме приведена на рис. 3. Изотерма адсорбции о-фенилендиамина на бентоните, модифицированном углеродными нанотрубками, линеаризованная по Фрейндлиху, показана на рис. 4.
Таблица 1
Значения исходной концентрации (С0) и величины адсорбции (Г) о-фенилендиамина
|
С0, мг/л |
0 |
20 |
30 |
40 |
50 |
100 |
200 |
400 |
600 |
800 |
1000 |
1500 |
2000 |
2500 |
3000 |
|
|
Г, мг/г |
Немодифицир. бентонит |
0 |
0,44 |
0,53 |
0,67 |
0,88 |
0,99 |
0,99 |
2,34 |
2,34 |
7,23 |
9,84 |
13,87 |
21,02 |
22,17 |
22,1 |
|
Бентонит, модифицир. углеродными нанотрубками |
0 |
0,5 |
0,74 |
0,92 |
0,99 |
1,2 |
1,2 |
5,16 |
5,16 |
13,5 |
18,1 |
30,4 |
41,85 |
51,62 |
51,31 |
|
|
Бентонит, модифицир. глицерином и углеродными нанотрубками |
0 |
0,48 |
0,67 |
0,86 |
1,01 |
1,04 |
1,04 |
3,34 |
3,34 |
8,96 |
11,58 |
24,9 |
31,35 |
37,94 |
38,43 |
|
Таблица 2
Значения СОЕ при адсорбции о-фенилендиамина на исследуемых сорбентах (Т = 20 °С)
|
Органическое вещество |
Вид модификации бентонита |
мг-экв/г |
s2 |
σ |
ΔCOE, мг-экв/г |
мг-экв/г |
|
|
Немодифицированный бентонит |
22,10 |
0,180 |
0,424 |
± 1,05 |
22,10 ± 1,085 |
|
Бентонит, модифицир. углеродными нанотрубками |
51,310 |
0,108 |
0,328 |
± 0,815 |
51,310 ± 0,815 |
|
|
Бентонит, модифицир. глицерином и углеродными нанотрубками |
38,430 |
0,103 |
0,321 |
± 0,755 |
38,430 ± 0,755 |
Таблица 3
Значения Kd для адсорбции о-толуидина и о-фенилендиамина на изучаемых сорбентах (Т = 20 °С)
|
Органическое вещество |
Вид модификации бентонита |
мг/л |
s2 |
σ |
ΔKd , мг/л |
мг /л |
|
|
Немодифицированный бентонит |
0,01 |
3,3·10-7 |
5,8·10-4 |
± 0,001 |
0,01 ± 0,001 |
|
Бентонит, модифицир. углеродными нанотрубками |
0,048 |
3·10-6 |
1,7·10-4 |
± 0,004 |
0,048 ± 0,004 |
|
|
Бентонит, модифицир. глицерином и углеродными нанотрубками |
0,025 |
3·10-7 |
5,8·10-4 |
± 0,001 |
0,025 ± 0,001 |
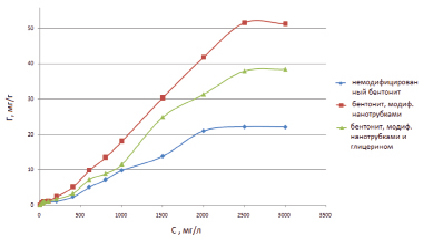
Рис. 1. Изотермы сорбции о-фенилендиамина на разных вариантах модифицированного бентонита в статических условиях
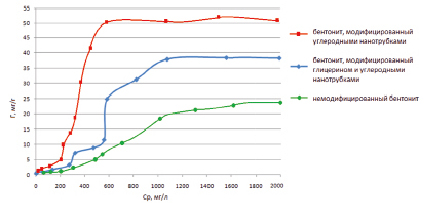
Рис. 2. Изотермы адсорбции Г = f(Cp) о-фенилендиамина на изучаемых сорбентах
По аналогии с графиками на рис. 3 и 4 были построены графики изотерм адсорбции о-фенилендиамина, линеаризованные по Ленгмюру и Фрейндлиху для других изучаемых видов модификации бентонита. Построение изотерм адсорбции о-фенилендиамина, линеаризованных в соответствии с моделью Бронауэра – Эммета – Тейлера (БЭТ) показало, что использование данной модели неприменимо к текущим процессам, поскольку величина аппроксимации полученных экспериментальных данных по отношению к линеаризованной по БЭТ-форме модели не превышала R2 = 0,06.
Сравнение построенных моделей, исходя из величины аппроксимации каждой из них [10], позволяет утверждать, что механизмы адсорбции о-фенилендиаминана на всех изучаемых сорбентах более всего отвечают модели Фрейндлиха (см. табл. 5).
Таблица 4
Значения СОЕ для адсорбции о-фенилендиамина на изучаемых сорбентах (Т = 20 °С)
|
Органическое вещество |
Вид модификации бентонита |
|
s2 |
σ |
ΔS, % |
|
|
|
Немодифицированный бентонит |
27,625 |
0,445 |
0,674 |
± 1,67 |
27,625 ± 1,67 |
|
Бентонит, модифицир. углеродными нанотрубками |
64,14 |
0,500 |
0,707 |
± 1,757 |
64,14 ± 1,757 |
|
|
Бентонит, модифицир. глицерином и углеродными нанотрубками |
47,92 |
0,053 |
0,23 |
± 0,572 |
47,92 ± 0,572 |
Таблица 5
Параметры моделей адсорбции o-фенилендиамина на изучаемых сорбентах
|
Изотерма Ленгмюра |
||||
|
Адсорбент |
уравнение |
KL, л/мг |
Г∞, мг/г |
R2 |
|
Бентонит, модифицированный глицерином и углеродными нанотрубками |
|
0,073 |
3,425 |
0,768 |
|
Бентонит, модифицированный углеродными нанотрубками |
|
0,138 |
3,717 |
0,748 |
|
Немодифицированный бентонит |
|
0,046 |
2,660 |
0,709 |
|
Изотерма Фрейндлиха |
||||
|
Адсорбент |
уравнение |
KF, (мг/г)·(л/мг)1/n |
n |
R2 |
|
Бентонит, модифицированный глицерином и углеродными нанотрубками |
|
5,689 |
1,475 |
0,866 |
|
Бентонит, модифицированный углеродными нанотрубками |
|
3,873 |
1,412 |
0,837 |
|
Немодифицированный бентонит |
|
9,550 |
1,488 |
0,899 |
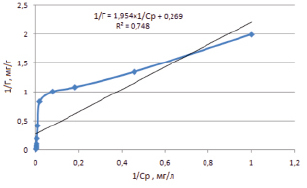
Рис. 3. Изотерма адсорбции о-фенилендиамина на бентоните, модифицированном углеродными нанотрубками, в линеаризованной по Ленгмюру форме
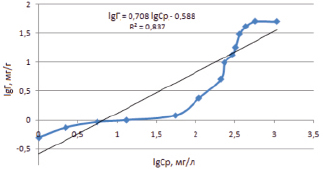
Рис. 4. Изотерма адсорбции о-фенилендиамина на бентоните, модифицированном углеродными нанотрубками, в линеаризованной по Фрейндлиху форме
Выводы
1. Преобладание модели Фрейндлиха в случае адсорбции о-фенилендиамина на указанных немодифицированном и модифицированных бентонитах свидетельствует о том, что преимущественно формируются смешанные слои «адсорбент – адсорбат».
2. Бентонит, модифицированный углеродными нанотрубками, при адсорбции указанного ароматического амина в наилучшей степени формирует смешанные слои адсорбент – адсорбат, что объясняется высоким взаимодействием его адсорбционных центров с указанным адсорбатом.
3. Добавка глицерина к бентониту, модифицированному углеродными нанотрубками, несколько снижает эффективность взаимодействия адсорбата с алюмосиликатом и нанотрубками, что может объясняться собственной адсорбцией глицерина на компонентах адсорбента и сокращением количества адсорбционных центров.
Описанные исследования проводились в рамках Госзадания Минобрнауки РФ на выполнение НИР «Разработка экологически чистых энергосберегающих технологий комплексной очистки вод, загрязненных в результате природных и техногенных чрезвычайных ситуаций, для станций локальной водоподготовки в проблемных регионах Российской Федерации» (Проект 5.3922. 2017/ПЧ).




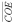 ,
,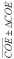 ,
,
 ,
,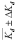 ,
,
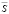 , %
, %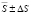 , %
, %