Раздел «химические и электрохимические процессы в растворах» лабораторного практикума по курсу химии для бакалавров технических специальностей может быть дополнен работой по изучению процесса электрохлорирования, содержащей элементы научного исследования – научно-исследовательский кейс, ориентированный на включение обучающегося в исследовательскую деятельность [1, 2]. Такую работу целесообразно проводить в завершение практикума по электрохимии после освоения лекционного материала и выполнения соответствующего домашнего задания [3–5]. Уровень усвоения материала повышается при использовании алгоритмического метода [6]. Электролиз раствора хлорида натрия проводили в бездиафрагменной ячейке, получали раствор гипохлорита натрия низкой концентрации и определяли концентрацию «активного хлора». Раствор гипохлорита натрия широко используется в качестве дезинфицирующего и отбеливающего средства. Важно, что при концентрации менее 1 % он является неопасным реагентом (ТУ 6-01-29-93, марка Э), поэтому его использование в лабораторном практикуме не требует принятия дополнительных мер безопасности. Для получения электролитического гипохлорита натрия используют хорошо отработанный процесс, основанный на одновременном получении хлора и гидроксида натрия и их взаимодействии в бездиафрагменном электролизере. Относительные скорости выделения хлора и кислорода на аноде и водорода на катоде зависят от материала электродов, pH электролита, концентрации хлорида натрия, плотности тока и температуры процесса. Так как целью эксперимента являлось получение низкоконцентрированного раствора гипохлорита, использовались растворы хлорида натрия невысокой концентрации. В то же время, при переходе к сильно разбавленным растворам вместе с хлором, выделяющимся на аноде, начинает образовываться все более заметное количество кислорода [7]. Этим продиктовано использование растворов с концентрацией 25 и 35 г/л. По мере накопления в растворе гипохлорите натрия электрохимическое и химическое разложение гипохлорита до хлората становится все заметнее. Известно, что выход по току уменьшается из-за потерь на катодное восстановление и электрохимическое анодное окисление гипохлорита пропорционально росту его концентрации, обратно пропорционально плотности тока и падает примерно на 2 % при повышении температуры на 1 °С [8]. Следовательно, для протекания основного процесса при минимуме побочных реакций оптимально проводить электролиз нейтральных растворов хлорида натрия при возможно более низкой температуре и ограничиваться невысокими концентрациями продукта – гипохлорита натрия. Рассмотрим более подробно влияние на выход гипохлорита плотности по току: при очень малых значениях на аноде выделяется кислород, затем, при достижении равновесного потенциала, начинается совместное выделение кислорода и хлора. С ростом плотности по току выход хлора быстро возрастает, и при 0,1 А/см2 доля электричества, пошедшая на выделение кислорода, составляет лишь несколько процентов [8]. По данным [9] зависимость выхода по току «активного хлора» от плотности тока имеет максимум в области от 0,1 до 0,2 А/см2. Таким образом, оптимальным представляется значение 0,1 А/см2. Оптимальная продолжительность процесса с точки зрения расхода электроэнергии не должна превышать 15–17 минут [10].
Целью исследования являлась оптимизация параметров электрохлорирования и апробация методики определения активного хлора в условиях студенческого практикума по химии.
Материалы и методы исследования
При проведении работы использовалась одна установка электрохлорирования на группу, размещенная в вытяжном шкафу и состоящая из стеклянной электролитической ячейки объемом 1 л, тефлоновой крышки, соединенной со стеклянным цилиндром, образующим гидравлический затвор, и приборов для проведения электрохимического процесса и контроля за его параметрами (рис. 1). Четыре титановых электрода 6х10 см с окисно-рутениевыми анодами располагали на расстоянии в 1 мм и проводили процесс при плотности тока 0,1 А/см2 [11–13]. Дополнительно к газлифту реакционную смесь перемешивали магнитной мешалкой, расположенной на дне ячейки. В качестве источника тока использовали потенциостат-гальваностат Elins Р-150Х. Раствор хлорида натрия готовили из дистиллированной воды и хлорида натрия квалификации «х.ч.». Концентрацию активного хлора определяли по ГОСТ 18190-72 титрованием метиловым оранжевым (пара-диметиламиноазобензолсульфокислый натрий) квалификации «ч.д.а.» [14].
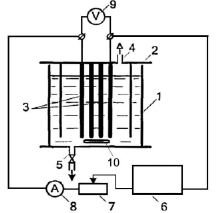
Рис. 1. Электролизная установка. 1 – корпус электролитической ячейки, 2 – крышка, 3 – электроды 6х10 см, 4 – газоотвод, 5 – дистанционно управляемый пробоотборный кран, 6 – блок питания, 7 – реостат, 8 – амперметр, 9 – вольтметр, 10 – магнитная мешалка
Раствор для электролиза предварительно охлаждали до 7 °C. Электрохлорирование осуществляли в непроточном режиме с периодическим отбором проб реакционной смеси по 10 мл через равные промежутки времени. Общее время электролиза не превышало 20 мин, благодаря чему итоговая концентрация «активного хлора» не превышала 1 %. Для построения графика экспериментальной зависимости через равные промежутки времени отбирали четыре пробы по 10 мл реакционного раствора, помещали их в мерные колбы на 250 мл, добавляли избыток 5 н. раствора соляной кислоты и доливали дистиллированную воду до метки. Затем из каждой мерной колбы отбирали по 20 мл в три конические колбы для титрования и определяли концентрацию «активного хлора».
Термин «активный хлор» обозначает весь объем хлора, образующийся при воздействии на реакционную смесь избытка соляной кислоты:
NaClO + HCl → Cl2↑ + NaCl,
HClO + HCl → Cl2↑ + H2O.
Для его определения использовали то, что окислительный потенциал хлора достаточен для разрушения метилового оранжевого, в результате чего при титровании раствора хлора метиловый оранжевый обесцвечивается – «метод определения свободного остаточного хлора титрованием метиловым оранжевым» [14]. Раствор 0,005 % метилового оранжевого в дистиллированной воде (25 мг на 1 л дистиллированной воды) помещали в микробюретку на 5 мл и титровали им 20 мл анализируемого раствора до появления неисчезающей розовой окраски. Содержание свободного остаточного хлора вычисляли по формуле
X = (0,04 + 217a)/V,
где a – объем раствора метилового оранжевого, пошедший на титрование, мл; V – объем взятой реакционной смеси, в нашем случае 10 мл; 0,04 – эмпирический коэффициент, 0,0214 – титр метилового оранжевого. Далее строили график в координатах концентрация «активного хлора» – время электрохлорирования и объясняли вид зависимости.
Результаты исследования и их обсуждение
На вид зависимости концентрации «активного хлора» от времени влияет концентрация исходного раствора хлорида натрия и значение плотности по току (рис. 2).
При концентрации 25 г/л и плотности по току 0,1 А/см2 побочные процессы протекают в небольшой степени и зависимость практически линейная. На аноде в основном образуется хлор, на катоде происходит разложение молекул воды с образованием водорода и гидроксил-ионов.
2Cl-- 2e- → Cl2,
2H2O + 2e- → H2 + 2OH-.
Выделяющийся хлор растворяется и диспропорционирует с образованием хлорноватистой и хлороводородной кислот:
Cl2 + 2H2O ↔ HClO + HCl.
Благодаря интенсивному перемешиванию электролита в межэлектродном пространстве образующиеся на катоде при восстановлении воды гидроксил-ионы нейтрализуют эти кислоты с образованием гипохлорита и хлорида натрия.
Суммарное уравнение электролиза:
Cl- + H2O → H2 + ClO-.
При плотности по току 0,125 и 0,15 А/см2 наблюдается отклонение зависимости концентрации «активного хлора» от времени электролиза от линейной и появляется участок на котором концентрация возрастает медленнее из-за протекания побочных процессов электрохимического восстановления гипохлорита натрия, находящегося в прямой зависимости от интенсивности перемешивания:
ClO- + H2O + 2e- → Cl- + 2 OH-,
и побочного процесса электрохимического окисления гипохлорита, усиливающегося из-за локальных перегревов:
6ClO- + 3H2O – 6e- → 2ClO3- + 4 Cl- + 1,5O2 + 6H+,
а также процесса химического образования хлората:
2HClO + ClO- → ClO3- + 2Cl- + 2H+.
Также на зависимости pH реакционной смеси от времени видны три участка: практически линейное возрастание pH на первом, область перегиба и практически линейный третий участок постоянных значений водородного показателя. Второму участку соответствует область нелинейности на графике зависимости концентрации «активного хлора» от времени.
Выбор плотности по току зависит от цели лабораторной работы. Если изучению подлежит основной химизм процесса, оптимальной представляется плотность по току 0,1 А/см2, при которой влияние побочных процессов невелико, если же предполагается исследовать влияние побочных процессов на выход гипохлорита, следует использовать более высокие значения плотности по току. Вид зависимости при концентрации 35 г/л и плотности по току 0,1 А/см2 сходен с видом кривой, соответствующей концентрации 25 г/л и 0,15 А/см2.
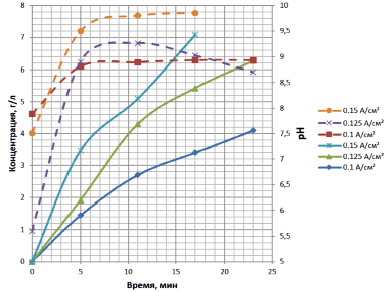
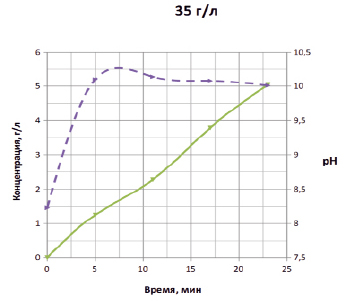
Рис. 2. Зависимость pH (правая шкала, пунктирные кривые) и концентрации активного хлора в г/л (левая шкала, сплошные) от времени электрохлорирования для плотностей тока 0,15; 0,125; 0,1 А/см2 и концентрации раствора хлорида натрия 25 г/л (верхний рисунок) и плотности тока 0,1 А/см2 и концентрации 35 г/л (нижний рисунок)
Выводы
Было апробировано использование процесса электрохлорирования для изучения основных закономерностей процесса электролиза в лабораторном практикуме по химии для студентов вузов. Показано, что при концентрации исходного раствора хлорида натрия 25 г/л и плотности по току 0,1 А/см2 процесс протекает с небольшими побочными реакциями, итоговая зависимость концентрации «активного хлора» от времени электрохлорирования получатся практически линейной. При более высокой плотности по току или при концентрации 35 г/л становятся заметны побочные процессы. Это позволяет проводить работу в двух вариантах. В первом, при плотности по току 0,1 А/см2, изучается химизм основного процесса синтеза гипохлорита натрия электролизом хлорида в бездиафрагменной ячейке и основные реакции, протекающие на электродах. При более высокой плотности по току дополнительно изучается влияние побочных процессов, приводящих к снижению выхода по току целевого продукта и к нелинейному виду зависимости концентрации «активного хлора» от времени. Для построения зависимости применена гостированная методика определения содержания «активного хлора» титрованием метиловым оранжевым. В работе использованы доступные и недорогие реагенты, имеющиеся в каждом лабораторном практикуме: хлорид натрия, соляная кислота, метиловый оранжевый. Процесс электрохлорирования сопровождается образованием газообразного хлора, большая часть которого поглощается реакционным раствором и превращается в гипохлорит, а часть выделяется через газоотводную трубку, поэтому установка должна располагаться в вытяжном шкафу. В целях безопасности отбор проб из реакционного объема осуществлялся при помощи дистанционно управляемого крана, расположенного в нижней части ячейки. Это позволяет держать тягу закрытой и избегать попадания отходящих газов в воздух лаборатории. Концентрация гипохлорита натрия в реакционной смеси не превышала 0,8 %, что в соответствии с ТУ 6-01-29-93 марка Э классифицирует его как неопасный реагент. Кроме того, перед титриметрическим определением раствор дополнительно разбавляли в 25 раз. Освоение предлагаемой работы поможет сформировать способность и готовность осуществлять технологический процесс в соответствии с регламентом и использовать технические средства для измерения основных параметров технологического процесса и продукции; выработать умение использовать теорию электрохимических процессов для оптимизации основных параметров электрохимических технологических процессов.



