При переработке рудничных вод методом флотации важным аспектом является количественное селективное извлечение наиболее ценных компонентов доступными нетоксичными реагентами-собирателями, прогнозирование активности которых целесообразно и перспективно осуществлять на основе принципа «структура/свойство – активность/свойство» [1]. Применительно к флотационным системам этот принцип можно сформулировать следующим образом: молекулярные структуры соединений реагентов содержат активные реакционные центры по отношению к извлекаемым компонентам (субстратам), структура и свойства которых усиливают избирательное действие применяемых реагентов и обеспечивают получение прочных соединений «субстрат-реагент» во флотационных системах [1, 2].
Кроме того, благодаря развитию А.В. Курковым и И.И. Пастуховой теории флотации как предмета супрамолекулярной химии [3], появилась возможность моделировать извлекающие агенты для обеспечения устойчивого самоорганизации (самосборки)молекул реагентов с активными центрами поверхности извлекаемых минералов.
Цель исследования – изучить прогнозный подход к выбору реагентов для выделения и концентрирования ценных компонентов Zn, Cu (II) из рудничных вод горно-обогатительных комбинатов в сублат на основе принципа «активность/свойство – структура/свойство».
Материалы и методы исследования
Для расширения ассортимента реагентов ионной флотации в работе проведён анализ квантово-химических и физико-химических дескрипторов известных и перспективных реагентов-собирателей с целью выявления критериев, обеспечивающих их высокую активность и селективность по отношению к извлекаемым катионам металлов – субстратам в процессе флотации.
Прогнозный подход к изысканию новых реагентов для ионной флотации меди (II) и цинка на основе принципа «структура/свойство – активность/свойство» может быть реализован как квантово-химический подход. Квантово-химические расчеты проводились с помощью программного продукта ChemCraft. Примеры выполнения квантово-химических расчётов по базовым и дополнительным дескрипторам при выборе регентов-собирателей, прогнозировании их свойств рассмотрены в работах [1, 2].
Для экспериментального подтверждения флотационной активности выбранных реагентов для выделения и концентрирования меди (II) и цинка на основе принципа «структура/свойство – активность/свойство» была проведена серия флотационных опытов на модельных растворах. Состав модельных растворов был максимально приближен к реальным техногенным водам горных предприятий Южного Урала, с исходным содержанием цинка не менее 180 мг/дм3 и меди в пределах 250 мг/дм3. Время проведения ионной флотации составило 10 мин, расход реагентов соответствовал 0,75 мг/дм3.
Количественная оценка эффективности действия реагентов для напорной флотации цинка и меди (II) на основе принципа «активность/свойство – структура/свойство» [4] проводилась по параметру нуклеофильности IN‾ (эВ), характеризующего реакционную активность и свойства реагентов по отношению к извлекаемым субстратам; по показателю устойчивости системы «металл-реагент» значениям степени переноса заряда ΔN и извлечению катионов цинка и меди (II) в сублат εМе, %, показывающим структурную стабильность флотационных систем Zn-реагент, Cu-реагент и селективные свойства реагента.
Результаты исследования и их обсуждение
В практике ионной флотации катионов цветных металлов используются реагенты-собиратели, у которых извлекающий агент представлен в анионном виде или проявляет хелатообразующую способность по отношению к переходным металлам. В качестве извлекающих агентов для выделения меди (II) и цинка из растворов нашли применение анионные поверхностно-активные соединения: соли высших карбоновых кислот, сульфонолы, соли ксантогеновой кислоты, производные дитиокарбаминовой кислоты и комплексообразователи: диацилгидразины и алкилгликольтерефталаты. Авторами были проанализированы свыше 180 соединений анионных ПАВ и перспективных комплексообразователей.
В таблице показаны расчёты квантово-химических и физико-химических дескрипторов флотационных систем Zn-реагент и Cu-реагент, в которых в качестве анионных ПАВ солей высших карбоновых кислот представлен пальмитат калия, алкилбензолсульфонатов – линейный додецилбензолсульфонат калия, солей ксантогеновых кислот – этилксантогенат калия, производных диэтилдитиокарбаминовой кислоты – диэтилдитиокарбамат, а диацилгидразин и (ди)этилгликольтерефталат – в роли перспективных комплексообразователей [2, 5–11].
Результаты исследований показали, что с увеличением показателя степени переноса заряда в молекуле «металл-реагент»увеличивается устойчивость, образующихся флотационных структур, возрастает выделение и концентрирование полезных металлов в сублат.
Согласно полученным результатам во флотационных системах катионы меди по сравнению с катионами цинка более реакционно активны, что может быть обусловлено особыми свойствами цинка, относящегося к диамагнетикам с закрытой электронной оболочкой. Так, этилксантогенат калия с цинком (IN¯ = 1,013 эВ-1) образует при ионной флотации субстрат – реагент менее прочные флотационные системы Zn-этилксантогенат (ΔN = 0,616) по сравнению с Cu-этилксантогенат (ΔN = 0,775), при этом извлечение цинка этилксантогенатом доходит до εZn = 93,28 %, а меди до 97,15 %. Этилксантогенат калия по отношению к субстратам меди проявляет большую реакционную способность, о чём свидетельствует показатель нуклеофильности IN¯(Cu) = 1,182 эВ–1 и образование устойчивой флотационной системы Cu-реагент > Cu-этилксантогенат более термодинамически выгоднее, согласно значениям энергии комплексообразования – 119,64 ккал/моль, чем Zn – реагент → Zn-этилксантогенат – 98,45 ккал/моль.
Пальмитат калия проявляет наименьшую нуклеофильность (IN¯(Zn) = 1,005 эВ, IN¯(Cu) = 1,008 эВ) по сравнению с другими реагентами, что в конечном итоге отражается на извлечении катионов металлов в сублат: εZn = 92,37 % и εCu = 93,45 %. Структурные свойства, образующихся флотационных систем Zn-пальмитат и Cu-пальмитат, характеризуются низкой по сравнению с другими системами конформационной устойчивостью ΔN(Zn) = 0,523, ΔN(Cu) = 0,549 и термодинамической стабильностью ΔEкомп(Zn) = –91,72 ккал/моль, ΔEкомп(Cu) равной –91,72 ккал/моль.
Обращает на себя внимание флотационная структура «Zn-додецилбензолсульфонат», показывающая высокие значения степени переноса заряда (0,681) и энергии комплексообразования в пределах 101,06 ккал/моль и, как следствие, высоким показателем по извлечению цинкового субстрата в сублат εZn = 95,10 %. Молекулы линейного алкилбензолсульфоната по отношению к Zn проявляют хорошую реакционную активность не менее 1,021. Выделение и концентрирование катионов металлов из рудничных вод с использованием додецилбензолсульфоната натрия достигает 95,1–95,52 %, что может быть обусловлено наличием в его структуре с позиции теории «жёстких и мягких кислот и оснований Льюиса» промежуточных основных групп SO42- и кислотных – С6Н5+ [12].
При взаимодействии 1,2-диацилгидразина с цинком и медью (II) в растворах образуются флотационные системы Zn-диацилгидразин и Cu-диацилгидразин, квантово-химические и физико-химические характеристики которых для цинка и меди составляют соответственно, IN¯(Zn) = 1,012, ΔN(Zn) = 0,545, ΔEкомп(Zn) = –91,72 ккал/моль, εZn = 93,03 % и IN¯(Cu) = 1,133, ΔN(Cu) = 0,686, ΔEкомп(Cu) = –123,30 ккал/моль, εCu = 96,06 %. Таким образом, можно заключить, что реагент-собиратель 1,2-диацилгидразин проявляет селективные свойства по отношению и к субстратам цинка и к субстратам меди.
Согласно проведённым исследованиям, самые высокие результаты квантово-химических и физико-химических дескрипторов получены при флотации меди (II) с использованием производных дитиокарбаминовой кислоты – диэтилдитиокарбамата натрия: IN¯(Cu) = 1,201, ΔN(Cu) = 0,787, ΔEкомп = –141,09 и εCu = 98,56 % и производных гликолевых эфиров терефталевой кислоты – диэтиленгликольтерефталата IN¯(Cu) = 1,161, ΔN (Cu) = 0,695, ΔEкомп = –339,11 и εCu = 98,20 %.
Таким образом, анализ квантово-химических и физико-химических дескрипторов известных и перспективных реагентов-собирателей позволяет обосновать комплекс критериев селективности реагентов по отношению к цинку параметрнуклеофильность и IN ≥ 1 эВ-1, степень переноса заряда ΔN > 0,5, энергия комплексообразования ΔEкомп > 100 ккал/моль, извлечение системы «цинк – реагент» в сублат должно быть не менее 93 % и меди – нуклеофильность IN ≥ 1,1 эВ-1, степень переноса заряда ΔN > 0,6, энергия комплексообразования ΔEкомп > 100 ккал/моль, извлечение системы «медь – реагент» в сублат не менее 95 %.
Следует обратить внимание на перспективный класс органических соединений – гликолевые эфиры терефталевой кислоты, которые способны селективно при рН 2 извлекать цинк в сублат Zn-этиленгликольтерефталат, а медь (II) при рН 8 в сублат Cu-диэтиленгликольтерефталат (таблица). Соединения данного класса входят в состав реагента комплексного действия РОЛ [2], который хорошо зарекомендовал себя при флотационном извлечении цинка и меди из техногенных вод горных предприятий. Поэтому представляется целесообразным проанализировать квантово-химические и физико-химические дескрипторы и других сложных эфиров (тере)фталевой кислоты на предмет прогнозного подхода к выбору новых реагентов на основе принципа «структура/свойство – активность/свойство».
Квантово-химические и физико-химические дескрипторы флотационных систем Zn-реагент и Cu-реагент
|
Zn-реагент |
IN¯, эВ-1 |
ΔN |
ΔEкомп, ккал/моль |
εZn, % |
|
Zn-додецилбензолсульфонат |
1,021 |
0,681 |
– 101,06 |
95,10 |
|
Zn-пальмитат |
1,005 |
0,523 |
– 76,06 |
92,37 |
|
Zn-этилксантогенат |
1,013 |
0,616 |
– 98,45 |
93,28 |
|
Zn-диэтилдитиокарбамат |
1,019 |
0,630 |
– 117,98 |
94,58 |
|
Zn-диацилгидразин |
1,012 |
0,545 |
– 99,81 |
93,03 |
|
Zn-этиленгликольтерефталат |
1,019 |
0,633 |
– 159,18 |
94,86 |
|
Cu-реагент |
IN¯, эВ– 1 |
ΔN |
ΔEкомп, ккал/моль |
εCu, % |
|
Cu-додецилбензолсульфонат |
1,022 |
0,692 |
– 104,92 |
95,52 |
|
Cu-пальмитат |
1,008 |
0,549 |
– 91,72 |
93,45 |
|
Cu-этилксантогенат |
1,182 |
0,775 |
– 119,64 |
97,15 |
|
Cu-диэтилдитиокарбамат |
1,201 |
0,787 |
– 141,09 |
98,56 |
|
Cu-диацилгидразин |
1,133 |
0,686 |
– 123,30 |
96,06 |
|
Cu-диэтиленгликольтерефталат |
1,161 |
0,695 |
– 339,11 |
98,20 |
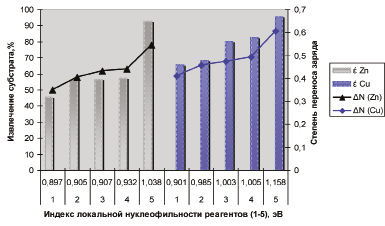
Зависимость извлечения субстратов меди (II), цинка и степени переноса заряда, образующихся флотационных систем «субстрат-реагент» от параметра нуклеофильности производных сложных эфиров (тере)фталевой кислоты: 1 – диоктилфталат, 2 – диметилтерефталат, 3 – диэтилтерефталат, 4 – дибутилтерефталат, 5 – бис-(4-гидроксибутил)терефталат
На рисунке представлена зависимость извлечения меди (II), цинка и степени переноса заряда, образующихся флотационных систем «субстрат-реагент» от параметра нуклеофильности некоторых сложных эфиров (тере)фталевой кислоты: диоктилфталата, диметилтерефталата, диэтилтерефталата, дибутилтерефталата и бис-(4-гидроксибутил)терефталат.
Согласно полученным данным из приведённых реагентов высокие показатели селективности проявляют сложные эфиры бис-(4-гидроксибутил)терефталат, которые и можно отнести к перспективным реагентам, характеризующимся оптимальным набором квантово-химических и физико-химических дескрипторов флотационных систем Zn-бис-(4-гидроксибутил)терефталат, которые показывают значения IN¯(Zn) = 1,038, ΔN(Zn) = 0,547, ΔEкомп(Zn) = –102,13 и εZn = 93,05 % и Cu-бис-(4-гидроксибутил)терефталат соответственно IN¯(Cu) = 1,158, ΔN(Cu) = 0,607, ΔEкомп(Cu) = –219,08 и εCu = 95,76 %.
Сложные эфиры ряда диметилтерефталат → диэтилтерефталат → дибутилтерефталат с ростом нуклеофильности показывают увеличение конформационной устойчивости (ΔN) систем «субстрат – реагент» и извлечения в сублат, однако значения IN¯(Zn), ΔN(Zn), εZn и IN¯(Cu), ΔN(Cu), εCuu ниже выявленных критериев селективности реагентов.
Заключение
В данной работе представлен прогнозный подбор к выбору селективных реагентов для выделения и концентрирования катионов цинка и меди (II) методом напорной флотации из рудничных вод горно-обогатительных комбинатов и разработке новых флотореагентов на основе принципа «структура/свойство – активность/свойство» с учётом комплекса критериев системы «субстрат – реагент», включающего оптимальные квантово-химические и физико-химические дескрипторы:
– комплекс критериев селективности реагентов по отношению к цинку должен соответствовать параметру нуклеофильности IN ≥1 эВ-1, степени переноса заряда ΔN > 0,5, энергии комплексообразования ΔEкомп > 100 ккал/моль при условии, что извлечение системы «цинк – реагент» в сублат должно быть не менее 93 %;
– комплекс критериев селективности реагентов по отношению к меди должен отвечать показателю нуклеофильности IN ≥ 1,1 эВ-1, степени переноса заряда ΔN > 0,6, энергии комплексообразования ΔEкомп > 100 ккал/моль и извлечению системы «медь – реагент» в сублат не менее 95 %;
– для эффективного выделения и концентрирования ионов Zn и Cu (II) из рудничных вод горно-обогатительных комбинатов предложено использовать сложные эфиры – бис-(4-гидроксибутил)терефталата.



