Ферриты и хромиты переходных элементов являются объектом интенсивного изучения благодаря удачному сочетанию важных технологических свойств. Они могут быть использованы как магнитные и диэлектрические материалы, фотокатализаторы, датчики и сенсоры, адсорбенты, электроды для литий-ионных аккумуляторов, керамические пигменты.
Несмотря на активно развивающееся направление синтеза наноструктурированных материалов, для получения твердых материалов со структурой шпинели по-прежнему широко используют классическую керамическую технологию [1]. Она позволяет получать материалы контролируемого химического состава без выброса вредных побочных продуктов процесса. Одним из существенных недостатков керамической технологии является длительность производственного цикла и необходимость применения высоких температур термообработки, что приводит к увеличению расходов на получение материалов.
В этой связи разработка научных основ экологичного способа получения ферритов и хромитов переходных элементов со структурой шпинели при пониженной температуре термообработки с меньшей продолжительностью является актуальной задачей химической технологии неорганических веществ.
Для получения шпинелей по классическому способу обычно используют оксиды, соли и гидроксиды соответствующих металлов. В двух последних случаях исходные вещества после соответствующей обработки переводят в форму оксидов. Далее образование структуры происходит по схожему механизму для всех перечисленных соединений. Реализуют производство по керамической технологии двумя способами:
1) смешиванием оксидов соответствующих металлов, брикетированием и последующим обжигом смеси при температуре 800–1650 °С в течение 50-300 часов [2, 3];
2) смешиванием оксидов соответствующих металлов, предварительным обжигом при температуре 750–900 °С в течение 3–5 часов, размолом, брикетированием и спеканием при температуре 900–1200 °С в течение 3–5 часов [4].
Так, ферриты и хромиты состава NiFe2-xCrxO4 могут быть получены: при 1400 °С в течение 7 часов [5]; при 1200 °С в течение 90 часов [6]; синтез проводили при температуре 1200 °С в течение 60 часов [7]. В [7–9] приводят сведения о синтезе твердых растворов состава ZnFe2-xCrxO4: 900 °С в течение 120 часов [8, 9] и при 1100 °С в течение 7 суток [7]. Шпинели состава CoFe2-xCrxO4 получали при 900 °С в течение 400 часов [9] и при 1200 °С в течение 70 часов [7]. Широкий разброс данных по синтезу отдельных составов ферритов и хромитов переходных элементов по керамической технологии может быть связан с различным гранулометрическим составом исходных порошков оксидов, а также различными условиями брикетирования шихты.
Как видно из приведенных выше данных, синтез шпинелей по такому способу проходит при высоких температурах и требует длительной термообработки. Из наиболее распространенных методов, повышающих интенсивность процесса образования шпинелей, следует отметить такие, как введение в состав шихты малых количеств добавок, образующих газовую фазу; использование в процессе солей галогенидов; выращивание шпинелей из высокотемпературных растворов-расплавов; горячее прессование тонких порошков; гидротермальное воздействие, использование в процессе шпинелеобразования окислительно-восстановительных реакций, введение органических прекурсоров и др.
Наиболее доступным способом достижения такого результата является введение в состав шихты галогенида щелочного металла. Целью настоящего исследования являлось изучение влияния добавки ряда галогенидов щелочных металлов на процесс формирования структуры ферритов и хромитов переходных элементов и выбор оптимальных технологических режимов производства шпинелей.
Материалы и методы исследования
Для синтеза образцов ферритов и хромитов никеля (II), цинка были использованы оксиды никеля (II), цинка, хрома (III) марки «хч», железа (III) марки «для ферритов». В качестве минерализатора использовали галогениды щелочных металлов (NaCl, KCl, NaBr, KBr, NaF) в количестве 1 % (мас.).
Рентгенофазовый анализ (РФА) образцов проводили на аппарате Thermo Scientific ARLX’TRA Powder Diffractometer, использовали монохроматизированное Cu Kα-излучение, методом сканирования по точкам (шаг 0,01 °, время накопления в точке 2 с) в интервале значений 2θ от 5 ° до 85 °. Определение качественного фазового состава осуществляли с помощью PDF-2 в программном комплексе Crystallographica в Центре коллективного пользования (ЦКП) «Нанотехнологии» Южно-Российского государственного политехнического университета (НПИ) имени М.И. Платова; на рентгеновском дифрактометре STOE IPDS II на базе Технического университета, г. Дрезден, Германия (использовали Cu-Kα излучение).
При анализе количественного соотношения между фазами использовали зависимость
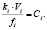
Здесь ki – коэффициент, учитывающий вклад интенсивности i-й линии в интегральную интенсивность линий, характеризующих данную фазу; Vi – объем элементарной ячейки i-й фазы, fi – атомный фактор рассеяния i-й фазы, Ci – относительная концентрация.
Результаты исследования и их обсуждение
Синтез ряда ферритов и хромитов (NiFe2O4, NiCr2O4, ZnFe2O4, ZnCr2O4, CoFe2O4) осуществляли по керамической технологии из оксидов переходных элементов ZnO, NiO, CoO, Cr2O3 марки «хч», Fe2O3 марки «для ферритов». В качестве добавки использовали галогениды щелочных металлов (NaCl, KCl, NaBr, KBr, NaF) в количестве 1 % (мас.). Исходные оксиды и введенный минерализатор гомогенизировали в агатовой ступке в течение часа. Полученную смесь прессовали в таблетки под давлением 15 МПа и подвергали термообработке в течение 0,5–5 часов при различных температурах.
По окончании реакции добавку минерализатора удаляли промыванием в деионизированной воде.
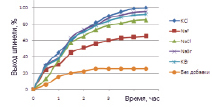
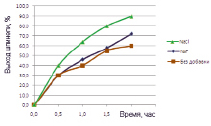
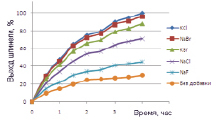
На рис. 1 приведены данные изучения действия добавки галогенидов щелочных металлов на процесс формирования структуры шпинели ряда составов. Термообработку проводили при 800 °С.
Согласно полученным результатам, наиболее полно проходит формирование целевого продукта – шпинели – в присутствии хлорида калия и бромидов калия и натрия.
Для определения оптимальной продолжительности термообработки был проведен ряд эксприментов, результаты которых представлены в таблице. В качестве добавки использовали хлорид калия.
 а
а 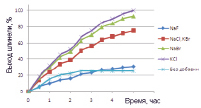 б
б
 в
в 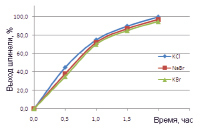 г
г
 д
д
Рис. 1. Количество образовавшейся шпинели в зависимости от введенной модифицирующей добавки: а – NiFe2O4 , б – NiCr2O4 , в, г – ZnFe2O4 , д – ZnCr2O4
Продолжительность термообработки для полного формирования структуры шпинели
|
Состав шпинели |
Продолжительность термообработки, час при температуре, °С |
|||
|
700 |
800 |
900 |
1000 |
|
|
ZnFe2O4 |
3,5 |
2 |
1 |
– |
|
ZnCr2O4 |
5 |
4 |
2 |
– |
|
NiFe2O4 |
– |
4,5 |
3 |
1,5 |
|
NiCr2O4 |
– |
5 |
4 |
2 |
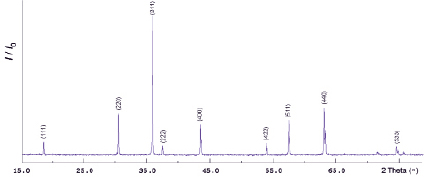
Рис. 2. Рентгенограмма образца феррита кобальта (II)
Как видно из представленных (рис. 1) результатов исследования, синтез ферритов и хромитов переходных элементов с существенным сокращением производственного цикла может быть осуществлен в присутствии 1 % (мас.) минерализатора – хлорида калия, бромида калия или бромида натрия. Увеличение скорости реакции шпинелеобразования отмечено для ферритов цинка и никеля (II) в 1,4–4,5 раза, для хромитов – в 2,2–4,4 раза.
С целью подбора более экономичного минерализатора опробован синтез в присутствии смеси 50 %KCl + 50 %NaCl, которая образует легкоплавкую эвтектику при температуре 650 °С, что может положительно влиять на скорость процесса формирования структуры. Проведение процесса в заданных условиях сопровождается формированием структуры шпинели, как и в случае добавки чисто хлорида калия.
В результате проведенных экспериментальных исследований по выбору минерализатора и определения технологических параметров процесса можно сделать следующее заключение. Для полного проведения процессов формирования структуры для всех изученных составов требуется не более 5 часов; оптимальная температура термообработки – 800–900 °С, минерализатор – NaBr, KBr, KCl. Из ряда рекомендованных галогенидов щелочных металлов хлорид калия является наиболее дешевым (его стоимость ниже стоимости бромидов натрия и калия в 3–5 раз). В этой связи дальнейшие исследования проводили с добавкой KCl как наиболее экономически целесообразного, экологически безопасного (калий – макроэлемент) вещества.
С целью проверки выявленных закономерностей был осуществлен синтез феррита кобальта (II) по описанной выше технологии в присутствии 1 % (мас.) хлорида калия. Термообработку проводили при температуре 800 °С в течение 5 часов. На рис. 2 представлен фрагмент дифрактограммы полученного материала, пики соответствуют CoFe2O4 (Cobalt Iron Oxide, PDF Number 000-03-0864, параметр элементарной кубической ячейки a = 0,8377 нм), На рис. 3 приведена микрофотография образца. Как видно из представленных рисунков, в условиях эксперимента формируется структура шпинели с хорошо окристаллизованными зернами.

Рис. 3. Микрофотография феррита кобальта (II)
Интенсификацию шпинелеобразования ряд авторов [10, 11] связывает с участием в процессе газовой фазы. Так, в [11] был предложен механизм формирования фазы шпинели в присутствии галогенидов:
KCl (т) = KCl (г),
2KCl (г) + ZnO (т) = ZnCl2 (г) + K2O (т),
ZnCl2 (г) + Fе2О3 (т) + H2O (г) = = ZnFe2O4 (т) + 2HCl (г),
2HCl (г) + ZnO (т) = ZnCl2 (г) + H2O (г).
Одним из возможных факторов ускорения процесса формирования структуры может выступать расплав галогенида металла. Подобный эффект был отмечен ранее [12, 13] в процессе синтеза в системе NiO-CuO-Fe2O3-Cr2O3 в присутствии KCl.
В пользу высказанного предположения может выступать тот факт, что существенное увеличение скорости реакции отмечено в присутствии только части введенных галогенидов (хлорида калия, бромида калия и натрия, эквимолярной смеси хлоридов калия и натрия). Все перечисленные выше галогениды и их смесь имеют температуру плавления ниже, чем температура проведения реакции. Для хлорида и фторида натрия, имеющих температуры плавления выше температурных условий процесса, эффект от введенной добавки был заметно слабее (рис. 1).
Если исходить из предположения, что в реакции будет принимать участие расплав хлорида калия, формирование структуры может протекать по следующему механизму. При повышении температуры образуется микрорасплав галогенида щелочного металла, смачивающий поверхность зерна. В расплаве образуются полярные ионы металла и галогена, которые за счет действия сил электростатического притяжения облегчают отрыв катиона переходного металла из решетки исходного оксида и перенос его в реакционную зону. Различия в количественном факторе влияния введенной добавки могут быть объяснены различной энергией связи «катион-кислород» в кристаллической решетке исходного оксида.
При введении в исходную шихту 1 % хлорида калия были синтезированы шпинели состава NiFe2-xCrxO4, CuFe2-xCrxO4, CoFe2-xCrxO4, ZnFe2-xCrxO4, Cu1-xNixCr2O4, NiFe2O4 – NiCr2O4 – CuCr2O4, CuxNiyFe1-x-yCr2O4 [14]. Установлено, что введение добавки хлорида калия позволяет увеличить скорость процесса образования шпинелей в 15–100 раз.
Выводы
1. Проведено комплексное изучение процесса формирования структуры шпинели ряда ферритов и хромитов переходных элементов в ходе топохимического процесса с введением добавок хлорида, бромида калия и натрия, фторида натрия. Показано, что введение галогенида щелочного металла приводит к существенному ускорению реакции шпинелеобразования.
2. Показано, что наиболее выраженное ускоряющее действие на процесс формирования структуры шпинели оказывают хлорид калия, бромиды калия и натрия. Введение фторида и хлорида натрия не приводит к полному формированию структуры в изученных условиях. Высказано предположение о существенной роли микрорасплава галогенида щелочного металла в механизме формирования структуры.
3. Определены экспериментально значения температуры термообработки, продолжительности синтеза целевого продукта. Предложенные технологические решения могут быть полезны для производства керамических материалов специального назначения на основе оксидных соединений ферритов и хромитов переходных элементов.



