Масштабирование процесса и реализация на практике биотехнологического производства зависит от таких факторов, как наличие воспроизводимого массового дешевого сырья; простота трансформации сырья в питательную среду; возможность аппаратурного оформления производства стандартным либо новым эффективным оборудованием; высокий выход целевого продукта и обеспечение стандартности его качества. Ввиду перспективности использования БЦ в различных областях [1, 2] необходимо создание ее промышленного производства, при этом важной задачей является поиск подходящих источников углерода, имеющих низкую стоимость и не конкурирующих с пищевой продукцией. Актуальным направлением получения БЦ является использование целлюлозосодержащего сырья для получения из него альтернативных питательных сред.
Массовое использование ископаемых ресурсов в течение прошлого столетия и связанная с этим проблема загрязнения вызвали значительное число экологических и экономических проблем. Предположительно, эти ресурсы будут исчерпаны в ближайшем будущем. Данные причины способствуют прогрессивному переходу к экономике на основе возобновляемых материалов (биомассы) в качестве сырья для производства химических веществ, материалов, топлива и энергии в пределах так называемой концепции биоконверсии. Целлюлоза является одним из наиболее распространенных полисахаридов и рассматривается как неисчерпаемый и универсальный источник. Перспективным является использование так называемых энергетических, т.е. быстрорастущих растений: мискантуса, проса, сорго и т.д. [3]. Мискантус – род многолетних травянистых растений семейства мятликовых. Представляет растение высотой до 200 см, стебли прямостоячие, листья простые пластинчатой формы, верхушка острая, основание клиновидное, соцветия в виде метелок. Растение является многолетним злаком и начиная с третьего года культивирования может ежегодно продуцировать на одном поле на протяжении 15–20 лет 10–15 т/га/год сухой биомассы, что соответствует 4–6 т/га чистой целлюлозы [4].
В ИПХЭТ СО РАН разработана технология получения ферментативных гидролизатов из мискантуса. Предварительно мискантус подвергают химической обработке разбавленными растворами кислоты и/или щелочи [5], а затем ферментативному гидролизу [6]. Исследование процесса биосинтеза БЦ на ферментативном гидролизате лигноцеллюлозного материала плодовых оболочек овса [7] показало, что для успешного микробиологического синтеза ферментативный гидролизат должен обладать биологической доброкачественностью.
В данной работе в качестве субстрата для ферментативного гидролиза выбран лигноцеллюлозный материал (ЛЦМ) мискантуса. ЛЦМ мискантуса получают обработкой сырья в одну стадию разбавленным раствором азотной кислоты при атмосферном давлении в стандартном оборудовании. Показано, что ферментативный гидролизат, полученный из ЛЦМ мискантуса, является биологически доброкачественным для биосинтеза этанола и не нуждается в дополнительной технологической обработке для освобождения его от вредных примесей [8].
Целью данной работы являлось изучение процесса биосинтеза БЦ на ферментативном гидролизате ЛЦМ мискантуса и исследование структуры полученных образцов методом инфракрасной спектроскопии. Следует отметить, что данная задача неоднозначна, поскольку продуценты БЦ более требовательны к составу питательных сред, следовательно, данные по доброкачественности среды для дрожжей не могут быть экстраполированы на целлюлозосинтезирующие микроорганизмы [9].
Материалы и методы исследования
ЛЦМ мискантуса был получен обработкой разбавленным раствором азотной кислоты на опытном производстве ИПХЭТ СО РАН и имел следующий состав ( %, в пересчете на а.с.в.): массовая доля кислотонерастворимого лигнина – 10,6, массовая доля золы – 4,8, массовая доля целлюлозы по Кюршнеру – 86,7, массовая доля пентозанов – 7,9.
Ферментативный гидролиз ЛЦМ мискантуса проводился в ферментере объёмом 11 л в водной среде при 47 ± 2 °С в течение 72 ч с помощью ферментных препаратов Целлолюкс-А (0,04 г/г субстрата) и Брюзайм BGX (0,1 мл/г субстрата), активная кислотность поддерживалась на уровне 4,7 ± 0,2 с помощью гидроксида аммония и ортофосфорной кислоты, начальная концентрация субстрата составила 60 г/л, более подробно методика описана в работе [9].
Полученный ферментативный гидролизат отфильтровывался от остатков субстрата под вакуумом. Гидролизат представлял собой прозрачную жидкость рыжего цвета с кислым запахом, активная кислотность 4,7 ед. рН. Общее количество редуцирующих веществ (РВ) составило 49,0 г/л, из них ксилозы – 2,8 г/л. В отфильтрованный ферментативный гидролизат ЛЦМ из мискантуса вносился охлажденный настой чая (1 л дистиллированной воды доводили до кипения, добавляли сухой черный байховый чай, проводили экстракцию в течение 15 мин, охлаждали и отфильтровывали). При этом питательная среда стандартизовалась по содержанию РВ от 20 до 25 г/л и по содержанию экстрактивных веществ чая от 1,6 г/л до 4,8 г/л [10].
В качестве продуцента для биосинтеза БЦ использовалась симбиотическая культура Мedusomyces gisevii Sa-12. Предварительно проводилась адаптация культуры на исследуемой питательной среде. Инокулят вносился в питательные среды в количестве 10 % от объема питательной среды, культивирование проводилось в статических условиях при 27 °С в течение 24 суток. Условия культивирования выбраны на основании ранее проведённых работ [10, 11].
Микробиологические показатели (количество дрожжей и уксуснокислых бактерий) контролировались с использованием микроскопа B-150 OPTIKA. Прирост пленки БЦ оценивался гравиметрическим методом (весы лабораторные аналитические Explorer EX-224), уровень активной кислотности контролировался с помощью иономера (иономер И-160 МИ). Концентрация РВ контролировалась спектрофотометрическим методом (спектрофотометр «UNICO-2804», США) с использованием динитросалицилового реактива, концентрация ксилозы определялась по стандартной методике, которая основана на образовании фурфурола из пентозанов.
Структура бактериальной целлюлозы была исследована на инфракрасном спектрофотометре «Инфралюм ФТ-801» в таблетках KBr.
Результаты исследования и их обсуждение
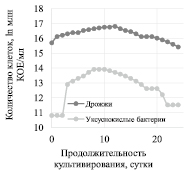
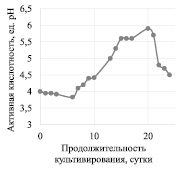
Изменение количества дрожжей и уксуснокислых клеток в процессе культивирования Мedusomyces gisevii Sa-12 на ферментативном гидролизате ЛЦМ мискантуса представлено на рис. 1, изменение уровня активной кислотности в процессе культивирования Мedusomyces gisevii Sa-12 – на рис. 2.
Концентрация клеток дрожжей в питательной среде в процессе культивирования оказалась на порядок выше, чем уксуснокислых бактерий. Для дрожжей лаг-фаза не наблюдалась, увеличение концентрации клеток происходило с 0 по 12 сутки, после 12 суток происходила фаза отмирания. Для уксуснокислых бактерий наблюдалась лаг-фаза, до 8 суток их количество увеличивалось, с 8 по 10 сутки количество клеток оставалось постоянным, после 10 суток происходила фаза отмирания.
|
|
|
|
Рис. 1. Изменение количества дрожжей и уксуснокислых клеток |
Рис. 2. Изменение уровня активной кислотности |
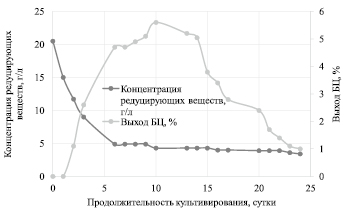
Рис. 3. Зависимость концентрации РВ и выхода БЦ от продолжительности культивирования
В процессе культивирования симбиотической культуры Мedusomyces gisevii в питательной среде в результате действия защитного механизма накапливаются промежуточные продукты гликолиза: уксусная, глюконовая кислоты, этанол и глицерин [12], косвенно об их накоплении можно судить по изменениям рН. Начальная активная кислотность питательной среды составляла 4,0, до шестых суток культивирования значение pH понизилось до 3,8. Далее в процессе культивирования значение активной кислотности среды повышалось до 5,9. Повышение активной кислотности не характерно для данного продуцента, однако похожая зависимость описана при культивировании продуцента Gluconacetobacter xylinus CH001 на кислотном гидролизате мискантуса [13].
На рис. 3 представлена зависимость концентрации РВ и выхода БЦ от продолжительности культивирования.
Константа скорости утилизации субстрата рассчитана по формуле [14]:
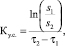 (1)
(1)
где Ку.с. – константа утилизации субстрата, сут-1; S1, S2 – концентрация РВ в начальный и конечный моменты времени; t1, t2 – начальный и конечный моменты времени, сутки.
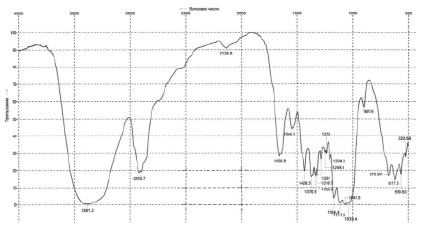
Рис. 4. Ик-спектр образца БЦ
Утилизация субстрата происходила в два периода: с 0 по 6 сутки культивирования константа скорости утилизации субстрата составила 0,234 сут-1, со 6 по 24 значение снизилось в 12 раз и составило 0,020 сут-1. Быстрая утилизация РВ с 0 по 6 сутки связано с потреблением субстрата микроорганизмами и их активным размножением. Со 6 по 24 сутки РВ медленно расходуются на поддержание жизнедеятельности микроорганизмов.
Гидролизат ЛЦМ мискантуса преимущественно состоит из глюкозы, концентрация ксилозы в нулевой момент времени составила 1,2 г/л. На 7 сутки культивирования общая концентрация РВ составила 4,9 г/л, при этом количество ксилозы в гидролизате практически не изменилось и составило 0,8 г/л. Через 24 суток культивирования концентрация РВ в питательной среде составила 3,4 г/л, а ксилозы – 0,3 г/л.
Скорость синтеза продукта (бактериальной целлюлозы) рассчитана по формуле
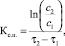 (2)
(2)
где Кс.п. – константа синтеза продукта, сут-1; С1, С2 – масса продукта в начальный и конечный момент времени; t1, t2 – начальный и конечный моменты времени, сутки.
В первые сутки культивирования на поверхности питательной среды не наблюдалось четко выраженной гель-пленки БЦ. На вторые сутки культивирования образовалась тонкая гель-пленка БЦ. Основной прирост биомассы происходил с 2 по 6 сутки культивирования – выход БЦ увеличился с 1,1 % до 4,7 %; константа скорости синтеза продукта в этот период составила 0,363 сут-1. С 6 по 10 сутки выход БЦ вырос до 5,6 %, константа скорости синтеза продукта в этот период снизилась до 0,044 сут-1. Далее скорость синтеза БЦ снижается, стремясь к нулевому значению.
С 10 по 24 сутки выход БЦ снизился до 1 %, что указывает на идущие процессы деструкции, этот период совпадает с фазой отмирания дрожжей и уксуснокислых бактерий. Таким образом, на практике начало фазы отмирания микроорганизмов может служить критерием окончания процесса биосинтеза БЦ.
Ферментативный гидролизат ЛЦМ мискантуса не является благоприятной питательной средой для биосинтеза БЦ, наибольший выход БЦ составил 5,6 %, что в 1,6 раз меньше, чем выход БЦ на синтетической питательной среде при культивировании Мedusomyces gisevii Sa-12 в аналогичных условиях – 9,0 % [10]. Предположительно, это можно объяснить способом предобработки исходного сырья и присутствием примесей в ферментативном гидролизате ЛЦМ мискантуса, которые могут ингибировать биосинтез БЦ. Таким образом, доброкачественность ферментативного гидролизата ЛЦМ мискантуса для биосинтеза этанола [8] не является гарантией доброкачественности для биосинтеза БЦ, что обусловлено большой требовательностью к качеству питательных сред симбиотических продуцентов Мedusomyces gisevii Sa-12 по сравнению с Saccharomyces сerevisiae. Можно предположить, что для успешного биосинтеза БЦ следует использовать более чистые субстраты, например техническую целлюлозу мискантуса.
На рис. 4 представлен ИК-спектр образца БЦ, синтезированного на ферментативном гидролизате ЛЦМ мискантуса.
В инфракрасном спектре образца БЦ присутствует интенсивная полоса при 3381 см-1, которая указывает на валентные колебания OH-групп. Менее интенсивная полоса при 2917 см-1 обусловлена валентными колебаниями групп CH2, CH. В спектре БЦ полосы в диапазоне 2000–1500 см-1 принадлежат деформационным колебаниям OH-групп прочно связанной воды. Слабые полосы поглощения в диапазоне: 1430–1370 см-1 обусловлены деформационным колебаниям групп CH2; 1360–1320 см-1 – деформационные колебания групп OH в CH2OH. Полосы при 1281 и 1235 см-1 указывают на деформационные колебания OH-групп в спиртах. Полоса при 1204 см-1 указывает на деформационные колебания OH-групп. Полосы поглощения в области 1000–1200 см-1 обусловлены в основном валентными колебаниями C-O-C и C-O в спиртах [15]. Таким образом, методом ИК подтверждено, что БЦ, полученная на ферментативном гидролизате ЛЦМ, является чистым соединением, содержащим только целлюлозу.
Выводы
Исследован процесс биосинтеза БЦ симбиотической культурой Мedusomyces gisevii Sa-12 на ферментативном гидролизате ЛЦМ мискантуса. Основная утилизация субстрата происходит за 6 суток культивирования, константа утилизации субстрата составляет 0,236 сут-1. Установлено, что численность уксуснокислых бактерий в процессе культивирования на порядок меньше, чем дрожжей, и через 10 суток составляет 1,1 КОЕ/мл. Показано, что на практике начало фазы отмирания симбиотических микроорганизмов может служить критерием окончания процесса биосинтеза, так как эта фаза совпадает с процессом деструкции БЦ. Показано, что ферментативный гидролизат ЛЦМ мискантуса не является доброкачественной питательной средой для биосинтеза БЦ: выход БЦ на 10 сутки культивирования составляет 5,6 %, что в 1,6 раз меньше, чем выход БЦ на синтетической питательной среде, а на 24 сутки выход падает до 1,0 %, то есть БЦ подвергается деструкции. С помощью инфракрасной спектроскопии установлено, что БЦ является чистым соединением, содержащим только целлюлозу.
Исследование выполнено за счет гранта Российского научного фонда (проект № 17-19-01054).