Стремительное развитие биотехнологической промышленности стало одним из ключевых трендов мировой науки. Особое внимание при этом уделяется процессу биосинтеза бактериальной целлюлозы (БЦ) [1]. Ученые всего мира считают БЦ уникальным материалом будущего, который может быть использован в различных отраслях. Широкое применение БЦ нашла в медицине – гель-пленки БЦ можно использовать в микрохирургии при протезировании кровеносных сосудов [1], также на их основе можно восстанавливать суставные хрящи у больных, страдающих от болей в суставах и потери подвижности. Для биосинтеза БЦ классической является стандартная синтетическая среда [2], она была многократно модифицирована, однакоо ее дороговизна увеличивает стоимость целевого продукта [2].
В ИПХЭТ СО РАН предложено получать питательную среду из отходов сельского хозяйства – плодовых оболочек овса (ПОО) [3]. Данный вид сырья сохраняет продовольственную безопасность страны и характеризуется массовостью, доступностью, ежегодной возобновляемостью и низкой себестоимостью. Ранее нашим коллективом плодовые оболочки овса использовались в качестве сырья для получения биоэтанола [4], кормового белка [5], нитратов целлюлозы [6].
В данной работе рассматриваются проблемы получения питательной среды методом ферментативного гидролиза, в качестве субстрата для которого используется продукт азотнокислой обработки (ПАО) ПОО. Предварительная обработка сырья в одну стадию разбавленным раствором азотной кислоты позволяет достичь высоких результатов, поскольку химическое воздействие сочетает три функции: гидролиза, нитрования и окисления. Этот способ многократно апробирован в условиях опытно-промышленного производства ИПХЭТ СО РАН. Ферментативный гидролиз полученных субстратов осуществляется промышленно доступными ферментными препаратами. Успешность проведения ферментативного гидролиза в производственных условиях не является очевидной. Это связано с необходимостью тщательной промывки субстратов от ингибиторов [7] на стадии предварительной химической обработки, а также с сохранением микробиологической чистоты биотехнологических процессов, проводимых в емкостном оборудовании.
Следует отметить, что процесс получения питательной среды характеризуется сложностью масштабирования, как на этапе предварительной обработки сырья [8], так и на этапе ферментативного гидролиза [9]. В Комплексной программе развития биотехнологий в Российской Федерации на период до 2020 г. № 1853п-П8 от 24 апреля 2012 г. обращается внимание на то, что в России полностью отсутствует система «масштабирования» научных биотехнологических разработок для целей промышленного производства и другие элементы биоэкономики, необходимые для преобразования научных знаний в коммерческие продукты. Таким образом, исследования возможности получения питательной среды в производственных условиях для биосинтеза БЦ являются актуальными.
Целью данной работы являлось исследование преодоления проблем получения питательной среды в производственных условиях из плодовых оболочек овса для биосинтеза бактериальной целлюлозы.
Материалы и методы исследования
Определение основных характеристик сырья до и после предварительной химической обработки (массовые доли (м.д.) целлюлозы по Кюршнеру, пентозанов, кислотонерастворимого лигнина, золы) проводилось по стандартным методикам [10]. Наработка субстратов проводилась на опытном производстве ИПХЭТ СО РАН согласно действующей нормативной документации.
Одностадийная обработка плодовых оболочек овса проводилась 4 %-ным раствором азотной кислоты при атмосферном давлении, температуре 90–96 °С в течение 4 ч, в результате был получен продукт азотнокислой обработки (ПАО) [4].
После азотнокислой обработки субстрат был промыт до нейтральной реакции и отжат на фильтр-прессе. Ферментативный гидролиз проводился в ацетатном буфере и водной среде в колбах Эрленмейера емкостью 0,5 л при концентрации субстрата 33,3 г/л, в водной среде при концентрации субстрата 60,0 г/л в трех вариантах: в колбах Эрленмейера емкостью 1 л, ферментере объемом 11 л и емкостном оборудовании объемом 63 л. Процесс ферментативного гидролиза проводился при непрерывном перемешивании с частотой колебаний 150 мин-1 в шейкере-инкубаторе «Unimax 1010». В работе использовались промышленно доступные ферментные препараты «Целлолюкс-А» (производитель ПО «Сиббиофарм», Бердск) и «Брюзайм BGX» (производитель «Polfa Tarchomin Pharmaceutical Works S.A.», Польша, для компании «Diadic International Inc.», США). Препарат «Целлолюкс-А» позиционируется на рынке как целлюлаза для расщепления некрахмалистых полисахаридов, «Брюзайм BGX» – как гемицеллюлаза. Температура ферментативного гидролиза составила 46–47 °С. Продолжительность ферментативного гидролиза составила 24 ч, при этом активная кислотность поддерживалась вручную на уровне 4,7–4,9.
Концентрация редуцирующих веществ (РВ) в пересчете на глюкозу определялась спектрофотометрическим методом с помощью реактива на основе 3,5-динитросалициловой кислоты на «UNICO UV-2804». Выход редуцирующих веществ (РВ) от массы субстрата рассчитан с учетом коэффициента 0,9, обусловленного присоединением молекулы воды к ангидроглюкозным остаткам соответствующих мономерных звеньев в результате ферментативного гидролиза.
Результаты исследования и их обсуждение
Химический состав сырья до и после обработки представлен в табл. 1.
Одностадийная обработка сырья раствором азотной кислоты приводит к следующим изменениям по сравнению с нативным сырьем: повышению массовой доли целлюлозы от (44,7 ± 0,2) % до (79,2 ± 0,3) %, снижению массовой доли пентозанов с (30,8 ± 0,2) % до (9,2 ± 0,2) % и уменьшению массовой доли кислотонерастворимого лигнина с (18,1 ± 0,1) % до (13,8 ± 0,1) %, при этом повысилась зольность. Продукт азотнокислой обработки ПОО представляет собой многокомпонентную смесь, включающую различные примеси, в том числе растворимые в осахаренном субстрате продукты окислительного нитрования лигнина. Однако достаточно высокая сумма гидролизуемых компонентов позволяет предположить высокую реакционную способность субстрата к ферментативному гидролизу и успешность дальнейшего синтеза бактериальной целлюлозы.
Работы по исследованию ферментативного гидролиза в ацетатном буфере ПАО ПОО [11] позволили сделать оптимистический прогноз относительно возможности получения питательной среды в производственных условиях для биосинтеза бактериальной целлюлозы – для начальной концентрации ПАО ПОО 33,3 г/л выход РВ составил 91,4 % от массы субстрата.
Таблица 1
Химический состав сырья до и после предварительной химической обработки
|
Наименование |
Массовая доля, % |
Сумма гидролизуемых компонентов, % |
|||
|
целлюлозы |
пентозанов |
лигнина |
золы |
||
|
Плодовые оболочки овса |
44,7 ± 0,2 |
30,8 ± 0,2 |
18,1 ± 0,1 |
4,6 ± 0,1 |
75,5 ± 0,3 |
|
Продукт азотнокислой обработки |
79,2 ± 0,3 |
9,2 ± 0,2 |
13,8 ± 0,1 |
8,2 ± 0,1 |
88,4 ± 0,3 |
Таблица 2
Результаты проведения ферментативного гидролиза в лабораторных условиях (колбах Эйленмейера) в ацетатном буфере и водной среде, а также при масштабировании процесса в ферментере и в производственных условиях (емкостном оборудовании)
|
Показатель |
Колба, объем 0,5 л |
Колба, объем 0,5 л |
Колба, объем 1 л |
Ферментер, объем 11 л |
Емкостное оборудование, объем 63 л |
|
Среда для ферментативного гидролиза |
ацетатный буфер [11] |
водная среда |
|||
|
Начальная концентрация субстрата, г/л |
33,3 |
60,0 |
|||
|
Концентрация РВ, г/л |
33,8 ± 0,2 |
32,3 ± 0,2 |
48,8 ± 0,2 |
42,8 ± 0,2 |
44,0 ± 0,2 |
|
Выход РВ, % от массы субстрата |
91,4 ± 0,3 |
87,3 ± 0,3 |
73,3 ± 0,3 |
64,3 ± 0,2 |
66,0 ± 0,2 |
Опыты по исследованию ферментативного гидролиза были проведены поэтапно. Результаты проведения ферментативного гидролиза в лабораторных условиях (колбах Эйленмейера) в ацетатном буфере и водной среде, а также при масштабировании процесса в ферментере и в производственных условиях (емкостном оборудовании) отражены в табл. 2 и на рисунке.
Результаты, полученные в лабораторных условиях, а также при дальнейшем масштабировании процесса в ферментере и в емкостном оборудовании, демонстрируют схожий характер кривой зависимости концентрации РВ от продолжительности процесса ферментативного гидролиза (рисунок). Кривые накопления концентрации РВ показывают, что концентрация РВ увеличивалась экспоненциально и через 24 ч от начала ферментативного гидролиза достигла значений от (32,3 ± 0,2) г/л до (48,8 ± 0,2) г/л.
Концентрация РВ, полученная в результате ферментативного гидролиза в ацетатном буфере и водной среде (колбы объемом 0,5 л), практически совпадает и равна (33,8 ± 0,2) г/л и (32,3 ± 0,2) г/л соответственно. Это связано с тем, что проведение ферментативного гидролиза в водной среде в небольших объемах не осложнено трудностями корректировки активной кислотности, по сравнению с осуществлением процесса в емкостном оборудовании.
При получении питательной среды в емкостном оборудовании концентрация РВ снижается на 4,8 г/л по сравнению с результатами, полученными в колбе Эйленмейера (объем 1 л) и на 2,8 г/л по сравнению с ферментером. Это объясняется не только колебаниями активной кислотности в процессе ферментативного гидролиза, но и с недостаточной промывкой продукта азотнокислой обработки ПОО от ингибиторов на стадии предварительной химической обработки сырья, а также снижением активной кислотности в процессе ферментативного гидролиза и сложностью ее корректировки в производственных условиях вручную.
Проведение ферментативного гидролиза в ацетатном буфере при начальной концентрации субстрата 33,3 г/л (колба Эйленмейера, объем 0,5 л) позволяет достичь максимального выхода РВ от массы субстрата – (91,4 ± 0,3) %. Переход от ацетатного буфера при ферментативном гидролизе к водной среде является важным этапом для дальнейшего биосинтеза бактериальной целлюлозы, так как ацетатный буфер может оказывать ингибирующее действие на уксуснокислые бактерии и биосинтез бактериальной целлюлозы из-за избытка ацетат-ионов. Однако осуществить ферментативный гидролиз в водной среде сложнее по сравнению с ацетатным буфером, так как в процессе гидролиза снижается активная кислотность среды, что негативно влияет на биохимическую стабильность ферментных препаратов.
При ферментативном гидролизе в водной среде в колбе при начальной концентрации субстрата 33,3 г/л выход РВ снижается на 4,1 % и составляет (87,3 ± 0,3) % от массы субстрата, что связано с колебаниями активной кислотности при проведении процесса, так как в процессе ферментативного гидролиза наблюдается подкисление, а поскольку рН поддерживался на заданном уровне вручную, то периодически рН отклонялся.
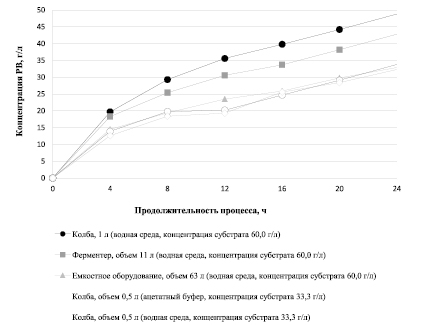
Зависимость концентрации РВ от продолжительности процесса ферментативного гидролиза в ацетатном буфере и водной среде
При дальнейшем увеличении объема ферментативного водного гидролизата и начальной концентрации субстрата до 60 г/л, происходило еще большее снижение выхода РВ: в колбе объемом 1 л выход РВ составил (73,3 ± 0,3) % от массы субстрата, а при переходе к ферментеру объемом 11 л выход снизился еще на 9 % и составил (64,3 ± 0,2) % от массы субстрата. Таким образом, переход от ацетатного буфера к водной среде и дальнейшее масштабирование процесса ферментативного гидролиза по объему при одновременном повышении концентрации субстрата является сложной проблемой, требующей постоянного контроля активной кислотности на протяжении всего процесса. В связи с этим при переходе в производственные условия для реализации ферментативного гидролиза ПАО ПОО в емкостном оборудовании объемом 63 л было принято решение о ежечасном контроле и корректировке активной кислотности. Это позволило достичь положительных результатов – в емкостном оборудовании был получен выход РВ (66,0 ± 0,2) % от массы субстрата.
Выполненные исследования свидетельствуют о том, что для получения питательной среды в производственных условиях для последующего биосинтеза бактериальной целлюлозы возможно применение одностадийной химической обработки сырья раствором азотной кислоты.
В работе [12] показано, что максимальный выход БЦ (8,7–9,0 %) обеспечивается при начальной концентрации глюкозы в среде 20–25 г/л. Таким образом, можно сделать вывод, что полученная ферментативным способом в производственных условиях питательная среда с концентрацией РВ (44,0 ± 0,2) г/л из сельскохозяйственных отходов – плодовых оболочек овса, предварительно обработанных разбавленным раствором азотной кислоты, может быть пригодна для дальнейшего биосинтеза бактериальной целлюлозы.
Выводы
Исследована возможность получения питательной среды в производственных условиях ферментативным способом из продукта азотнокислой обработки плодовых оболочек овса в водной среде для биосинтеза бактериальной целлюлозы. По результатам работы выявлено, что при переходе от ацетатного буфера к водной среде в процессе ферментативного гидролиза при начальной концентрации субстрата 33,3 г/л наблюдается снижение концентрации редуцирующих веществ от (33,8 ± 0,2) г/л до (32,3 ± 0,2) г/л или на 4,1 % в пересчете на выход РВ от массы субстрата. Показано, что при поэтапном масштабировании ферментативного гидролиза по объему в водной среде при начальной концентрации субстрата 60,0 г/л происходит снижение выхода РВ: в колбе объемом 1 л выход РВ составил (73,3 ± 0,3) % от массы субстрата, а при переходе к ферментеру объемом 11 л выход снизился еще на 9 % и составил (64,3 ± 0,2) % от массы субстрата. Постоянный контроль и корректировка активной кислотности в емкостном оборудовании позволили получить выход РВ (66,0 ± 0,2) % от массы субстрата. Таким образом, установлено, что ферментативным гидролизом в водной среде при использовании ферментных препаратов Целлолюкс-А и Брюзайм BGX в производственных условиях можно получить питательную среду для последующего биосинтеза бактериальной целлюлозы из плодовых оболочек овса одностадийно обработанных раствором азотной кислоты.
Исследование выполнено за счет гранта Российского научного фонда (проект № 17-19-01054).



