Титаномагнетиты представляют собой в основном смесь магнетита Fe3O4, гематита Fe2O3, ильменита FeTiO3, ульвошпинели Fe2TiO4 (FeO•FeTiO3) и других титанатов с примесями ванадия и хрома. Магнетит и ильменит находятся в виде твердых растворов [1]. При этом Fe3O4 и промежуточная фаза ульвошпинель Fe2TiO4 (FeO•FeTiO3) неограниченно растворяются друг в друге. С использованием мокрой магнитной сепарации из титаномагнетитовых песчаников получают титаномагнетитовые концентраты [2, 3]. Исследования по технологии переработки титаномагнетитовых концентратов для выделения железа, титана, хрома, ванадия и др. продуктов проводятся в течение нескольких десятков лет [4–7]. В последние годы возрос интерес к методам получения титанатов лития и натрия, обладающих функциональными свойствами [8, 9].
В зависимости от соотношения рудных и нерудных минералов, химический состав титаномагнетитовых песчаников различных месторождений изменяется в широких пределах. Так, в составе различных проб Аджинаурских песчаников Азербайджана нами обнаружено [10]: Feобщ – в пределах 6–12 %, иногда до 22–38,5 %; TiO2 – в пределах 0,7–1,7 %, иногда до 3,2–5,9 %; Mn – до 0,5–0,7 %; V – до 0,3–0,5 %; Cr – 0,01–0,1 %; Al2O3 – 10–18 %; SiO2 – 23–60 %; CaO – 5–10 %; MgO – 4–6 %; P2O5 – 0,1–0,3 %; SO3 – 0,07–0,2 %; CoO – 0,005–0,01 %. Обогащением Аджинаурских песчаников Азербайджана получаются титаномагнетитовые концентраты, в которых общее содержание железа и титана Feобщ – 54 % и TiO2 – 7 % мас. доли. Титаномагнетитовые концентраты, полученные из различных месторождений, помимо содержания целевых компонентов, существенно отличаются по физико-химическим свойствам и, следовательно, по условиям восстановления гранул. В известных методах [4–7] процесс металлизации продуктов восстановления проводится при высоких температурах (выше 1500 °С) для плавления и коагуляции металлического железа и образования титанованадиевого шлака.
Целью этой работы является определение условий прямого восстановления гранул титаномагнетитового концентрата метаном для получения железного порошка и анатазной модификации диоксида титана при температурах ниже 1000 °С.
Объектами исследования являются гранулы концентратов титаномагнетитов с флюсовыми добавками 25 % маc. доли соды, фазовые составы которых указаны в дифрактограмме, представленной на рис. 1. Гранулы с размером 5–6 мм титаномагнетитовых концентратов получены по методике, описанной в [11].
Термодинамический анализ восстановительных реакций и получение железного порошка
Для определения оптимального температурного интервала получения железа рассчитывали температурные зависимости свободной энергии Гиббса реакций восстановления гранул титаномагнетитового концентрата метаном. Использовано уравнение, успешно апробированное в работе [12]:
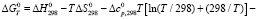
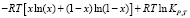 ,
,
где 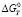 ,
, 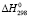 и
и 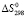 – стандартные свободные энергии, энтальпии и энтропии для реакций (1–14). х – мольная доля TiO2 в твердых растворах (Fe3O4)1-x(TiO2)x.
– стандартные свободные энергии, энтальпии и энтропии для реакций (1–14). х – мольная доля TiO2 в твердых растворах (Fe3O4)1-x(TiO2)x.
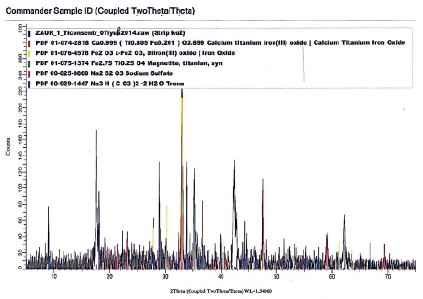
Рис. 1. Дифрактограмма для офлюсованного с содой титаномагнетитового концентрата. Дифрактограмма получена на основе измерений порошкового дифрактометра D2 Phaser (Bruker)
 – изменение молярной изобарной теплоемкости веществ в реакциях, КР,Т – константа равновесия реакции для газообразных веществ. Термодинамические функции образования соединений и простых веществ, участвующих в реакциях, заимствованы из справочника [13]. Результаты термодинамического расчета приведены на рис. 2.
– изменение молярной изобарной теплоемкости веществ в реакциях, КР,Т – константа равновесия реакции для газообразных веществ. Термодинамические функции образования соединений и простых веществ, участвующих в реакциях, заимствованы из справочника [13]. Результаты термодинамического расчета приведены на рис. 2.
Из рис. 2 следует, что при пониженных температурах восстановление железа природным газом в присутствии соды протекает через феррит натрия и оксид железа (II). При 500–550 °С магнетит (титаномагнетитовый концентрат) начинает взаимодействовать с содой с получением феррита (III) натрия. С повышением температуры до 850–930 °С реакция протекает с большой скоростью, образующийся феррит натрия восстанавливается до металла с регенерацией соды, и, таким образом, ферритообразование вступает как переходный процесс в каталитическом действии соды на металлизацию магнетита:
Fe3О4(тв) + Na2СО3(тв) = = 2NaFeO2(тв) + FeO(тв) + CO2(г), (1)
FeTiO3(тв) + Na2СО3(тв) = = Na2TiO3(тв) + FeO(тв) + CO2(г), (2)
2NaFeO2(тв) + CH4(г) = Fe(тв) + + FeO(тв) + Na2СО3(тв) + 2H2(г), (3)
2NaFeO2(тв) + CH4(г) = 2Fe(тв) + + Na2СО3(тв) + H2(г) + H2О(г). (4)
Титанат натрия, полученный по реакции (2), переходит в немагнитную фазу. Метан частично подвергается термическому распаду, а также конверсии с продуктами восстановления – водяным паром и диоксидом углерода. Образующиеся вторичные восстановители водород и СО также восстанавливают магнетит и промежуточные продукты FeO и NaFeO2 до металла:
Fe3О4(тв) + H2(г) = 3FeO(тв) + H2О(г), (5)
FeO(тв) + H2(г) = Fe(тв) + H2О(г), (6)
Fe3О4(тв) + CO(тв) = 3FeO(тв) + CO2(г), (7)
FeO(тв) + CO(г) = Fe(тв) + CO2(г), (8)
2NaFeO2(тв) + Н2 (г) + CO2(г) = 2FeO(тв) + Na2СО3(тв) + H2О(г), (9)
2NaFeO2(тв) + CO(г) = 2FeO(тв) + Na2СО3(тв), (10)
2NaFeO2(тв) + 3CO(г) = 2Fe(тв) + Na2СО3(тв) + 2CO2 (г). (11)
При более высоких оптимальных температурах преимущественно происходит непосредственное восстановление магнетита через вюстит до металла:
Fe3О4(тв) + CН4(г) = 3FeO(тв) + CO(г) + 2H2(г), (12)
FeO(тв) + CH4(г) = Fe(тв) + CO(г) + 2H2 (г), (13)
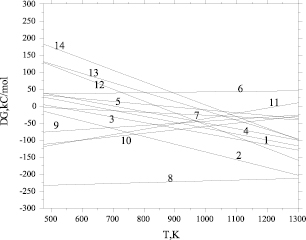
Рис. 2. Зависимости свободной энергии Гиббса реакций (1–14) от температуры
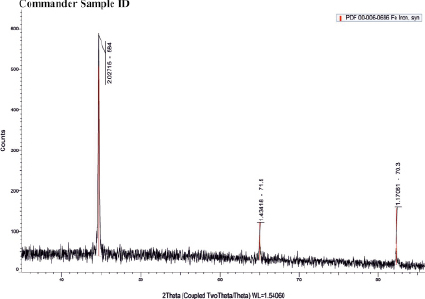
Рис. 3. Дифрактограмма железного порошка (α-Fe – 99 %), полученного из титаномагнетитового концентрата
Обобщенное уравнение реакции восстановления магнетита имеет вид
Fe3О4(тв) + CH4(г) = 3Fe(тв) + CO2(г) + 2H2О(г). (14)
Из рис. 2 следует, что реакция (14) при сравнительно низких температурах протекает очень слабо. Равновесие в реакции (14) смещается в правую сторону, начиная с 750 °С (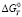 < 0). В то же время отрицательные значения свободной энергии Гиббса для реакций восстановления оксида железа (II) водородом (реакция 6), восстановления феррита натрия водородом (9), монооксидом углерода (7, 10, 11), с повышением температуры сменяются положительными значениями. Однако в проточной, неравновесной системе непрерывное удаление из зоны продуктов реакции способствует постоянному смешению равновесия вправо. Таким образом, термодинамические расчеты показали, что при температурах 850–930 °С большинство реакций восстановления гранул природным газом завершаются получением железа. Проведенные эксперименты подтвердили результаты термодинамического расчета (рис. 3). Был получен порошок α-Fe 99 %-ной чистоты при отсутствии науглероженности и слипания металлизованных частиц.
< 0). В то же время отрицательные значения свободной энергии Гиббса для реакций восстановления оксида железа (II) водородом (реакция 6), восстановления феррита натрия водородом (9), монооксидом углерода (7, 10, 11), с повышением температуры сменяются положительными значениями. Однако в проточной, неравновесной системе непрерывное удаление из зоны продуктов реакции способствует постоянному смешению равновесия вправо. Таким образом, термодинамические расчеты показали, что при температурах 850–930 °С большинство реакций восстановления гранул природным газом завершаются получением железа. Проведенные эксперименты подтвердили результаты термодинамического расчета (рис. 3). Был получен порошок α-Fe 99 %-ной чистоты при отсутствии науглероженности и слипания металлизованных частиц.
Продукты восстановления подвергались мокрой магнитной сепарации и разделились на две фракции: магнитную и немагнитную. Из магнитной фракции после промывки и сушки был получен природно-легированный железный порошок (рис. 3). Из немагнитной фракции после промывки, фильтрации и сушки извлекалась титановая фракция для получения технического диоксида титана.
Получение анатаза из титановой фракции
Титана диоксид TiO2 имеет три модификации: рутил, анатаз и брукит. Рутил является более стабильной формой и представляет собой плотно упакованную структуру анатаза (тетрагональную). Анатаз представляет собой тетрагональную структуру и переходит в рутил модификацию при 915 °С. Брукит обладает орторомбической структурой и спонтанно превращается в рутил при температуре около 750 °С. В большинстве работ при комплексной переработке титаномагнетитов и титановых руд получают рутил [14]. В нашей работе для выщелачивания титановой фракции использовали 15 %-ную соляную кислоту. Было выявлено, что при обработке титановой фракции таким раствором при 85 °С в течение 1 часа ионы железа, кальция и магния переходят в раствор в виде хлоридов. Для обескремнивания диоксида титана смесь обрабатывали слабым раствором гидроксида натрия при температуре кипения раствора. Порошок полититановой кислоты xTiO2•yH2O смешивали с порошком чистого хитозана в массовом соотношении 20:1 и прокаливали в интервале температур 850–900 °С до получения технической двуокиси титана в виде смеси 94,5 % анатаза и 4,5 рутила (рис. 4).
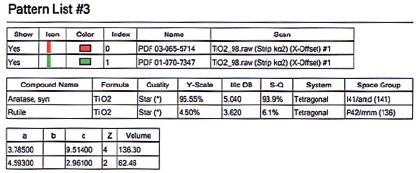
Рис. 4. Результаты рентгенофазового анализа технического диоксида титана с содержанием 94,5 % анатаза и 4,5 % рутила, полученного из титановой фракции титаномагнетитового концентрата
Использование хитозана в качестве модификатора не является случайным. В работе [15] выявлено влияние биоактивного природного полимера – хитозана как органического реагента на формирование текстуры морфологии и фазового состава продуктов при гидротермальной обработке порошков TiO2.
Заключение
Для восстановления офлюсованных гранул размерами 4–6 мм титаномагнетитового концентрата природным газом были установлены следующие оптимальные условия: Т = 875÷925 °С, продолжительность процесса t – 30 минут, скорость природного газа – 0,1 л/мин, при расходе – 0,6 м3/кг. При таких условиях степень металлизации офлюсованных гранул титаномагнетитового концентрата достигает 99 % при отсутствии сажеобразования, слипания и спекания восстановленных окатышей.
Реакции восстановления в температурном интервале Т = 875÷925 °С протекают в том случае, если в природный газ добавляется смесь водорода и монооксида углерода до 15 % по объему. Это объясняется тем, что реакции восстановления магнетита и других соединений метаном, водородом и монооксидом углерода являются сопряженными. В частности
Fe3О4 + CO = Fe + CO2, (9)
Fe3О4 + H2 = Fe + H2O, (10)
Fe3О4 + CH4 = 3Fe + CO2 + 2H2O. (11)
В этих реакциях СО и Н2 являются индукторами, СН4 акцептором. Первые две реакции инициируют восстановление магнетита метаном до металла. Фактор индукции I = n(CH4)/n(H2 + CO) ≥ 5. Это явление имеет место при высокой скорости проникновения молекул во все слои гранул, обладающих достаточной пористостью и прочностью.
При использовании биоактивного природного полимера хитозана в процессе гидротермальной обработки порошков полититановой кислоты xTiO2•yH2O в интервале температур 850–900 °С получен техничесий диоксид титана в виде смеси 94,5 % анатаза и 4,5 % рутила.



