Сочетание важных технологических свойств материалов, изготовленных на основе сложных оксидных систем переходных элементов, обусловливает неослабевающий научный интерес к таким объектам. Известно, что хромит меди (II) CuCr2O4 катализирует большую группу химических реакций, например гидрирование [6], разложение NH4ClO4 [5]. Феррит никеля (II) NiFe2O4 является известным магнитомягким материалом [7], активен в процессах каталитического разложения органических красителей из водных растворов [8].
Для системы NiFe2O4-CuCr2O4 ранее было установлено [1] существование при комнатной температуре морфотропных областей, содержащих две шпинельные фазы. Однако механизм образования таких структур до сих пор не ясен.
Целью исследования являлось изучение процессов формирования структуры в системе 0.3NiFe2O4-0.7CuCr2O4 и ее свойств в процессах окислительной деструкции метилового оранжевого в присутствии пероксида водорода.
Материалы и методы исследования
Для синтеза образцов были использованы оксиды NiO, CuO, Fe2O3, Cr2O3 квалификации хч. Фазовый состав полученных материалов изучали с применением метода рентгенофазового анализа (РФА), использовали Cu-Kα излучение. Анализ структуры фаз, входящих в образцы, проводили по линиям 220, 311 для кубической шпинели, 312 и 321 для фазы тетрагональной шпинели, 006 и 012 для хромита меди (I). Микрофотографии образцов были получены на сканирующем электронном микроскопе, изотермы физической адсорбции азота – на аппарате Quantachrome Autosorb 1c. Определение площади поверхности проводили, используя уравнение ВЕТ (p/p0 = 0,05–0,2). ИК-спектры водного раствора органического красителя были получены на ИК-Фурье спектрометре Varian 640 (производитель – компания Varian (США)).
Изучение каталитической активности синтезированных материалов проводили на модельном растворе метилового оранжевого с концентрацией 40 мг/л по методике, приведенной в [3]. Для проведения исследования катализатор измельчали до размера зерен не более 0,385 мм. Исходный раствор метилового оранжевого в количестве 10 мл помещали в плоскодонную колбу, добавляли 0,0010–0,0012 г катализатора и 2 мл раствора пероксида водорода с концентрацией 3 % (мас.). Эксперимент проводили при комнатной температуре. Реакционную систему периодически перемешивали. Расчет количества метилового оранжевого, подвергшегося каталитической деструкции (Р), проводили по формуле
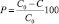 ,
,
где С0 – начальная концентрация раствора, мг/л; С – текущее значение концентрации раствора, мг/л.
Результаты исследования и их обсуждение
Формирование структуры образцов проводили с применением следующих технологических приемов.
Образец 1 был получен из оксидов переходных элементов NiO, CuO, Fe2O3, Cr2O3 квалификации хч. Оксиды отвешивали в количестве, отвечающем соотношению компонентов в твердом растворе состава Ni0.3Cu0.7Fe0.6Cr1.4O4, тщательно перемешивали, брикетировали в таблетки диаметром 20 мм под давлением 15 МПа и подвергали термообработке циклами по 7–8 часов при температуре 900 °С в течение 140 часов.
На рентгенограмме образца 1 (рис. 1, а) присутствуют линии, соответствующие твердому раствору, кристаллизующемуся в структуре кубической шпинели, и линии, характеризующие фазу состава CuCrO2, кристаллизующуюся в ромбоэдрической симметрии, ее содержание не превышает 3 %.
Формирование в образце фазы делафоссита может протекать по реакции разложения хромита меди (II) в соответствии с уравнением:
CuCr2O4 + CuO = Cu2Cr2O4 + ½ O2.
Процесс возможен при длительном нагревании реакционной смеси выше 850 °С. Образование хромита меди (II) происходит по механизму твердофазной реакции между оксидами меди (II) и хрома (III):
CuO + Cr2O3 = CuCr2O4.
Параллельно протекает реакция образования феррита никеля (II):
NiO + Fe2O3 = NiFe2O4.
Формирование структуры образца завершается реакцией
0,3NiFe2O4 + 0,67CuCr2O4 + 0,03CuO +
+ 0,03Cr2O3 = 0,03 CuCrO2 + 0,97Ni0,31 Cu0,66 ϒ0,03 Fe0,62 Cr+31,36 CrVI 0,02 O4.
При составлении уравнения приведенной выше реакции для соблюдения условия необходимости получения формульной единицы шпинели общего состава АВ2О4 следует предположить, что часть катионов хрома переходит из трехвалентного в шестивалентное состояние.
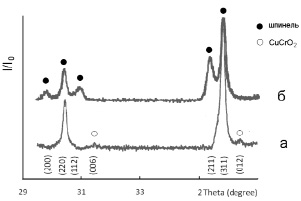
Рис. 1. Фрагмент рентгенограммы системы 0.3 NiFe2О4 – 0.7 CuCr2O4

Рис. 2. Микрофотография образца, полученного из оксидов NiO-CuO-Cr2O3-Fe2O3 по керамической технологии

Рис. 3. Микрофотография образца, полученного из оксидов NiO-CuO-Fe2O3-Cr2O3 в присутствии KCl
На основании результатов анализа данных РФА состав образца 1 можно выразить следующим образом: около 97 % – твердый раствор со структурой кубической шпинели (параметр решетки aк = 0,8326 нм) примерного состава Ni0,31 Cu0,66 ϒ0,03 Fe0,62 Cr1,38 O4, содержащий, по-видимому, вакансии (обозначены символом ϒ) в решетке шпинели, 3 % – фаза делафоссита CuCrO2 (с параметрами решетки aр = 0,2982 нм, cр = 1,7111 нм).
На микрофотографии образца 1 (рис. 2) можно различить кристаллы, максимальный и минимальный размер кристаллитов в которых соответственно равен 2 мкм и 140 нм; площадь поверхности образца, измеренная методом БЕТ (SБЕТ), составляет 0,74 м2/г.
Следуя описанной выше процедуре синтеза, однако, не удается получить материал, содержащий только фазы шпинели. В этой связи были изменены технологические условия и осуществлен синтез материалов в более мягких температурных режимах.
Образец 2 был получен из оксидов переходных металлов аналогично описанному для образца 1, в присутствии 0,5–1,5 % (мас.) хлорида калия (сверх 100 %). Введение хлорида калия проводили на стадии гомогенизации смеси оксидов. Более подробно методика синтеза шпинелей описана в [2, 4]. Термообработку смеси оксидов NiO, CuO, Fe3O3, Cr2O3 и хлорида калия проводили при температуре 800 °С.
При анализе данных РФА установлено, что в образце 2 присутствуют две фазы шпинели: кубическая и тетрагональная (рис. 1, б). Фазовый состав образца 2 следующий: порядка 35 % – хромит меди (II) состава CuCr2O4, (тетрагональная шпинель, параметры решетка aт = = 0,6013 нм, cт = 0,7863 нм, отношение cт/aт = 0,925), 65 % – твердый раствор состава Ni0.46Cu0.54Fe0.92Cr1.08O4 (кубическая шпинель, aк = 0,8326 нм).
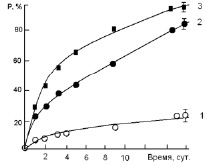
Рис. 4. Зависимость степени разложения метилового оранжевого от времени протекания реакции: без катализатора (1); в присутствии: шпинелей системы 0.3 NiFe2О4 – 0.7CuCr2O4, полученных: по керамической технологии (2); с введением хлорида калия (3)
На рис. 3 приведена микрофотография шпинелей, на которой видны кристаллы различной формы с высокой степенью окристаллизованности, максимальный размер зерен 3 мкм, минимальный 220 нм. Площадь поверхности образца, измеренная методом БЕТ, составляет 1,82 м2/г.
Согласно полученным данным, значение SБЕТ для образца 2, полученного в оптимизированных технологических режимах, превышает эту величину для образца, синтезированного по керамической технологии, на 59 %. Полученный результат может быть связан с более высокой дефектностью поверхности кристаллов.
Изучение каталитической активности синтезированных материалов проводили на примере реакции разложения пероксидом водорода органического красителя.
В ходе проведенного исследования установлено, что полученные материалы проявляют каталитическую активность в реакции Фентона. Временная зависимость количества метилового оранжевого, подвергшегося каталитической деструкции, приведена на рис. 4.
Согласно полученным результатам, наблюдали значительное увеличение скорости разложения органического вещества пероксидом водорода в присутствии катализатора. Введение в систему синтезированных материалов ускоряет процесс деструкции в среднем в 4–4,5 раза. Проведение процесса в присутствии катализатора, полученного в присутствии хлорида калия, позволяет практически полностью выводить органическое вещество из водного раствора (степень деструкции достигает 98 %).
На рис. 5 представлены ИК-спектры водного раствора органического красителя. В ходе процесса разложения метилового оранжевого (через 24 часа после начала реакции) интенсивности пиков в области значений ν = 2357–2360 см-1 и 2343–2344 см-1 уменьшаются, остальные линии смещаются в область больших значений ν. Это может свидетельствовать об уменьшении концентрации органической составляющей раствора. Немаловажным результатом можно считать отсутствие образования новых токсичных соединений в процессе деструкции органического вещества.
Разработанный метод синтеза может быть использован для получения материалов, пригодных в процессах очистки сточных вод промышленных предприятий, использующих в производственных циклах органические красители.
Выводы
Изучен процесс фазообразования в системе 0.3NiFe2O4-0.7CuCr2O4. Выявлено, что значение площади поверхности для образца, полученного в присутствии хлорида калия при пониженной температуре термообработки, превышает эту величину для синтезированного по керамической технологии образца более чем в 2 раза.
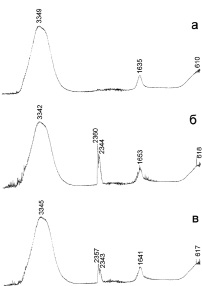
Рис. 5. ИК-спектры воды (а), модельного раствора метилового оранжевого (б), водного раствора после реакции (в)
Установлена высокая каталитическая активность синтезированных материалов в процессе окислительной деструкции метилового оранжевого в присутствии пероксида водорода. Выявлено увеличение скорости реакции деструкции органического вещества в среднем в 4–4,5 раза при введении в систему синтезированных материалов. Проведение процесса в присутствии катализатора, полученного в оптимизированных технологических условиях, позволяет практически полностью удалить органическое вещество из водного раствора (степень деструкции достигает 98 %). Полученный результат может быть полезным для разработки материалов, пригодных в процессах очистки сточных вод промышленных предприятий, использующих в производственных циклах органические красители.



