Технологии, основанные на реакциях, протекающих в твердофазном режиме, например, в условиях микроизмельчения компонентов, весьма перспективны, поскольку позволяют осуществлять их в энерго- и ресурсосберегающем цикле. Как таковое измельчение твёрдых материалов широко используется в химической технологии с целью инициирования процессов химического взаимодействия реагентов, в производстве строительных и лакокрасочных материалов, для увеличения сорбционной активности материалов, для получения стабильных гомогенных и гетерогенных смесей [1, 2, 8, 16, 19]. При измельчении твёрдых тел происходит поглощение ими подводимой механической энергии и накопление её в потенциальной форме. Материал сначала претерпевает объёмное деформирование и только после этого при определённом механическом усилии он разрушается. Работу, необходимую для измельчения, можно разделить на две составляющие, одна из которых расходуется на объёмное деформирование (А1), а другая (А2) – на образование новых поверхностей. Первая пропорциональна объёму тела А1 = к1•V (к1 – коэффициент пропорциональности, равный работе объёмного деформирования единицы объёма тела), а вторая работа пропорциональна увеличению поверхности А2 = σ.ΔS (σ-энергия образования единицы поверхности, или поверхностное натяжение, ΔS – проращивание поверхности, или площадь образовавшейся поверхности). Полная работа равна А = А1 + А2 = к1•V + σ•ΔS, т.к. V = d3, а S = d2, то А = d2(к1d + к2σ), где V – объем частицы, d – диаметр частицы, к2 – коэффициент пропорциональности, равный работе по увеличению единицы площади тела [11,17]. Из этой формулы следует, что при больших размерах частиц можно пренебречь работой образования поверхности и общая работа определяется главным образом работой упругого и пластического деформирования, которое характерно при дроблении материала. Чем меньше размер частиц измельчаемого материала, тем лучше выполняется соотношение А = к2σd2, т.е. работа измельчения определяется главным образом работой образования новой поверхности, что и присуще механоактивации в планетарных мельницах.
Проведение механической активации в высокоэнергетических мельницах является наиболее распространённой операцией в механохимии [3, 9, 20]. Основными причинами этого, вероятно, можно считать относительную простоту проведения опытов, и в технологических процессах по механическому воздействию на вещество мельничное оборудование широко распространено. Однако механика и физика процессов, происходящих при обработке вещества в мельнице, к настоящему времени изучена недостаточно. При механоактивации (МА) смесей веществ, в ходе воздействия стенок сосуда и мелющих тел на обрабатываемый материал смесей, происходят значительные изменения крупности частиц, пластической деформации зерен и даже кристаллов веществ, за счет образования новой поверхности ускоряется перемешивание и массоперенос компонентов смеси. В момент образования новой поверхности существенно возрастает вероятность химического взаимодействия между компонентами смеси. Образование локальных зон повышенного выделения энергии приводит к повышению температуры в точках соударения мелющих тел. Эти факторы (образование новой поверхности, выделение тепла, рост числа дефектов в кристаллах и т.п.) приводят к возбуждению твердофазной химической реакции. Твердофазные реакции происходят не во всем объёме реагирующих веществ, а лишь в точках контакта реагирующих частиц. Поэтому число контактов и площадь контакта имеют при этом определяющее значение. Мельничное оборудование в большой степени обеспечивает большую вероятность создания условий к возникновению как большого числа ультрадисперсных частиц, так и, соответственно, значительного числа контактов реагентов друг с другом за счет многократного повторения циклов, в ходе которых протекает твердофазная реакция.
В последнее время твердофазные реакции, активируемые в ходе обработки материалов в мельницах, приобрели особое значение. Причиной этому является перспектива использования подобного рода реакций в технологических процессах, в особенности при разработке нетрадиционных технологий, экологически чистых и экономически более выгодных по сравнению с известными.
Целью данной работы является изучение условий твердофазных процессов, протекающих в планетарной мельнице при получении прекурсоров функциональных материалов на основе соединений титана.
Материалы и методы исследования
Исследованы условия получения в режиме твердофазного процесса двух продуктов – титанового соединения в виде комплексной соли аммоний титанил сульфата – (NH4)2TiO(SO4)2·H2O (АТС), используемого в кожевенной промышленности в качестве нетоксичного дубителя кож и меха [18] и диоксида титана со структурой рутила. В первом случае исходными материалами были порошки технического сульфата титана TiO(SO4)·H2O(СТ), полученные при сернокислотной переработке минерала титанита – CaSiTO5 [4, 13, 14], и сульфата аммония (СА) марки Ч. Во втором случае для микроизмельчения использовался порошок диоксида титана анатазной модификации, полученный прокаливанием АТС при температуре 700 °С [15].

Рис. 1. Вид внутреннего пространства мельничного стакана и шаров с обрабатываемым материалом. Длительность обработки 60 минут
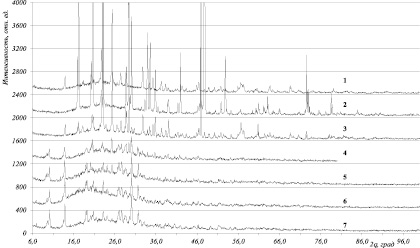
Рис. 2. Рентгенограммы исходных компонентов (1 – СТ и 2 – СА) и смесей компонентов, взятых при массовом отношении 1:1, после их измельчения в течение 3 – 4 мин, 4 – 30 мин, 5 – 60 мин, 6 – 5 ч, 7 – 10 ч
Для проведения эксперимента исходные материалы в заданном количестве смешивались в фарфоровой ступке, в смесь добавляли несколько капель дистиллированной воды в качестве поверхностно активного вещества, после чего смесь помещали в планетарную мельницу типа «САНД» с мельничными барабанами емкостью 500 мл. Внутренние стенки и крышки барабанов футерованы титаном, в качестве измельчающих тел использовали титановые шары диаметром 20 мм. Внешний вид стаканов с шарами и полученным при измельчении материалом представлен на рис. 1. Соотношение массы смеси к массе шаров соответствовало 1:10. Измельчение проводили в атмосферных условиях. Скорость вращения барабанов составляла 350–380 об/мин. Время измельчения материала варьировали от 4 мин до 10 ч.
По истечении заданного времени активированный продукт выгружали из мельничного барабана, помещали его в бюксы с герметичной крышкой. С помощью рентгеновского дифрактометра Shimadzu XRD-60001 с Со Кα излучением (l = 0,154060 нм, U = 30,0 kV, I = 30,0 mA) определяли его фазовый состав. Для сравнения и обсуждения результатов на дифрактометре анализировали и компоненты исходной смеси. На основании полученных данных рассчитывали средний размер кристаллита. Для этого применяли метод, основанный на использовании расчета уширения интерференционных линий, с учетом инструментальной поправки и эффектов напряжения [12]. Морфологию частиц образцов исследовали с помощью сканирующего микроскопа SEMLEO 420.
Механоактивацию анатаза проводили в планетарной мельнице типа Pulverisette-7, которая состоит из 2-х емкостей (стаканы) объемом около 50 мл с титановыми шарами диаметром 10 мм. Скорость вращения стаканов – 750 об/мин. Соотношение массы материала к массе шаров равно 1:10–15. Продолжительность измельчения – 2 ч. Термолиз измельченного материала проводили в электрической муфельной печи со скоростью нагревания до заданной температуры 10 град/мин. Выдержка образцов в зоне высокой температуры (800 °С) – 4 ч. После охлаждения образцы изучались с помощью химических и физико-химических методов. В частности, фазовый состав образцов устанавливали с помощью РФА – ДРОН, ДРФ Siemens D 5000. Удельную поверхность определяли по методу ВЕТ на приборе TriStar 3020 по показателям сорбции-десорбции азота.
Результаты исследования и их обсуждение
На рис. 2 представлены рентгенограммы исходных компонентов (1, 2), взятых для синтеза АТС, и образцов, полученных при измельчении в планетарной мельнице. Для удобства обсуждения результатов состояние смеси после 4 мин измельчения принято за исходное, поскольку заметного изменения в дифрактограммах компонентов и конечного образца не отмечено (3). С увеличением продолжительности измельчения изменение дифрактограмм становится заметным, что связано со структурными преобразованиями, обусловленными химическим взаимодействием компонентов смеси в процессе их механической активации. Степень преобразований в зоне твердофазной реакции постепенно возрастает. Так, интенсивность характеристических рефлексов на рентгенограммах исходных компонентов в области углов от 10 до 80 градусов в процессе измельчения снижаются, при этом наблюдается расширение появившихся рефлексов в области от 8,2 до 35 градусов, что свидетельствует о структурных преобразованиях в системе. После 30 мин измельчения в образце присутствует фаза, идентифицированная как титановое соединение α-(NH4)2TiO(SO4)2. Повышение продолжительности измельчения сопровождается дальнейшей фазовой перестройкой, что подтверждается появлением рефлексов в области 10, 18, 30 и 32 градусов, относящихся к соединению (NH4)2TiO(SO4)2.Н2О [5, 14].
На основании полученных данных можно констатировать, что в результате механоактивации компонентов смеси при их совместном измельчении протекает твердофазная химическая реакция, сопровождаемая образованием нового соединения. Процесс идет постепенно, через промежуточные структурные преобразования. Скорость процесса достаточно высокая и в выбранных условиях за 1–1,5 ч практически завершается.
Для изучения механизма процесса и влияния на его скорость дисперсионного состава частиц реакционной массы проведены расчеты изменения размера кристаллитов в зависимости от времени измельчения. Расчет проводили с использованием данных РФА. Отмечена общая тенденция уменьшения размера кристаллитов по мере увеличения продолжительности обработки (табл. 1). Оценка проведена по каждому характеризующему образец рефлексу. Вывод, который можно сделать, заключается в следующем: уменьшение размера кристаллитов при механической активации компонентов в исходной и реакционной смеси приводит к росту площади поверхности кристаллитов и, соответственно, увеличению их химической активности.
По результатам расчета размера кристаллитов можно с достаточной уверенностью сказать, что по мере увеличения продолжительности измельчения степень активации компонентов смеси возрастает. Происходят существенные энергетические изменения в системе, приводящие к уменьшению размера кристаллитов. Такого рода изменения начинаются уже в период предварительного смешения компонентов (4 минуты) и продолжаются по мере увеличения времени механической активации (от 30 минут до 10 часов) в исследованном промежутке времени.
О повышении химической активности компонентов свидетельствуют расчётные данные хода изменения микроискажений, полученные с применением метода аппроксимации, основанном на использовании функции псевдо-Фойгта [6, 10].
По мере увеличения продолжительности измельчения происходит некоторое выравнивание микроискажений в диапазоне изученных углов и при 10-часовом измельчении микроискажений заметно выравниваются (рис. 3). Это можно объяснить происходящим процессом гомогенизации размера кристаллитов, а также химическим взаимодействием компонентов смеси с образованием нового соединения.
Необходимо отметить, что обработка смеси компонентов в течение 30 мин уже обеспечивает необходимую степень активации компонентов, однако частицы агрегированы, что препятствует протеканию химической реакции. При увеличении продолжительности обработки материал смеси гомогенизируется, равномерно распределяется по поверхности мелющих тел и стенок барабана и скорость реакции увеличивается.
На рис. 4 представлены SEM-изображения образца (1) после одного часа обработки смеси компонентов в мельнице – «твердофазный» синтез и образца (2) аммоний титанилсульфата, полученного по «жидкофазному» синтезу [14].
Таблица 1
Данные расчета размера кристаллитов исследуемых образцов
|
Характеристика образца |
Продолжительность механической активации |
Размер кристаллитов (средний размер), нм |
|
СТ |
– |
32–110 (71) |
|
СА |
– |
55–178 (116,5) |
|
СТ + СА |
4 мин |
18–80 (48) |
|
СТ + СА |
30 мин |
16–55 (35,5) |
|
СТ + СА |
60 мин |
9–55 (32) |
|
СТ + СА |
5 ч |
9–28 (18,5) |
|
СТ + СА |
10 ч |
8–25 (16,5) |
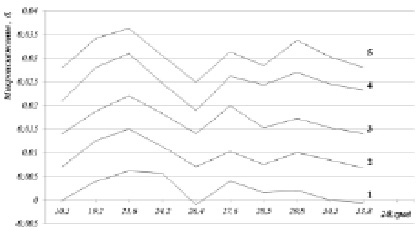
Рис. 3. Изменение микроискажений в зависимости от продолжительности измельчения, где: 1 – 4 мин, 2 – 30 мин, 3 – 60 мин, 4 – 5 ч и 5 – 10 ч. Кривые изменения микроискажений смещены по ординате, относительно друг друга, начиная с 1, на трансляционное слагаемое равное 0, 007δ
 а)
а)  б)
б)
Рис. 4. SEM-изображение образцов: а) после одного часа обработки смеси компонентов в мельнице – «твердофазный» синтез; б) – «жидкофазный» синтез [14]
Частицы образца 1 по размеру представлены узкой фракцией – 2–3 мкм, что не характерно для образца 2, размер частиц которого изменяется в широких пределах до 50 мкм. Кристаллы образца 1 имеют более строгую конфигурацию, чем у образца 2. Это свидетельствует о различном механизме фазообразования в гомогенной («твердофазный» синтез) и гетерогенной («жидкофазный» синтез) системах. В первом случае кристаллизация протекает при практически стехиометрическом соотношении компонентов, соответствующем приведенной выше реакции; во втором – при значительном избытке в системе высаливающих компонентов (серная кислота и сульфат аммония). Это и способствует образованию на первой стадии кристаллизации значительного количества мелких кристаллов, с большой поверхностной энергией, снижение которой сопровождается образованием крупных агрегатов.
Таблица 2
Фазовый состав образцов (после механоактивации анатаза и после прокаливания механоактивированных образцов)
|
№ п/п |
МА ч |
прокалкаАТС – МА анатаза |
прокалкаАТС – МА анатаза – термолиз |
||||
|
рутил |
анатаз |
брукит |
рутил |
анатаз |
брукит |
||
|
TiO2:Шары = 1:10 |
|||||||
|
1 |
0,5 |
– |
80 |
20 |
8 |
92 |
– |
|
2 |
1 |
25 |
55 |
20 |
82 |
18 |
– |
|
3 |
3 |
– |
60 |
40 |
30 |
70 |
– |
|
TiO2:Шары = 1:15 |
|||||||
|
4 |
0,5 |
– |
65 |
35 |
20 |
80 |
– |
|
5 |
1 |
60 |
10 |
30 |
97 |
3 |
– |
|
6 |
3 |
15 |
35 |
50 |
70 |
30 |
– |
Таблица 3
Поверхностные свойства диоксида титана
|
№ образцов (как в табл. 3) |
TiO2, % |
Рутил, % |
Sуд, м2/г |
Vпор, см3/г |
Dпор, нм |
|
2 |
98,2 |
82,0 |
1,73 |
0,032 |
23,8 |
|
5 |
98,4 |
97,0 |
5,10 |
0,055 |
27,8 |
Известны три структурные модификации диоксида титана: анатаз, рутил и брукит. Первые две наиболее широко известны и являются продукцией, выпускаемой в промышленном масштабе [7]. Рутил обладает более стабильной структурой по сравнению с анатазом. Поэтому использование рутила в составе многих функциональных материалов гарантирует стабильность их свойств. Авторы провели исследования по получению диоксида титана рутильной модификации из анатаза без использования сложной «жидкофазной» технологии, реализуемой в современных промышленных условиях.
Исследования по твердофазному структурированию анатаза с перекристаллизацией его в рутил проводили по схеме: прокаливание АТС (700 °С) – МА анатаза – термолиз (800 °С).
Изучено влияние продолжительности механоактивации и количества в мельничном барабане шаров на содержание в получаемых образцах рутила. Определяли фазовый состав промежуточных и конечных продуктов, образующихся при проведении экспериментов (табл. 2).
За промежуток времени 1 ч при МА достигается наибольшая степень активизации твердых частиц, проявляющейся в уменьшении их размера и в частичном деструктурировании анатаза. Порошок представляет собой смесь анатаза, рутила и фазы приближенной к структуре брукита. Некоторые авторы считают, что эта фаза является промежуточной, кристаллизуется из анатаза под действием давления и удара, что имеет место при механоактивации. Количество брукита больше в том случае, когда измельчение проходило при большем количестве шаров. Температурная обработка (800 °С) образцов после МА приводит к упорядочиванию структурных дефектов, приобретенных при механоактивации, и тем самым к снижению плотности свободного заряда на поверхности частиц. В конечных образцах метастабильная фаза подобная брукиту отсутствует. Можно предположить, что именно эта фаза является матрицей для структурирования рутила. Определены поверхностные свойства порошков (табл. 3), полученных по схеме, приведенной выше.
Повышение количества шаров в мельнице при измельчении анатаза повышает степень структурной перестройки анатаза в рутил. При этом почти в 3 раза увеличивается удельная поверхность частиц порошка.
Выводы
Изучены механизм и кинетика твердофазных процессов, протекающих при микроизмельчении кристаллических веществ или их смесей в высокоскоростных измельчителях, в частности в планетарных мельницах. Показано, что помимо уменьшения своего размера частицы претерпевают и структурно-морфологические преобразования, что способствует повышению реакционной способности образующихся при механоактивации кристаллитов.
На примере механоактивации смеси, состоящей из сульфата титана TiO(SO4).H2O и сульфата аммония, проводимой в планетарной мельнице, показано, что процесс механоактивации компонентов сопровождается химической реакцией с образованием комплексного соединения, состав которого соответствует формуле (NH4)2TiO(SO4)2.Н2О. Найдены характеристики проведения твердофазного синтеза при условии стехиометрического соотношения названных компонентов.
На основании данных рентгенофазового анализа проведен расчет изменения размера кристаллитов, что послужило основой для обоснования кинетики и механизма процессов, происходящих при механоактивации. Для обоснования положительного влияния механоактивации на химическую активность твердых частиц проведен расчет изменения микроискажений структуры кристаллитов с применением метода аппроксимации, который основан на использовании функции псевдо-Фойгта.
На примере механоактивации метастабильной фазы диоксида титана (анатаз) показана возможность перестройки его структуры с образованием промежуточной фазы, близкой к структуре брукита, при термолизе которой формируется рутил.
Экологически безопасные технологические приемы, основанные на твердофазных процессах, могут быть использованы для усовершенствования известных технологий.



