Большое внимание в мире уделяется возможности комплексной переработки биомассы различного типа в ценные продукты, а также разработке следующих поколений биотоплива из лигноцеллюлозного сырья, не представляющего пищевой ценности для человека [5, 14]. Лигноцеллюлозное сырье может быть представлено в виде древесины и отходов ее переработки, отходов сельского хозяйства (солома и шелуха злаковых культур), различных энергетических культур. Установлено, что лигноцеллюлоза насчитывает около 50 % в год от биомассы в мире (10–50 миллиардов тонн) [15]. В качестве инновационных источников легковозобновляемой биомассы для получения биоэтанола могут рассматриваться энергетические растения (с высокой урожайностью и малыми затратами на выращивание) и отходы сельскохозяйственной переработки – вторичное сырье, получение которых окупается производством зерна [1, 10].
В отличие от пищевого сырья (представляющего собой сахаро- или крахмалосодержащее сырье) использование лигноцеллюлозной биомассы в качестве источника сырья для получения биоэтанола имеет трудности, заключающиеся в ее сложной структуре, для разрушения которой необходима предварительная химическая обработка сырья [9, 12]. Процесс биоконверсии сырья в биоэтанол может включать в себя как последовательные технологические стадии осахаривания и сбраживания (separate hydrolysis and fermentation), так и одновременные стадии осахаривания-сбраживания (simultaneous saccharification and fermentation), известные в мировом научном сообществе как SHF и SSF процессы соответственно [11]. Одним из главных преимуществ SHF (последовательного процесса) является возможность для ферментных препаратов и микроорганизмов работать при их оптимальных условиях. Однако недостатком последовательного проведения стадий является его длительная продолжительность, поэтому в настоящее время SSF (одновременный процесс) становится центром большинства научно-исследовательских работ, в качестве альтернативы последовательному процессу [13]. Преимуществом данного процесса является проведение стадий осахаривания-сбраживания в одном реакторе, уменьшение продолжительности технологических стадий и энергозатрат. Также известно, что при одновременном процессе при внесении продуцентов биоэтанола редуцирующие вещества начинают отводиться из системы и расходоваться на синтез биоэтанола, таким образом, равновесие ферментативной реакции гидролиза целлюлозы постоянно смещается в сторону образования продуктов реакции (глюкозы). Этим достигается интенсификация процесса осахаривания [6]. Тем не менее одновременный процесс имеет некоторые недостатки: различие оптимальных температур для действия ферментов на стадии осахаривания (45–50 °С) и культивирования микроорганизмов (28–30 °С) [11]. Мискантус (М) – перспективное энергетическое растение с высокой продуктивностью, быстрым ростом и устойчивостью к заболеваниям, которое может успешно выращиваться по всей территории страны, включая континентальную Сибирь [3, 8], плодовые оболочки овса (ПОО) являются видами «концентрированного» целлюлозосодержащего сырья, сосредоточенного в крупных промышленных центрах и распространенного по всей России [4]. Переработка такого сырья требует значительно меньше энергозатрат, так как мискантус измельчается в сечку в одну стадию, а плодовые оболочки овса – природный коротковолокнистый материал, не требующий дополнительного измельчения.
Целью данной работы являлось исследование возможности совмещения технологических стадий осахаривания-сбраживания для получения биоэтанола с высоким выходом на гидролизных средах из целлюлозной части злаковых культур.
Материалы и методы исследования
Определение основных характеристик сырья (массовой доли (м.д.) целлюлозы по Кюршнеру, м.д. пентозанов, м.д. кислотонерастворимого лигнина, зольность) проводилось по стандартным методикам. Характеристики представлены на рисуноке а, б.
Наработка субстратов проводилась на опытном производстве ИПХЭТ СО РАН. Щелочная делигнификация заключалась в обработке сырья 4 %-ным раствором гидроксида натрия при атмосферном давлении, температуре 90–96 °С в течение 8 ч для мискантуса и 4 ч для ПОО, в результате были получены волокнистые продукты (ВП) из мискантуса и плодовых оболочек овса Химический состав полученных субстратов представлен в табл. 1.
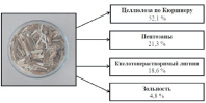
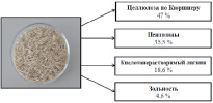
а б
Основные характеристики сырья: а – мискантус и его химический состав; б – плодовые оболочки овса и их химический состав
Таблица 1
Характеристики субстратов, полученных из мискантуса и плодовых оболочек овса
|
Характеристики |
Массовая доля, % |
|
|
ВП М |
ВП ПОО |
|
|
Целлюлоза по Кюршнеру |
83,8 |
89,0 |
|
Пентозаны |
8,3 |
5,8 |
|
Кислотонерастворимый лигнин |
3,2 |
4,5 |
|
Зольность |
4,8 |
0,63 |
|
Сумма гидролизуемых компонентов, % |
92,1 |
93,5 |
После щелочной делигнификации субстраты были промыты до нейтральной реакции и отжаты на фильтр-прессе. Технологические стадии осахаривания-сбраживания проводились в колбах Эрленмейера емкостью 1000 мл в водной среде, при концентрации субстрата 60 г/л в пересчете на абсолютно сухое вещество. В работе использовались промышленно доступные ферментные препараты «Целлолюкс-А» (производитель ПО «Сиббиофарм», Бердск) и «Брюзайм BGX» (производитель «Polfa Tarchomin Pharmaceutical Works S.A.», Польша, для компании «Diadic International Inc.», США). Препарат «Целлолюкс-А» позиционируется на рынке как целлюлаза для расщепления некрахмалистых полисахаридов, «Брюзайм BGX» – как гемицеллюлаза. Ферментные препараты были внесены в избытке – в 1,5 раза больше. Температура ферментативного гидролиза составила 46–47 °С. Продолжительность стадии осахаривания составила 24 ч, после этого среда охлаждалась до 28 °С, вносились засевные дрожжи и в течение трех последующих суток проводилось сбраживание, совмещенное с осахариванием, при этом активная кислотность поддерживалась вручную на уровне 4,7–5,1.
Концентрация редуцирующих веществ (РВ) в пересчете на глюкозу определялась спектрофотометрически с помощью реактива на основе 3,5-динитросалициловой кислоты на «UNICO UV-2804». Выход редуцирующих веществ (РВ) рассчитан с учетом коэффициента 0,9, обусловленного присоединением молекулы воды к ангидроглюкозным остаткам соответствующих мономерных звеньев в результате ферментативного гидролиза.
Полученные после стадии осахаривания ферментативные гидролизаты из ВП мискантуса и плодовых оболочек овса сбраживались с помощью дрожжей Saccharomyces сerevisiae Y-1693 (ФГУП «ГосНИИГенетика», г. Москва), штамм является устойчивым к вредным примесям гидролизатов [7]. Доза инокулята составляла 10 %. Объемная доля спирта в бражках определялась ареометром в дистилляте, полученном перегонкой спирта из бражки согласно ГОСТ Р 51135-2003. По крепости полученных бражек и концентрации РВ в исходной среде рассчитывался выход биоэтанола.
Анализ этанола выполнен методом газожидкостной хроматографии (ГЖХ) по ГОСТ Р 51786-2001 на газовом хроматографе с пламенно-ионизационным детектором «Кристалл – 2000М» фирмы «СКБ Хроматэк», г. Йошкар-Ола, Россия; условия эксперимента: колонка газохроматографическая капиллярная ZB-FFAP (США) 50 м×0,32 мм×0,52 мкм, температура детектора 220 °С, температура испарителя 190 оС, выдержка пробы при температуре 77 °С длительностью 6 мин 30 с, затем нагрев со скоростью 10 °С/мин до температуры 210 °С, выдержка 15 мин, коэффициент деления потока 40:1, газ-носитель – азот сжатый, давление газа-носителя (азота) 77 кПа, соотношение воздух: водород равно 250:25; построение калибровочного графика по градировочным смесям – государственным стандартным образцам; расход газа (сброс) – 30 мл/мин, расход газа (поддув в ПИД) – 30 мл/мин, расход газа (водород в ПИД) – 20 мл/мин, расход газа (воздух ПИД) – 200 мл/мин, объем пробы 1 мкл.
Результаты исследования и их обсуждение
Как следует из данных, представленных на рисунке и в табл. 1, предварительная химическая обработка обоих видов сырья разбавленным раствором гидроксида натрия позволяет снизить содержание кислотонерастворимого лигнина в 4–5,8 раза, пентозанов – в 2,5–6,1 раза, но при этом для ВП мискантуса зольность не изменилась, а для ВП плодовых оболочек овса зольность снизилась в 7,3 раза. Сумма гидролизуемых компонентов для двух субстратов примерно равна и составляет 92,1 % для ВП М и 93,5 % для ВП ПОО. Результаты спиртового брожения для волокнистого продукта из мискантуса и плодовых оболочек овса представлены в табл. 2. Ранее были проведены исследования последовательного процесса осахаривания-сбраживания [2].
Таблица 2
Результаты спиртового брожения для продукта щелочной делигнификации из мискантуса и плодовых оболочек овса
|
Показатель |
Субстрат |
|
|
ВП М |
ВП ПОО |
|
|
Концентрация РВ в ферментативном гидролизате, г/л |
43,0 |
32,6 |
|
Крепость бражки, об. % |
1,8 |
1,8 |
|
Остаточная концентрация РВ в бражке, г/л |
7,0 |
2,1 |
|
Выход биоэтанола из 1 т сырья, дал |
14,9 |
10,3 |
После проведенной стадии осахаривания установлено, что выход редуцирующих веществ при расчете от массы субстрата для ВП М составил 64,5 %, что выше значения для субстрата ВП ПОО, 48,9 %. Полноту сбраживания косвенно характеризует остаточная концентрация редуцирующих веществ в бражках, для обоих гидролизатов этот показатель невысокий и составляет 2,1–7 г/л, что свидетельствует о биологической доброкачественности гидролизных сред. На стадии сбраживания полученные крепости бражек для обоих видов сырья совпадают и составляют 1,8 об. %, что отличается от крепостей бражек, получаемых химических гидролизатов древесины равных 1,0–1,5 об. %. Этот факт подтверждает перспективность применения именно ферментативного способа получения гидролизатов из целлюлозосодержащего сырья. Для обоих видов сырья получены сопоставимые результаты на стадиях осахаривания и сбраживания, но больший выход ВП мискантуса при его получении из сырья (химической обработкой гидроксидом натрия) определяет больший суммарный выход биоэтанола из единицы сырья для ВП М (14,9 дал/т против 10,3 дал/т для ВП плодовых оболочек овса).
Таблица 3
Содержание примесей в этиловом спирте из непищевого сырья и опытных образцах биоэтанола
|
Показатель |
Спирт этиловый технический |
Опытные образцы биоэтанола |
||
|
марки А ОКП 91 8213 1100 |
марки Б ОКП 91 8213 1200 |
ВП М |
ВП ПОО |
|
|
Массовая концентрация альдегидов, в пересчёте на безводный спирт, мг/дм3 |
< 200 |
< 350 |
1100 ± 300 |
7100 ± 200 |
|
Массовая концентрация сивушного масла, в пересчёте на безводный спирт, мг/дм3 |
< 500 |
< 1000 |
4000 ± 200 |
2700 ± 100 |
|
Массовая концентрация эфиров, в пересчёте на безводный спирт, мг/дм3 |
< 80 |
< 180 |
1300 ± 200 |
800 ± 200 |
|
Содержание метанола в пересчёте на безводный спирт, об. % |
< 0,1 |
< 0,1 |
0,008 ± 0,001 |
0,005 ± 0,001 |
Содержание примесей в спирте этиловом техническом и опытных образцах биоэтанола представлено в табл. 3. При хроматографировании опытных образцов биоэтанола было выявлено, что последовательность выхода обнаруженных веществ соответствует действующей нормативной документации: этиловый эфир, уксусный альдегид, ацетон, метилацетат, этилацетат, метанол, 2-пропанол, этанол, 2-бутанол, 1-пропанол, кротональдегид, изобутиловый спирт, 1-бутанол, изоамиловый спирт, 1-пентанол, 1-гексанол. Присутствие в следовых количествах ацетона, 2-бутанола и кротональдегида идентифицирует этанол как непищевой.
Довольно высокая по сравнению с техническим спиртом марок А и Б и спиртом-сырцом из пищевого сырья концентрация альдегидов в опытных образцах биоэтанола 1100 мг/дм3 для биоэтанола из ВП мискантуса и 7100 мг/дм3 для биоэтанола из ВП плодовых оболочек овса связана с природой сырья и не обусловлена технологией получения, поскольку исключено накопление фракции альдегидов (фурфурола и оксиметилфурфурола) в процессе ферментативного гидролиза, так как процесс проводился при температуре (46 ± 2) °С и рН 4,7.
Содержание сивушного масла и эфиров в опытных образцах превышает нормы для технического этилового спирта, это объясняется тем, что опытные образцы не подвергались ректификации.
Важно отметить, что в обоих образцах объёмная доля метанола крайне мала: 0,005–0,008 об. %, что намного ниже 0,1 об. %, регламентированных для спирта этилового технического.
Выводы
По результатам данной работы показано, что на стадии осахаривания путем ферментативного гидролиза в водной среде при использовании промышленно доступных ферментных препаратов «Целлолюкс-А» и «Брюзайм BGX» можно получить доброкачественные гидролизаты для дальнейшего микробиологического синтеза в биоэтанол. Исследован одновременный процесс осахаривания-сбраживания для получения биоэтанола на среде ферментативных гидролизатов. Показано, что оба ферментативных гидролизата являются биологически доброкачественной средой для синтеза биоэтанола. На гидролизных средах продуктов щелочной делигнификации из мискантуса и плодовых оболочек овса при использовании продуцента Saccharomyces сerevisiae Y-1693 получен биоэтанол. Выход биоэтанола составил 14,9 дал из 1 т мискантуса и 10,3 дал из 1 т плодовых оболочек овса. Выявлено, что опытные образцы биоэтанола характеризуются низким содержанием метанола – 0,005–0,008 об. %, что обусловлено глубокой подготовкой субстратов и получением гидролизатов ферментативным путем в мягких условиях. Полученные результаты могут быть рекомендованы для масштабирования процесса по объему.



