Создание неподдерживаемых жидких мембран для транспортировки железа (II) и кобальта (II) имеет большие перспективы в очистке пластовых вод от этих металлов. Учитывая большое прикладное значение этой проблемы в решении широких экологических, химотологических и социальных аспектов [1] нами проведен поиск в области создания высокоэффективных жидких мембран, способных транспортировать ионы железа (II) и кобальта (II) с высокой скоростью.
Существующие технологические методы во многих случаях не приемлемы в производстве из-за экономических и технологических причин. Особенно это относится к нефтям и пластовым водам, в которых ядовитые тяжелые металлы находятся в малом количестве.
В связи с этим нами предложен и изучен метод ионного транспорта тяжелых металлов с использованием многокомпонентных жидких мембран, которые имеют большие перспективы для создания технологического процесса очистки нефтей и пластовых вод [2, 3].
В данной работе приведены результаты исследований по транспорту ионов железа через жидкие мембраны, ионов железа (II) и кобальта (II) в виде тетрароданидных анионных комплексов.
Сущность метода заключается в том, что при добавлении к раствору соли железа (II) и кобальта (II) роданида аммония образуется комплексное соединение ((КЭNH4)2[Me(SCN)4] Me-Fe, Co), в котором металл находится в анионном комплексе, т.е. ионы железа (II) и кобальта (II) транспортируются в виде анионного комплекса, при контакте его водного раствора с жидкой мембраной, состоящей из хлороформа, олигомерного Краун-эфира (КЭ) и диэтилфталата (ДЭФ) в U-образном реакторе, описанном в работе [4].
Цель исследования – исследования активности транспорта и комплексообразования отмеченных ионов в металлах.
Материалы и методы исследования
В работе были использованы реагенты марки хч: NH4SCN, FeCl2, CoCl2 хлороформ, олигомерный дибензо-16-краун-5 (полученный при тетрамеризации 6-глицидилок-си-16-краун-5) и диэтилфталат.
Концентрация железа определялась методом атомно-адсорбционной спектроскопии (PerkinElmer 603 spectrophotometer).
Концентрация комплексных анионов тетрароданид железа (II) и кобальта (II) определялась методом ультрафиолетовой спектроскопии с применением спектрофотометра BekmanActa. Коэффицент распределения, определенный прямым калиброванием водных растворов анионного комплекса [Fe(SCN)4]2– и [Co(SCN)4]2–, составлял 1,42·10–4 при 462 нм.
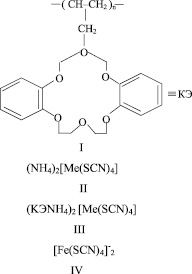
Коэффициент распределения комплексного аниона тетрамерного Краун-эфира (I) в диэтилфталате составил 1,80·10–4. Для нахождения этой величины из водного раствора экстрагируется комплексное соединение диэтилфталатным раствором краун-эфира (I) и концентрация его в диэтилфталатной фазе определена методом спектроскопии УФ-излучения по поглощению при 487 нм.
Установлено, что при контактировании хлоформного раствора Краун-эфира I с водой, КЭ I распределяется в хлороформе в 3700 раз больше, чем в воде. При этих условиях допускается, что КЭ по существу полностью переходит в хлороформную фазу с эквивалентным количеством Ме (II)-тетрароданид аммония (II), который образует с Краун-соединением I комплекс типа гость-хозяин III. Поэтому определение в обоих слоях комплексного аниона Ме (II)-тетрароданид IV позволяет найти концентрацию свободного краун-эфира как в мембранной, так и в водных фазах.
Эксперименты с использованием жидкой мембраны проводились в U–образном стеклянном реакторе, описанном в работе [4].
Жидкая мембранная фаза приготовлена путем перемешивания соответствующих количеств хлороформа, диэтилфталата и краун-эфира в течение 15 мин. Приготовленная жидкая мембрана помещается в U-образный реактор. В левое колено наливается заранее приготовленный водный раствор Ме (II) тетрароданид аммония, а в правое колено - дистиллированная и дионизированная вода. Мембранная фаза перемешивалась магнитной мешалкой, а левое и правое колено механическими мешалками. Все работы выполнялись при температуре 30 + 1 °С. Образцы были анализированы в начале и в конце работы, чтобы проверить материальный баланс по Ме (II)-тетрароданид аммониевому комплексу II. Образцы водного раствора II, взятые из левого колена, анализированы при регулярных интервалах времени по комплексному аниону Ме (II)-тетрароданид (IV). В большинстве случаев транспорт комплекса II контролировался методом УФ-спектроскопии.
Результаты исследования и их обсуждение
Транспорт комплексного аниона IV из водного раствора ((NH4)2[Me(SCN)4] Me-Fe, Co) через жидкие мембраны, содержащего Краун-эфир I, исследовался как функция концентраций диэтилфталата и изучаемого макроциклического соединения в жидкой мембране. Комплексный анион [Me(SCN)4]2– нами подобран потому, что такие анионы имеют высокую скорость транспорта. Влияние различных факторов на кинетику транспорта через жидкую мембрану выражено через концентрацию комплексного аниона [Fe(SCN)4]2–. Кинетика транспорта комплексного соединения (NH4)2[Fe(SCN)4] представлена на диаграмме (рис. 1), которая описывает влияние добавки Краун-соединения 5 к мембранной фазе, содержащего 10 % мас. диэтилфталата.
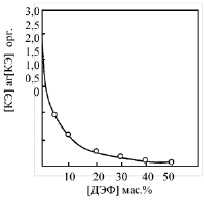
Рис. 1. Влияние концентрации олигомерного Краун-эфира I в жидкой мембране на кинетику, описывающую мембранный транспорт (NH4)2[Fe(SCN)4
[ДЭФ] = 10 мас. %; [КЭ] = 2 мас. %; [КЭ] = 10 мас. %; [КЭ] = 0.
В отсутствие Краун-соединения I в сущности комплексный анион IV не транспортируется. Этот результат подтверждается опубликованными литературными данными [5, 6], ясно демонстрирующими роль макроциклических носителей в ускорении межфазного переноса комплексного аниона. Другая графическая зависимость (рис. 2), описывающая влияние краун-эфирной добавки к мембранной фазе, показывает, что хотя максимум (6 %) первоначально присутствующего аниона IV был перенесен через мембрану против течения, ион-транспорт имеет явное нестабильное состояние, характеризующее продолжительное уменьшение скорости транспорта, если даже градиент концентрации закомплексованного Ме (II)-тетрароданид аммония (II), регулирующий транспорт, мог уменьшиться до 6 %.
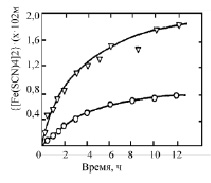
Рис. 2. Влияние концентрации олигомерного Краун-эфира I в жидкой мембране на кинетику мембранного транспорта (NH4)2[Fe(SCN)4
Графическая зависимость, описывающая транспорт в присутствии 10 % мас. тетрамерного Краун-эфира I, должна быть линейной с наклоном в раз больше наклона соответствующей диаграммы, характеризующей транспорт в присутствии 2 мас. процента этого Краун-соединения. Такое исключение основывается на допущении о том, что Краун соединение I более мобильное и быстро комплексуется с Ме (II)-тетрароданидом аммония (II) на контактирующих поверхностях между мембранной и водной фазами. В дальнейшем допускалось, что распределение образцов Краун-соединения I между мембранной фазой и водой является мгновенным и изменчивым по времени и по концентрации Краун-эфира. В связи с этим проводилось измерение влияния компонентов, содержащихся в хлороформной фазе на определение коэффициента распределения Краун-соединения I между соответствующими фазами. Полученные результаты представлены в виде графика на рис. 3.
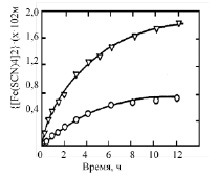
Рис. 3. Влияние сверх насыщенности водной фазы с олигомерным Краун-соединением I на кинетику, описывающую транспорт (NH4)2[Fe(SCN)4] через жидкую мембрану
[ДЭФ] = 10 мас. %; [КЭ] – 2 мас. %; [КЭ] = 0,64 мас. % (сверх насыщенные водные фазы с краун-эфирами).
График показывает зависимость между коэффициентом распределения, носителя (Краун-эфира I) при добавлении диэтилфталата возрастает в направлении мембранной фазы (хлороформный слой). Поскольку коэффициент распределения не является чрезвычайно большим в благосклонности хлороформа относительно водных фаз, даже при относительно высоких содержаниях диэтилфталата в хлороформе, огромное обьемное соотношение водная фаза мембранная фаза (6900) может быть серьезным основанием истощения мембранной фазы по Краун-эфиру I
Данные, представленные на рис. 4, описывающие влияние добавок диэтилфталата, наводят на мысль не ожидающейся траектории неидеальных свойств. Более важно, экспериментальная работа, включающая 2 мас. % Краун-соединения I в отсутствие диэтилфталата указывала, что ДЭФ является критически важным для контролирования транспортного явления, поскольку очень мало транспорта ионов осуществлялось при этих ограниченных условиях.
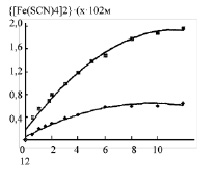
Рис. 4. Влияние концентрации ДЭФ в жидкой мембране на кинетику транспорта (NH4)2(SCN)4
Более того, с увеличением концентрации ДЭФ наблюдается монотонное увеличение скорости транспорта, хотя ограниченный транспорт является нестабильным состоянием целого направления эксперимента.
Выводы
1. Жидкомембранные эксперименты выполнялись с систематически меняющимися составами жидких мембран, включая Краун-соединение в качестве носителя и различные соотношения диэтилфталата и хлороформа. Распределение образцов Краун-эфира в мембранной фазе значительно увеличилось с добавкой диэтилфталата (ДЭФ) к хлороформу.
2. Уменьшение количества ДЭФ в жидкой мембранной фазе приводит к уменьшению распределения носителя и комплексов носителя по отношению мембранной фазы к контактируемым водным фазам.
3. Уменьшение концентрации носителя в мембранной фазе приводит к поступательному уменьшению градиента концентрации комплекса носителя.
4. Скорость транспорта железа (II) тетрароданида аммония уменьшалась в течение проведения эксперимента. Полученные экспериментальные данные доказывают что отмеченные ионы Fe (II) и Co (II) отличаются по активности транспорта и комплексообразования отмеченных ионов в металлах с олигомером I находящихся в ряду: Co > Fe, сосредотачивают внимание на важную практическую проблему неограниченного распределения носителя и ключевого растворителя между мембранной фазой и контактирующимися водными фазами. Тонкое изменение в коэффициенте распределения носителя заметно подвергает опасности эффективность процесса, поскольку объемное соотношение водной и мембранной фаз является огромным.



