Наночастицы металлов (НЧ) проявляют уникальные оптические [12], электромагнитные [4] и химические свойства [1], зависящие от природы металла и размера частиц. В настоящее время наночастицы золота интенсивно изучаются в качестве препаратов для диагностики (визуализации) и терапии рака [6]. Следует отметить, что за счет высокого соотношения поверхностного объема частицы к энергии поверхности наночастицы могут проявлять каталитическую [5] и фотокаталитическую [13] активность, а также обладать уникальными электрохимическими свойствами [3]. Актуальной задачей супрамолекулярной химии является изучение возможности воздействия на частицы с помощью УФ и видимого излучения; обычно для этого используют наночастицы, ковалентно модифицированные фотохромными молекулами. Под действием УФ-излучения происходит изменение геометрии фотохромной молекулы, что обычно приводит к неуправляемой агрегации частиц [10]. В последнее время фотохромные спиропираны привлекают внимание для создания на их основе новых динамических материалов [9], за счет их способности переходить из «закрытой» формы спиропирана в «открытую» – мероцианиновую, под действием света, температуры, механического воздействия, а также в присутствии катионов металлов (рис. 1).
Целью данной работы являлся синтез новых лигандов на основе фотохромных спиропиранов, изучение их физико-химических свойств, а также изучение возможности модификации поверхности золотых наночастиц полученными лигандами.
Результаты исследования и их обсуждение
Синтез и спектральные свойства спиропиранов 1 и 2
В качестве лигандов для адсорбции на поверхности золотых наночастиц были выбраны спиропираны, содержащие фрагменты липоевой кислоты в различных положениях спиропирана: индолиновом и арильном фрагментах в случае спиропирана 1, и только в индолиновом фрагменте в случае спиропирана 2 (рис. 2). Наиболее перспективными для исследования представляются спиропираны индолинового ряда, содержащие нитрогруппу в положении 6 (рис. 1), за счёт образования устойчивой мероцианиновой формы в полярных растворителях [14].
Исходные соединения 3 и 4 для синтеза спиропиранов 1 и 2 были получены по описанным в литературе методам [7]. Введение в целевые молекулы фрагментов липоевой кислоты осуществляли в условиях карбодиимидного синтеза в присутствии ДЦК (дициклогексилкарбодиимид) и ДМАП (4-диметиламинопиридин) в ТГФ [8]. Выход спиропиранов 1 и 2 составил соответственно 15 и 23 % после хроматографической очистки на сорбенте силикагель. Строение продуктов было подтверждено данными ЯМР 1Н спектроскопии и масс-спектрометрии высокого разрешения.
С целью изучения возможности фотоизомеризации спиропиранов 1 и 2 под действием УФ-излучения полученные вещества были исследованы с помощью спектроскопии поглощения и флуоресценции в УФ и видимой области. На рис. 3 приведены спектры поглощения раствора спиропирана 1 в этаноле. Исходная закрытая форма спиропирана поглощает только в УФ области спектра; однако при облучении раствора спиропиранаУФ-светом с длиной волны 365 нм мощностью 3 Вт в течение 15 минут происходит раскрытие спиропиранового кольца с образованием открытой мероцианиновой формы; при этом в спектре появляется полоса поглощения в видимой области с максимумом поглощения при 554 нм (рис. 3).
При облучении раствора видимым светом с длиной волны 560 нм для соединения 1 наблюдается появление флуоресценции с максимумом поглощения испускаемого излучения при 651 нм (рис. 4).
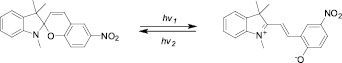
Рис. 1. Раскрытие и закрытие спиропиранового цикла под действием УФ-света
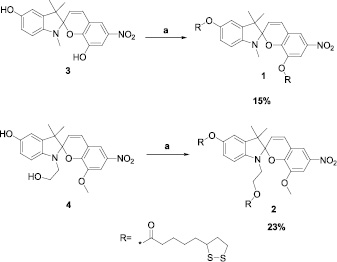
Рис. 2. Схема синтеза спиропиранов 1 и 2. Условия и реагенты: а – липоевая кислота, ДЦК/ДМАП, ТГФ
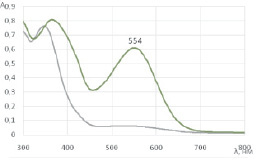
Рис. 3. Спектры поглощения спиропирана 1 в этаноле (2?10–4 М) до () и после (---)УФ-облучения (365 нм, 3 Вт, 15 минут)
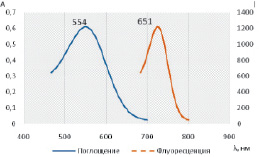
Рис. 4. Спектры поглощения () и флуоресценции (---) спиропирана 1 в этаноле (2?10–4 М, λвозб = 560 нм)
Также в ходе работы была исследована обратимость фотопереключения спиропирана 1 в этаноле. Для этого раствор спиропирана последовательно облучали УФ-светом (365 нм, 3 Вт, 15 минут) а затем светом лампы накаливания (500 Вт, 1 минута), повторяя эту последовательность облучения несколько раз. Полученные результаты представлены на рис. 5. Как видно из рис 5, спиропиран 1 обладает хорошей реверсивностью закрытой формы в открытую (мероцианиновую) в течение семи циклов «переключения».
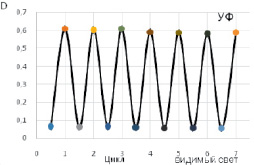
Рис. 5. Изменение оптической плотности раствора спиропирана 1 в результате многократного последовательного облучения УФ-светом (365 нм, 3 Вт, 15 минут), а затем светом лампы накаливания (500 Вт, 1 минута)
Синтез модифицированных наночастиц золота
Исходные наночастицы золота были синтезированы по методу Туркевича [2] из золотохлористоводородной кислоты (HAuCl4) восстановлением цитратом натрия, который одновременно выступает в качестве стабилизирующего лиганда. По данным просвечивающей электронной микроскопии (ПЭМ) были получены сферические наночастицы средним размером 12 ± 2 нм. Для модификации наночастиц золота использовали спиропираны 1 и 2, содержащие фрагменты липоевой кислоты. Известно, что производные липоевой кислоты способны адсорбироваться на поверхности НЧAu с образованием устойчивых ковалентных связей Au-S [11]. На рис. 6 приведены ПЭМ микрофотографии НЧAu, модифицированных спиропиранами 1 (рис. 6, а) и 2 (рис. 6, б), а также распределение по размеру наночастиц, модифицированных спиропираном 1.

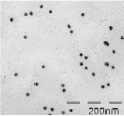
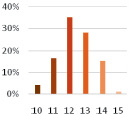
а б в
Рис. 6. Микрофотографии ПЭМ наночастиц золота, модифицированных спиропиранами 1 (а) и 2 (б), и диаграмма размерного распределения наночастиц, модифицированных спиропираном 1 (в)
Как видно, в случае с частицами, модифицированными спиропираном 1, преимущественно образуются димерные агрегаты (62 %), чего не наблюдается для частиц, модифицированных спиропираном 2. Очевидно, такое различие связано с геометрическим строением спиропиранов. В молекуле спиропирана 1 фрагменты липоевой кислоты расположены на значительном расстоянии друг от друга, и поэтому способны адсорбироваться на двух различных наночастицах, в то время как в спиропиране 2 оба фрагмента липоевой кислоты присоединены к индолеиновому фрагменту спиропирана и способны поэтому адсорбироваться только на одной НЧAu. Расстояние между двумя наночастицами в димерах, показанных на рис. 6, а, составляет ~2 нм; эта величина хорошо согласуется с расстоянием между дисульфидными фрагментами спиропирана 1, рассчитанным в программе HyperChem методом PM3 (21 Å), что подтверждает адсорбцию спиропирана 1 на двух соседних наночастицах золота.
Экспериментальная часть
Контроль за ходом реакций осуществлялся методом тонкослойной хроматографии на закрепленном слое силикагеля (Merck). Температуры плавления определяли в блоке с открытым капилляром. Спектры ЯМР 1Н были зарегистрированы на приборе BrukerAvance с рабочей частотой 400 МГц. В качестве растворителя использовали дейтерированные растворители (CDCl3 и DMSO-d6). Химические сдвиги приведены в миллионных долях по шкале δ относительно гексаметилдисилоксана как внутреннего стандарта. Масс-спектры высокого разрешения были зарегистрированы на приборе BrukermaXis методом электрораспылительной ионизации (ESI). Измерения выполнены на положительных (напряжение на капилляре – 4500 V) ионах. Диапазон сканирования масс – m/z 50 – 3000 Да, калибровка – внешняя (ElectrosprayCalibrantSolution, Fluka). Использовался шприцевой ввод вещества для растворов в метаноле, скорость потока – 3 мкл/мин. Газ-распылитель – азот (4 л/мин), температура интерфейса – 180 °C.Электронные спектры в УФ- и видимой области регистрировали на приборе HitachiU-2900. Спектры флуоресценции регистрировали на приборе SpectraMaxM5.
Синтез 1’,3’,3’-триметил-6-нитроспиро[хромен-2,2’-индолин]-5’,8-диил бис-5-(1,2-дитиолан-3-ил)пентаноата 1
В 10 мл ТГФ растворили 280 мг (1,36 ммоль) липоевой кислоты, 200 мг (0,57 ммоль) 1’,3’,3’-триметил-6-нитроспиро[хромен-2,2’-индолин]-5’,8-диола 3, 350 мг (1,7 ммоль) ДЦК, реакционную смесь охладили до 0ОС, затем по каплям добавили 200 мг (1,64 ммоль) ДМАП в 2 мл ТГФ. Смесь перемешивали в течение 1 часа при 0 °С, затем 3 часа при комнатной температуре. Выпавшую мочевину отфильтровали, фильтрат промыли водой (10 мл), сушили над Na2SO4. Растворитель отгоняли при пониженном давлении, полученный продукт очищали методом колоночной хроматографии на силикагеле (Merck) c размером частиц 60–200 Å в системе CH2Cl2/гексан = 1/10 c градиентом к CH2Cl2 в отсутствии света. Продукт представляет собой масло темно-коричневого цвета. Выход продукта составил 50 мг (12 %). Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м.д.): 7,97 (д, J = 2,54 Гц, 1 H, Ar), 7,85 (д, J = 2,54 Гц, 1 H, Ar), 6.99 (д, J = 9,98 Гц, 1 H, C = CH–Ar), 6,88 (дд, J = 8,12; 2,05 Гц, 1 H, Ar), 6,83 (м, 1 H, Ar), 6,50 (д, J = 8,22 Гц, 1 H, Ar), 5,92 (д, J = 10,17 Гц, 1 H, HC = C–Ar), 3,66–3,61 (м, 2 H, CH2), 3,58–3,52 (м, 2 H, CH2), 3,25–3,12 (м, 2 H, CH2), 2,59 (т, J = 7,53 Гц, 3 H, CH3–N), 2,54–2,45 (м, 2 H, CH2), 2,23–2,08 (м, 2 H, CH2), 2,00–1,89 (м, 2 H, CH2), 1,85–1,74 (м, 4 H, CH2), 1,65–1,55 (м, 2 H, CH2), 1,36–1,20 (м, 10 H, (CH3)2C, CH2), 0,92–0,80 (м, 4 H, CH2). HRMS (m/z): [MH+], для C35H42N2O7S4рассч.: 731,1948; найдено: 731,1980.
Синтез 2-(5’-((5-(1,2-дитиолан-3-ил)пентаноил)окси)-8-метокси-3,3’-диметил-6-нитроспиро(хромен-2,2’-индолин)-1’-ил)этил 5-(1,2-дитиолан-3-ил)пентаноата 2
В 10 мл ТГФ растворили 265 мг (1,35 ммоль) липоевой кислоты, 210 мг (0,54 ммоль) 1’-(2-гидроксиэтил)-8-метокси-3’,3’-диметил-6-нитроспиро[хромен-2,2’-индолин]-5’-ола 4, 320 мг (1,55 ммоль) ДЦК, реакционную смесь охладили до 0 °С, затем прикапали раствор 180 мг (1,64 ммоль) ДМАП в 2 мл ТГФ. Смесь перемешивали в течение 1 часа при 0 °С, затем 60 часов при комнатной температуре. Выпавшую мочевину отфильтровали, фильтрат промыли водой (10 мл), сушили над сульфатом натрия. Растворитель отгоняли при пониженном давлении, полученный продукт очищали методом колоночной хроматографии на силикагеле (Merck) cразмером частиц 60–200 Å в системе CH2Cl2/EtOAc = 95/5 с градиентом к EtOAc в отсутствии света. Продукт представляет собой масло темно-зеленого цвета. Выход продукта составил 94 мг (23 %). Спектр ЯМР 1Н (400МГц, CDCl3, δ, м.д.): 7,70 (д, J = 2,54 Гц, 1 H, Ar), 7,63 (д, J = 2,54 Гц, 1 H, Ar), 6,83–6,91 (д, 2 H, C = CH–Ar), 6,81 (д, J = 2,15 Гц, 1 H, Ar), 6,64 (д, J = 8,41 Гц, 1 H, Ar), 5,85 (д, J = 10,37 Гц, 1 H, HC = C–Ar), 4,10–4,30 (д, 2 H, CH2), 3,36–3,67 (д, 5 H), 3,06–3,25 (д, 4 H), 2,55–2,60 (д, 2 H), 2,39–2,55 (м, 2 H), 2,27 (т, J = 7,14 Гц, 2 H), 1,86–2,00 (м, 2 H), 1,71–1,86 (м, 4 H), 1,49–1,70 (м, 8 H), 1,35–1,48 (м, 2 H), 1,20–1,29 (м, 6 H). HRMS (m/z): [M+], для C37H46N2O8S4рассч.: 775,2210; найдено: 775,2201.
Синтез модифицированных наночастиц Au
15 мл свежеприготовленного раствора наночастиц золота смешивали при тщательном перемешивании с раствором 1,3 мг лиганда в смеси 5 мл воды и 1 мл метанола. После окончания реакции избыток лиганда отмывают при помощи диализа в 2 л воды. При этом, за счет образования ковалентной связи S–Au цитрат ионы на поверхности наночастиц золота замещаются на соответствующие лиганды.
Работа выполнена при финансовой поддержке РФФИ (14-03-31176мол_а).



