В процессе эксплуатации многие промышленные и строительные материалы подвергаются негативному воздействию микроорганизмов (бактерий и грибов), то есть процессу биоповреждений. Среди наиболее активных деструкторов промышленных и строительных материалов выделяют микроскопические грибы [1, 2]. Лабильность, мощность ферментных систем позволяют этим живым организмам использовать в качестве источника питания самые различные субстраты природного и синтетического происхождения [3, 4]. Кроме того что микроскопические грибы разрушают и материалы, и строительные конструкции, они способны вызывать серьезные заболевания человека и животных: микозы, микоаллергозы, микотоксикозы и др., так как многие представители различных мицелиальных грибов могут являться условно патогенными организмами [5, 6]. В связи с вышеизложенным борьба с негативным воздействием микроскопических грибов особенно актуальна для различных сфер деятельности человека: промышленность, строительство, ветеринария, медицина экология и т.д. В качестве средств защиты промышленных материалов от биоповреждений используются различные методы, но наиболее распространенным является химический, а именно использование различных биоцидных (фунгицидных) препаратов [7]. Так как адаптационные возможности микроскопических грибов высоко, арсенал биоцидных препаратов все время изменяется. В последнее время в качестве биоцидных препаратов используются различные производные халькогенов (серы, селена, теллура) [8, 9]. Пристальное внимание к производным халькогенов объясняется тем, что они способны реагировать с тиольными (SH) группами, в результате чего они оказывают токсическое действие, катализируя окисление широкого ряда биологически значимых тиолов, включая глутатион, цистеин, дигидролиполевую кислоту и коэнзим А [10]. Эти реакции определенным образом связаны с формированием адаптационных механизмов микроорганизмов, в том числе и устойчивости к воздействию на них различных химических соединений. В связи с этим целью настоящего исследования явилось изучение биоцидной (бактерицидной и фунгицидной) активности селен- и серосодержащих соединений к ряду бактерий и микроскопических грибов активных деструкторов промышленных и строительных материалов.
Материалы и методы исследования
В качестве объектов исследования использовались Se(S),N-содержащие гетероциклические соединения:
 2-меркаптопиридин-1-оксид (1),
2-меркаптопиридин-1-оксид (1),
 ди(2-пиридил-1-оксид)дисульфид (2),
ди(2-пиридил-1-оксид)дисульфид (2),
 2-селанил-1-пиридин-1-оксид (3),
2-селанил-1-пиридин-1-оксид (3),
 ди(2-пиридил-1-оксид)диселенид (4),
ди(2-пиридил-1-оксид)диселенид (4),
в качестве контроля использовался
 пиридин N-оксид (5)
пиридин N-оксид (5)
Соединения 1–4 были синтезированы по методикам [11–13], соединение 5 – продажный реактив. В экспериментах по определению биоцидной активности и скорости роста нами использовались растворы данных соединений в диметилсульфоксиде в концентрациях 0,05–2,5 %.
В качестве тест-организмов использовались микроскопические грибы: Аlternaria alternata, Penicillium cyclopium, Penicillium chrysogenum, Аspergillus oryzae, Аspergillus terreus, Аspergillus niger, а также бактерии: Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa. Культуры указанных микроорганизмов предоставлены Всероссийской коллекцией микроорганизмов. Данные микроорганизмы являются активными деструкторами различных промышленных и строительных материалов.
Для культивирования микроскопических грибов использовали агаризованную среду Чапека – Докса следующего состава (г/л): NaNO3 – 2,0 г, KCl – 0,5 г, KH2PO4 – 1,0 г, Fe2(SO4)3∙7H2O – 0,01 г, MgSO4∙7 H2O – 0,5 г, агар-агар – 20 г, сахароза – 30 г, вода – 1 000 г.
Для культивирования бактерий использовали мясопептонный агар (МПА). Исследование бактерицидности проводилось диско-диффузионным методом. Для получения суспензии бактерий делали смыв с поверхности скошенного агара с суточной культурой бактерий. Для этого вносили в пробирки по 5–7 мл стерильного физиологического раствора. Полученную суспензию стандартизировали физиологическим раствором по оптическому стандарту мутности на 10 единиц. Затем с помощью пипетки отбирали 0,2 мл полученной суспензии культуры и переносили ее в центр чашки Петри. С помощью шпателя растирали культуру по всей поверхности питательной среды. Затем в чашки Петри помещали по 5 бумажных дисков каждый диаметром 5 мм, пропитанных растворами исследуемых веществ. Контролем служили образцы с фильтрами, пропитанными чистым растворителем.
Инкубация длилась в течение суток в термостате при (37 ± 2)°С [14].
Исследование показателей фунгицидности также выполнялось диско-диффузионным методом. В центр чашки Петри с агаризованной средой Чапека – Докса помещали бумажный диск диаметром 20 мм, пропитанный раствором исследуемого вещества. После этого осуществлялся посев микромицетов на плотную питательную среду Чапека – Докса в чашки Петри поверхностным способом. Инкубация длилась в течение 7–14 суток в термостате при (27 ± 2) °С и влажности 90 %.
Минимальная ингибирующая концентрация (бактерицидная и фунгицидная) Se(S),N-содержащих соединений
|
Соединение Название м/о |
МИК, % |
||||
|
1 |
2 |
3 |
4 |
5 |
|
|
Escherichia coli |
2,5 |
1 |
1 |
1 |
– |
|
Staphylococcus aureus |
1 |
1 |
1 |
1 |
– |
|
Pseudomonas aeruginosa |
25 |
1 |
2,5 |
1 |
– |
|
Аlternaria alternata |
0,15 |
0,5 |
0,25 |
0,15 |
– |
|
Penicillium cyclopium |
0,15 |
1 |
0,25 |
0,15 |
– |
|
Penicillium chrysogenum |
0,5 |
1 |
0,25 |
0,15 |
– |
|
Аspergillus oryzae |
0,25 |
0,5 |
0,5 |
0,5 |
– |
|
Аspergillus terreus |
1 |
– |
0,25 |
0,25 |
– |
|
Аspergillus niger |
0,5 |
0,5 |
0,5 |
0,25 |
– |
Примечание. «–» – в исследуемых концентрациях биоцидная активность не обнаружена.
По окончании инкубации измеряли зону ингибирования роста вокруг диска, в мм, по величине которой судили о степени биоцидности соединения или ее отсутствии. В качестве контроля использовались образцы с фильтрами, пропитанными чистым растворителем [14].
Нами исследовалась радиальная и линейная скорость роста микроскопических грибов [15]. Для эксперимента по оценке скорости роста к суспензии спор микроскопических грибов добавляли растворы исследуемых веществ и выдерживали в течение определенного времени: 0,5, 1, 3, 5 ч. Затем каплю суспензии спор микроскопических грибов (0,01 мл) наносили в центр чашки Петри с плотной питательной средой. Затем чашки инкубировались в термостате при (27 ± 2) °С и влажности 90 %. Рост колонии оценивался измерением ее диаметра в двух перпендикулярных направлениях через каждые двое суток в течение двух недель. Контролем служили образцы инокулированных суспензией спор микромицетов, выдержанных в течение определенного времени без биоцидов. На основании полученных данных составляли графики зависимости скорости роста исследуемых культур от времени.
Результаты исследования и их обсуждение
Представляло интерес исследовать взаимосвязь биоцидной активности (фунгицидной и бактерицидной) S(Se), N-содержащих гетероциклических соединений с их химической структурой. Все исследованные соединения являются производными оксипиридина. В соединении 5 отсутствуют атомы халькогенов, тогда как в соединениях 1–4 они имеются. В состав соединений 1–2 входят атомы серы, а в состав соединений 3–4 – селена. Между собой соединения 1 и 2 и 3 и 4 отличаются количеством присутствующих в них атомов серы и селена.
Анализ результатов показывает следующее (таблица).
В ходе экспериментов было установлено, что исходное соединение пиридин N-оксид (5), не содержащее в своем составе атомов халькогенов, не проявило ни бактерицидной, ни фунгицидной активности. Введение серы в пиридин N-оксид с образованием соединения (1) приводит к появлению бактерицидной и фунгицидной активности, причем фунгицидный эффект выражен более сильно, по сравнению с бактерицидным. Наибольшее бактерицидное действие данное соединение оказывает на Staphylococcus aureus, а фунгицидный эффект в наибольшей степени проявляется по отношению к Penicillium cyclopium и Аlternaria alternata. Соединение 2, которое представляет собой продукт окисления соединения 1, также обладало бактерицидной и фунгицидной активностью, но в этом случае имело место усиление бактерицидного действия по отношению ко всем культурам и снижение фунгицидной активности по отношению ко всем исследуемым микромицетам. При введении селена в исходное соединение пиридин N-оксид с образованием соединения (3) также отмечалось наличие фунгицидной и бактерицидной активности. По сравнению с соединением 1 имело место усиление биоцидного эффекта по отношению к Escherichia coli, однако фунгицидное действие снижалось, за исключением Penicillium chrysogenum и особенно Аspergillus terreus. Продукт окисления соединения 3 (соединение 4) проявил повышенную активность по отношению к Pseudomonas aeruginosa и фунгицидную активность по отношению к Аlternaria alternata, Penicillium cyclopium, Penicillium chrysogenum, Аspergillus niger. При сравнении биоцидной активности S и Se-содержащих соединений (2 и 4) можно сказать, что эти соединения обладают практически равной бактерицидной активностью, но соединение серы уступает по фунгицидному действию.
Известно, что при оценке биоцидного действия новых химических соединений используется такой физиологический показатель, как радиальная и линейная скорости роста [15]. В данной серии экспериментов нами использовались селенсодержащие соединения и культуры A. terreus и P. chysogenum. Как видно из таблицы, достаточно высокой фунгицидной активностью обладал диселенид (4). В связи с этим нами проводилось сравнение радиальной скорости роста для соединений 3 и 4. В качестве тест-культур при исследовании скорости роста грибов исследовался A. terreus – наиболее резистентный микроорганизм ко всем исследуемым соединениям и P. chysogenum – один из наименее резистентных микромицетов к исследуемым селенсодержащим соединениям.
На рис. 1 приведена средняя радиальная скорость роста по отношению к грибам при действии на них Se-содержащих биоцидов. Анализ этих данных показывает, что средняя скорость роста не зависела от времени выдерживания суспензии микроорганизмов в растворах исследуемых соединений, а зависела только от вида микроскопического гриба и природы химического соединения. Подтверждением этому могут являться данные по линейной скорости роста гриба Аspergillus terreus, представленные на рис. 2. На рис. 2 представлена линейная скорость роста колоний, выросших из спор, подверженных воздействию селенсодержащих соединений в течение 5 ч.
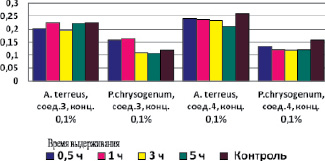
Рис. 1. Средняя радиальная скорость роста колоний A. terreus и P. chysogenum
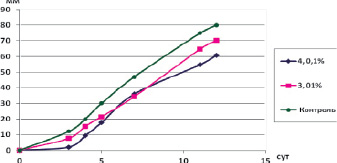
Рис. 2. Линейная скорость роста Aspergillus terreus в присутствии соединений 3 и 4
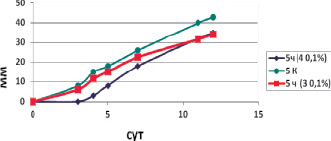
Рис. 3. Линейная скорость роста Penicillium chrysogenum, в присутствии соединений 3 и 4
Хотя минимальные ингибирующие концентрации данных соединений по отношению к этому грибу одинаковы (таблица), характер роста отличается в начальный и конечный период. На начальном периоде более высокая скорость роста данного микроорганизма наблюдалась в присутствии соединения (3). При действии соединения (4) наблюдалась более длительная лаг-фаза. Все это позволяет говорить о более сильном ингибировании начального роста биоцидом (4).
При действии биоцидов на P. сhrysogenum характер роста остается одинаковым, однако скорость роста колоний существенно меньше, что может быть связано с физиолого-биохимическими особенностями этих грибов.
Выводы
Таким образом, наши эксперименты показали, что биоцидный эффект зависит от химической структуры соединения и от вида халькогена (S, Se). Однако эта зависимость носит неоднозначный характер. Так, увеличение количества атомов серы в соединении приводит к повышению бактерицидной активности и снижению фунгицидной активности. Увеличение количества атомов селена, напротив, повышает фунгицидную активность, не влияя на бактерицидный эффект. Таким образом, изменяя структуру исследуемых нами соединений, можно регулировать их биоцидную активность, повышая или снижая их фунгицидное и бактерицидное действие.
Учитывая бактерицидную и фунгицидную активность исследуемых нами халькогенсодержащих гетероциклических соединений, последние можно рекомендовать в качестве биоцидных соединений, ингибирующих жизнедеятельность бактерий и микроскопических грибов, участвующих в процессе биодеградации промышленных и строительных материалов.
Рецензенты:
Соловьева И.В., д.б.н., заведующая лабораторией микробиома человека и средств его коррекции, ФБУН «Нижегородский научно-исследовательский институт эпидемиологии и микробиологии им. академика И.Н. Блохиной» Роспотребнадзора, г. Нижний Новгород;
Мельникова Н.Б., д.х.н., заведующая кафедрой фармацевтической химии и фармакологии, Нижегородская государственная медицинская академия, г. Нижний Новгород.



