Впервые бактериальная целлюлоза (БЦ) была описана Брауном в 1886 г. [13]. С тех пор интерес к этому материалу непрерывно растет, раскрывая новые возможности уникального материала.
Технология БЦ развивается в странах EC, США и Японии с 40-х гг. ХХ века. В настоящее время достигнуты значительные успехи в данной области. БЦ используется в биотехнологической, пищевой, химической, электронной и целлюлозно-бумажной промышленности, в частности теоретически обосновано и экспериментально доказано, что добавление БЦ повышает устойчивость бумаги к старению, а также повышает электрофизические характеристики электроизоляционной бумаги [8]. Широкое применение БЦ нашла в медицине. На основе матриц БЦ создают раневые покрытия, в микрохирургии при протезировании кровеносных сосудов, также на их основе возможно восстановить суставные хрящи. Нанокомпозиты БЦ – гидроксиапатита могут быть использованы в тканевой инженерии [4]. Исследования в данной области продолжаются и в настоящее время [5, 6, 7], включая попытки химической модификации БЦ.
Бактериальная целлюлоза (БЦ) обладает свойствами, отличающими ее от растительной целлюлозы. Хотя молекулярная и полимерная структура соответствует растительной целлюлозе, БЦ имеет более высокие степени полимеризации и кристалличности, характеризуется высокой водопоглощающей способностью, более высокой механической прочностью при меньшей ширине волокна, чем у растительной целлюлозы [12].
В настоящее время методы рентгеноструктурного анализа позволяют рассчитать и проанализировать структурные характеристики кристаллической составляющей: степень кристалличности (СК), размеры и форму элементарных фибрилл (областей когерентного рассеяния (ОКР), периоды элементарной ячейки и угол моноклинности, а также оценить соответствие атомной структуры той или иной модели строения целлюлозы [9]. В литературе приведен рентгенодифракционный анализ различных видов целлюлозы [10].
Целью данной работы является исследование БЦ, выращенной на различных питательных средах, методом рентгенографического анализа.
Материалы и методы исследования
В экспериментах использовались: синтетическая питательная среда, приготовленная растворением сахарозы в экстракте черного чая, гидролизат крахмала, ферментативный гидролизат мискантуса. В качестве инокулята использовалась семидневная симбиотическая культура, выращенная на глюкозной среде, доза внесения составляла 10 %. Начальная концентрация субстрата во всех питательных средах составила 20 г/л, уровень активной кислотности саморегулировалcя симбиозом [3]. Культивирование проводилось в статических условиях при 25–29 °С в течение 13 суток.
Образцы пленок были очищены следующим способом: в течение двух суток пленка выдерживалась в 2 %-ном растворе NaOH для удаления клеток, затем пленка промывалась в дистиллированной воде до нейтральной реакции, после этого пленку обрабатывали в течение суток в 2 %-ном растворе HCl для удаления красящих веществ чая, затем пленка промывалась дистиллированной водой до нейтральной реакции среды. Плёнка высушивалась при комнатной температуре в расправленном состоянии.
Рентгенографический анализ высушенных образцов проводился сотрудниками Петрозаводского государственного университета Л.А. Алешиной и И.В. Люхановой на автоматизированном дифрактометре ДРОН-6.0 в СuKα излучении, монохроматор – пиролитический графит. Рентгенограммы отсняты в двух геометриях: на отражение и просвет.
Результаты исследования и их обсуждение
На рис. 1 сравниваются картины рассеяния образцом, полученные в геометриях на отражение и просвет, в сопоставлении со штрихдиаграммой целлюлозы Iα, рассчитанной по координатам атомов, приведенным в литературе [11]. Указаны индексы наиболее интенсивных отражений. Видно, что зарегистрированная в геометрии на отражение дифракционная картина по соотношению интенсивностей отражений от кристаллической фазы резко отличается от таковой, зарегистрированной в геометрии на просвет. Это свидетельствует об анизотропии структуры изучаемого образца. Ранее были отсняты рентгенограммы образцов бактериальной целлюлозы, выращенной на питательной среде, приготовленной из сахарозы и экстракта черного чая, в геометриях на отражение и на просвет. Рентгенограммы исследованных образцов, полученные в геометрии на отражение и просвет, также резко отличаются, что также указывает на анизотропию структуры [2].
В табл. 1 сравниваются результаты расчета размеров кристаллов (ОКР) и СК для образцов бактериальной целлюлозы, выращенной на различных питательных средах.
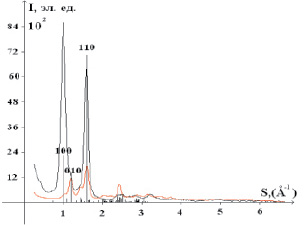
Рис. 1. Нормированные кривые распределения интенсивности рассеяния образцом бактериальной целлюлозы, полученной на среде ферментативного гидролизата мискантуса, в геометриях:  на отражение,
на отражение,  на просвет
на просвет
Таблица 1
Размеры ОКР в различных кристаллографических направлениях и СК образцов бактериальной целлюлозы
|
Образец бактериальной целлюлозы, выращенной |
СК, % |
Размер кристаллитов D (Å) в направлениях |
||
|
[100] |
[010] |
[110] |
||
|
на сахарозе [2] |
89 |
51 |
57 |
57 |
|
на гидролизате крахмала |
91 |
68 |
38 |
49 |
|
на гидролизате мискантуса |
95 |
48 |
38 |
51 |
Примечание. Погрешность: ∆СК = ±5 %; ∆D = ±5 Å.
СК и ОКР являются характеристиками надмолекулярной структуры БЦ [9]. ОКР исследованных образцов практически равноосны по форме и в направлениях осей a и b элементарной ячейки практически не отличаются друг от друга. Следует отметить, что образец БЦ, выращенной на гидролизате мискантуса, имеет более высокую степень кристалличности, по сравнению с БЦ, полученной на гидролизате крахмала и сахарозной среде.
Расчет данной рентгенограммы методом полнопрофильного анализа показал, что бактериальная целлюлоза состоит из двух различных кристаллических модификаций: триклинной Iα и моноклинной Iβ (с антипараллельным расположением молекул). Процентное соотношение фаз Iα :Iβ в образце составило 99:1 соответственно. Аномально высокая интенсивность отражения (100) связана с наличием текстуры (преимущественной ориентации кристаллитов) в фазе Iα: ось текстуры [010]. Коэффициент, учитывающий текстуру, больше 1, что свидетельствует об игольчатой форме кристаллов целлюлозы Iα. При этом плоскости (100) кристаллитов оказываются параллельны поверхности пленки. Графический результат уточнения профильных характеристик показан на рис. 2.
Уточненные значения периодов a, b, c и углов α, β, γ элементарных ячеек обеих фаз представлены в табл. 2.
Полученные данные соответствуют литературным [1], где с целлюлозой Iα была идентифицирована одноцепочная триклинная элементарная ячейка со следующими размерами: a = 6,74; b = 5,93; c = 10,36; α = 117°; β = 113°; γ = 81°. Пространственная группа симметрии P1. Структура фазы Iβ описывается моноклинной элементарной ячейкой с размерами: a = 8,01; b = 8,17; c = 10,36; γ = 97,3°. Пространственная группа симметрии P2.
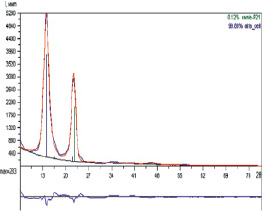
Рис. 2. Рентгенограммы:  теоретическая, рассчитанная по данным, полученным в результате уточнения профильных и структурных параметров,
теоретическая, рассчитанная по данным, полученным в результате уточнения профильных и структурных параметров,  экспериментальная для образца бактериальной целлюлозы. В нижней части рисунка показана разностная кривая; вертикальные линии соответствуют штрихдиаграмме:
экспериментальная для образца бактериальной целлюлозы. В нижней части рисунка показана разностная кривая; вертикальные линии соответствуют штрихдиаграмме:  1α,
1α,  1β
1β
Таблица 2
Кристаллографические характеристики исследуемых образцов БЦ
|
Образец БЦ |
a, Å |
b, Å |
c, Å |
α, ° |
β, ° |
γ, ° |
Rwp, % |
Rp, % |
|
|
на сахарозной среде |
1α |
6,82(8) |
6,10(6) |
10,35(2) |
118,(10) |
114,(17) |
82,(6) |
13,84 |
11,03 |
|
1β |
8,171 |
7,846 |
10,340 |
90,00 |
90,00 |
96,4 |
|||
|
на гидролизате крахмала |
1α |
7,(1) |
5,97(1) |
10,(3) |
116,(31) |
112,(3) |
81,(20) |
14,75 |
11,75 |
|
1β |
7,88(9) |
8,17(3) |
10,36(2) |
90 |
90 |
97,(3) |
|||
|
на гидролизате мискантуса |
1α |
6,74(5) |
5,97(3) |
10,(2) |
117,(59) |
112,(86) |
81,(18) |
12,26 |
8,50 |
|
1β |
7,90(1) |
8,18(2) |
10,38(3) |
90 |
90 |
98,(6) |
|||
Примечание. Rwp, Rp – факторы недостоверности.
Рассчитанные значения СК и размеры ОКР, рассчитанные из ширин трех отражений целлюлозы, индексы которых приведены в табл. 2. Видно, что СК не зависит от геометрии исследований.
Преобладание низкосимметричной фазы Iα в экспериментальном образце хорошо согласуется с литературными данными, свидетельствующими, что, в отличие от растительной целлюлозы, целлюлозы примитивных организмов характеризуются высоким процентом фазы Iα (~70 %). Также известно, что триклинная модификация целлюлозы Iα метастабильна, поэтому её реакционная способность выше. Сосуществование двух полиморфов, имеющих различную стабильность, будет влиять на реакционную способность нативной целлюлозы: так как Iα метастабильна, то ее реакционная способность выше, чем у Iβ, и Iα будет участком первичной реакции [1].
Выводы
Проведено культивирование бактериальной целлюлозы на синтетической сахарозной среде, на гидролизате крахмала, на среде ферментативного гидролизата мискантуса, с использованием симбиотической культуры Мedusomyces gisevii. Очищенные образцы исследованы методом рентгенографического анализа. В результате анализа определены структурные характеристики кристаллической составляющей: степень кристалличности, размеры и форма элементарных фибрилл, периоды элементарной ячейки и угол моноклинности, а также проведена оценка соответствия атомной структуры той или иной модели строения целлюлозы. Установлено, что все образцы характеризуются анизотропией структуры. Обнаружено, что наибольшая степень кристалличности у образца бактериальной целлюлозы, полученного на среде ферментативного гидролизата. Достоверно показано, что во всех образцах бактериальной целлюлозы преобладает низкосимметричная метастабильная фаза Iα.
Рецензенты:
Канарский А.В., д.т.н., профессор кафедры пищевой биотехнологии, ФГБОУ ВПО «Казанский национальный исследовательский технологический университет», г. Казань;
Меледина Т.В., д.т.н., профессор, заведующая кафедрой пищевой биотехнологии продуктов из растительного сырья, Институт холода и биотехнологий, ФГАОУ ВО «Санкт-Петербургский национальный исследовательский университет информационных технологий, механики и оптики», г. Санкт-Петербург.



