Неблагоприятные факторы внешней среды вызывают развитие окислительного стресса во всех тканях организма, в том числе тестикулярной ткани. Активные формы кислорода в физиологических концентрациях являются регуляторами сперматогенеза, подвижности сперматозоидов и взаимодействия с яйцеклеткой, однако их избыточное накопление в условиях оксидативного стресса приводит к повреждению генетического материала и мембран клетки [12]. Серьезный вклад в развитие заболеваний репродуктивного аппарата мужчин вносят неблагоприятные условия среды и труда. В последние годы возросла динамика мужского бесплодия – состояния, которое является следствием ряда заболеваний и патологических воздействий на репродуктивную систему мужчины. Его причины и структура до сих пор излагаются нечётко и противоречиво, несмотря на внушительный перечень факторов, нарушающих сперматогенез [4]. Актуальность изучения специфичности действия различных неблагоприятных факторов на сперматогенез продиктована тем обстоятельством, что до сих пор нет четких разграничений между степенью угнетения сперматогенеза под влиянием того или иного стресс-фактора. Более того, нет единой модели угнетения мужской репродуктивной функции, объясняющей включение различных составляющих репродуктивного аппарата в зависимости от направленности и силы действия неблагоприятного фактора. Последнее обстоятельство позволит направленно подойти к вопросу профилактики нарушений репродуктивной функции в условиях воздействия различных стрессирующих факторов.
Целью настоящей работы было сравнительное исследование влияния различных неблагоприятных факторов на состояние стероидо- и сперматогенеза, а также уровень свободнорадикального окисления в эякуляте.
Материалы и методы исследования
Было обследовано 40 мужчин репродуктивного возраста (25–35 лет), обратившихся по поводу отсутствия детей в браке в течение 2–3 лет. Все пациенты были разделены на четыре группы в зависимости от действующего неблагоприятного фактора. Первую группу составили работники нефтегазовой промышленности, вторую – работники радиолокационных и телерадиовещательных объектов, третью – работники творческих профессий, четвертую – безработные и малоимущие лица. Контрольную группу составили физически здоровые мужчины аналогичного возраста, имеющие детей в браке.
Для оценки стресс-реактивности в крови измеряли перекисный гемолиз эритроцитов [7]. Для определения уровня МДА в спермоплазме 0,5 мл нативной спермы смешивали с 1,5 мл 1,2 % KCl, добавляли 1 мл 40 % раствора трихлоруксусной кислоты, затем пробы центрифугировали 10 минут при 5000 об/мин, далее следовали классической методике [9]. Измерение показателей стандартной спермограммы (концентрации, подвижности, жизнеспособности и морфологии сперматозоидов) проводили согласно рекомендациям и нормативам ВОЗ [5, 8]. Уровни половых гормонов (тестостерона, лютеинизирующего гормона, пролактина) определяли иммуноферментным методом. Статистическую обработку полученных данных выполняли с использованием критерия Стьюдента (t), различия считали достоверными при p < 0,05 [1].
Результаты исследования и их обсуждение
У всех мужчин, на которых действовал тот или иной неблагоприятный фактор, были обнаружены признаки развития окислительного стресса, что подтверждают данные измерения уровней перекисного гемолиза эритроцитов (ПГЭ) в крови и МДА в эякуляте (рис. 1, 2).
При этом следует отметить, что наиболее агрессивным неблагоприятным фактором оказался сероводородсодержащий природный газ, поскольку у работников нефтегазовой промышленности зафиксировано наибольшее усиление процессов свободнорадикального окисления (СРО) как в крови, так и в эякуляте (рис. 2). Развитие окислительного стресса сопряжено с генерированием активизированных кислородных метаболитов (HO•, 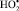 ,
, 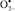 ), вызывающих повреждение биомембран клеток. Образование пероксидного радикала
), вызывающих повреждение биомембран клеток. Образование пероксидного радикала 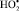 вызывает каскад свободнорадикальных окислительных процессов, связанных с деструкцией ненасыщенных фосфолипидов RH мембран клеток [6]:
вызывает каскад свободнорадикальных окислительных процессов, связанных с деструкцией ненасыщенных фосфолипидов RH мембран клеток [6]:
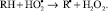
Дальнейшая судьба ненасыщенных фосфолипидов, входящих в состав биологических мембран клеток, зависит от соотношения прооксидантной и антиоксидантной составляющих, определяющих в целом уровень радикалообразования в клетке.
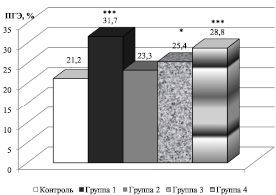
Рис. 1. Изменение уровня перекисного гемолиза эритроцитов у мужчин, подверженных воздействию неблагоприятных факторов: * P < 0,05; *** P < 0,001 – в сравнении с контролем
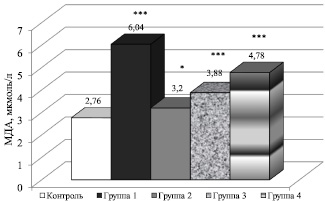
Рис. 2. Изменение уровня МДА в эякуляте мужчин, подверженных воздействию различных неблагоприятных факторов: * P < 0,05; *** P < 0,001 – в сравнении с контролем
Следует отметить положительную коррелятивную связь между уровнем МДА и ПГЭ как показателями развития окислительного стресса в условиях воздействия неблагоприятных факторов. Изменение уровней МДА и ПГЭ под влиянием различных неблагоприятных факторов во всех группах соответствовало высокому коэффициенту положительной корреляции r = +0,993 (P < 0,001), что свидетельствует об общих тенденциях развития оксидативного стресса в организме.
Анализ спермограмм показал, что во всех группах мужчин, где действовал конкретный неблагоприятный фактор, изменения коснулись количественных и микроскопических показателей сперматозоидов. Результаты исследований показали, что у работников нефтегазовой промышленности концентрация сперматозоидов оказалась почти в 10 раз ниже таковой в контрольной группе (табл. 1). Наименее агрессивным стрессирующим фактором оказалось микроволновое излучение (группа 2).
Таблица 1
Показатели сперматогенеза мужчин в условиях воздействия различных неблагоприятных факторов
|
Показатели сперматогенеза |
Контроль (n = 10) |
Группа 1 (n = 10) |
Группа 2 (n = 10) |
Группа 3 (n = 10) |
Группа 4 (n = 10) |
|
Кол-во сперматозоидов, млн |
21,7 ± 0,79 |
2,6 ± 0,31 |
13,8 ± 0,71 |
8,65 ± 0,33 |
4,73 ± 0,14 |
|
Подвижные (А + В), % |
40,5 ± 1,55 |
*** 26,0 ± 2,69 |
* 33,9 ± 2,00 |
** 32,8 ± 1,47 |
*** 31,1 ± 1,11 |
|
Активно подвижные А, % |
27,2 ± 2,06 |
*** 8,8 ± 3,24 |
*** 15,0 ± 1,85 |
* 19,4 ± 2,10 |
** 17,8 ± 1,69 |
|
Слабо подвижные В, % |
13,3 ± 1,08 |
17,2 ± 3,85 |
** 18,9 ± 1,46 |
13,4 ± 1,18 |
13,3 ± 1,17 |
|
Непоступательно подвижные С, % |
26,7 ± 1,67 |
27,2 ± 2,21 |
24,5 ± 1,30 |
* 32,2 ± 1,88 |
30,5 ± 1,94 |
|
Неподвижные D, % |
32,8 ± 2,06 |
** 46,8 ± 3,46 |
** 41,6 ± 1,86 |
35,0 ± 2,04 |
38,4 ± 1,86 |
|
Живые, % |
84,3 ± 1,05 |
*** 76,8 ± 0,65 |
81,9 ± 0,83 |
80,9 ± 0,89 |
80,2 ± 0,94 |
|
Нормальные, % |
73,0 ± 1,78 |
* 65,4 ± 2,23 |
* 66,7 ± 1,28 |
69,2 ± 1,45 |
68,2 ± 1,45 |
Примечание: * P < 0,05; ** P < 0,01; *** P < 0,001 – в сравнении с контролем.
Исследование микроскопических показателей сперматозоидов выявило у работников нефтегазовой промышленности снижение общей подвижности сперматозоидов более чем в 1,5 раза, по сравнению с контрольной группой. При этом следует указать, что снижение общей подвижности сперматозоидов было вызвано снижением относительного количества активно подвижных сперматозоидов (P < 0,001). Относительное количество слабо подвижных и непоступательно подвижных сперматозоидов (категории В и С) не отличалось достоверно от контрольных значений. Однако относительное количество неподвижных сперматозоидов возросло почти на 43 % относительно контрольных показателей (P < 0,01). Возрастание неподвижных форм сперматозоидов (категория D) было вызвано приростом мёртвых клеток. Указанное обстоятельство свидетельствует об ускоренном апоптозе сперматозоидов в условиях интоксикации природным и попутным нефтяным газами (табл. 1).
У безработных мужчин с недостаточным и неполноценным питанием (группа 4) наблюдалось также заметное снижение подвижности сперматозоидов по сравнению с контрольной группой (P < 0,001). Однако, в отличие от работников нефтегазовой промышленности, у данной группы мужчин количество активно подвижных сперматозоидов (категория А) было умеренно сниженным, в то время как количество слабо подвижных клеток (категория В) не отличалось от контрольных (нормативных) показателей (табл. 1). Относительное количество непрогрессивно-подвижных и неподвижных сперматозоидов (C + D) было повышено, что свидетельствует об усиленной динамике старения половых клеток. Таким образом, значительное снижение концентрации сперматозоидов на фоне прироста непрогрессивно-подвижных и неподвижных форм у работников нефтегазовой промышленности и у малоимущих мужчин коррелирует с усиленной динамикой процессов СРО в эякуляте.
У мужчин творческих профессий (группа 3) была умеренно снижена подвижность сперматозоидов (P < 0,01) за счёт некоторого снижения относительного количества активно подвижных форм (P < 0,05). Вместе с тем высока доля непрогрессивно-подвижных форм (категория С), которые представлены в основном патологическими клетками. У работников радиолокационных и телерадиовещательных объектов (группа 2) относительное количество подвижных сперматозоидов (А + В) было также умеренно снижено (P < 0,05). Однако следует заметить, что по сравнению с контрольными показателями в этой группе мужчин отмечалось изменение соотношения между активно подвижными и слабо подвижными сперматозоидами со сдвигом в сторону слабо подвижных (категория В). Количество неподвижных сперматозоидов (категория D) было увеличено, в сравнении с контрольными показателями (P < 0,01).
Морфологический анализ показал, что во всех группах мужчин, на которых действовал тот или иной неблагоприятный фактор, отмечалось снижение относительного количества нормальных сперматозоидов. Особенно четко это прослеживалось у работников нефтегазовой промышленности и радиолокационных объектов (группы 1 и 2). Во всех группах дефекты коснулись в основном шейки и хвоста сперматозоидов. Если суммарный процент дефектов шейки и хвоста сперматозоидов в контрольной группе составил 10,3 %, то в первой группе он был 17,2 %, во второй – 17,7 %, в третьей – 13,9 %, а в четвёртой – 14,4 % (табл. 2).
Изменения уровней половых гормонов под влиянием различных неблагоприятных факторов отражены в табл. 3.
Таблица 2
Морфологические характеристики сперматозоидов в условиях воздействия различных неблагоприятных факторов
|
Морфологические характеристики сперматозоидов |
Контроль (n = 10) |
Группа 1 (n = 10) |
Группа 2 (n = 10) |
Группа 3 (n = 10) |
Группа 4 (n = 10) |
|
Патология головки, % |
16,7 ± 0,70 |
17,4 ± 0,85 |
15,6 ± 0,26 |
16,9 ± 0,38 |
17,4 ± 0,56 |
|
Патология шейки, % |
5,4 ± 0,42 |
* 8,4 ± 1,02 |
** 7,9 ± 0,57 |
6,8 ± 0,53 |
* 7,0 ± 0,47 |
|
Патология хвоста, % |
4,9 ± 0,87 |
** 8,8 ± 0,53 |
*** 9,8 ± 0,63 |
* 7,1 ± 0,57 |
* 7,4 ± 0,47 |
Примечания: * P < 0,05; ** P < 0,01; *** P < 0,001 – в сравнении с контролем.
Таблица 3
Изменение уровней половых гормонов мужчин в условиях воздействия различных неблагоприятных факторов
|
Группы |
n |
Тестостерон, нг/мл |
Лютеинизирующий гормон, мМЕ/мл |
Пролактин, МЕ/мл |
|
Контроль |
10 |
7,40 ± 0,381 |
4,21 ± 0,250 |
368,5 ± 18,77 |
|
Группа 1 |
10 |
*** 3,52 ± 0,123 |
*** 1,84 ± 0,125 |
354,1 ± 18,87 |
|
Группа 2 |
10 |
7,22 ± 0,243 |
4,18 ± 0,197 |
296,3 ± 18,42 |
|
Группа 3 |
10 |
*** 2,68 ± 0,262 ○○ |
*** 1,79 ± 0,079 |
*** 565,0 ± 30,31 |
|
Группа 4 |
10 |
*** 3,83 ± 0,130 |
2,09 ± 0,033 |
***492,2 ± 21,75○○○ |
Примечания: *** P < 0,001 – в сравнении с контролем; ○○ P < 0,01; ○○○ P < 0,001 – в сравнении с группой 1.
Таким образом, у работников радиолокационных и телерадиовещательных объектов (группа 2) уровни тестостерона и лютеинизирующего гормона не отличались от контрольных показателей. Вместе с тем в остальных группах мужчин зафиксированы достоверные изменения уровней тестостерона и лютеинизирующего гормона в сторону их снижения, что свидетельствует об угнетении тестостеронпродуцирующей активности яичек в условиях воздействия целого ряда неблагоприятных факторов. Снижение тестостеронпродуцирующей активности яичек отрицательно сказывается на отдельных этапах сперматогенеза [10]. Следует отметить положительную коррелятивную связь между уровнями тестостерона и лютеинизирующего гормона во всех группах мужчин, на которых действовал тот или иной неблагоприятный фактор. В группе мужчин творческих профессий (группа 3) падение уровня тестостерона было наиболее заметным. В то же самое время в этой группе зафиксировано достоверное повышение уровня пролактина, который был значительно выше контрольных показателей и превышал верхнюю границу нормальных значений. Указанный факт объясняет возможную причину падения тестостерона в крови под влиянием эмоционального стресса, поскольку пролактин угнетающе действует на продукцию тестостерона клетками Лейдига [15]. Механизм влияния эмоционального стресса на репродуктивную функцию довольно сложен: с одной стороны, запускаются общие механизмы развития окислительного стресса, с другой – подключаются центральные регуляторные механизмы на уровне гипоталамо-гипофизарного комплекса, обеспечивая эндокринные сдвиги в системе гипофиз ‒ семенники [11]. Повышенный уровень пролактина вызывает угнетение тестикулярного андрогенопоэза, что отрицательно сказывается на сперматогенной функции. В результате угнетение сперматогенеза в условиях хронического эмоционального стресса носит интегральный характер.
Заключение
Обобщая все вышеприведённые факты, можно заключить, что у работников нефтегазовой промышленности наблюдается значительное угнетение сперматогенеза. Одним из механизмов возникновения дефектов сперматозоидов можно считать усиление процесса липопероксидации, вследствие которого генерируется огромное количество свободных радикалов, что негативно отражается на оплодотворяющей способности эякулята [3]. С другой стороны, в хвосте сперматозоидов содержится селенопептид с молекулярной массой Mr = 17,0 кД [13], который имеет важное структурное значение при сборке хвоста сперматозоидов. Под влиянием сероводородсодержащего газа Астраханского газоконденсатного месторождения, очевидно, происходит замещение селена серой. В результате ухудшаются морфокинетические характеристики сперматозоидов. В условиях неполноценного питания снижаются собственные ресурсы антиоксидантной системы. Нехватка биоресурсов ведёт к общему снижению уровня половых гормонов. Вместе с тем известно, что такой фактор, как безработица, также вызывает снижение уровня тестостерона, что в конечном счете отрицательно сказывается на сперматогенезе [14].
Микроволновое излучение (МВИ) миллиметрового диапазона на начальных этапах способно оказать положительный эффект на сперматогенез, способствуя пролиферации стволовых клеток (сперматогонии А0). Однако длительное воздействие МВИ средней и высокой интенсивности вызывает угнетение антиоксидантной системы, способствуя тем самым усилению процессов радикалообразования [2]. Воздействие МВИ на организм сопровождается изменением устойчивости мембран сперматозоидов из-за эффекта усиления акустоэлектрических колебаний (колебаний Фрёлиха) в мембранах. Наиболее уязвимой частью оказывается элемент движения сперматозоидов – их хвост; среди подвижных форм начинают доминировать слабо подвижные сперматозоиды (категория В). Неподвижные формы (категория D), очевидно, представлены умирающими и бесхвостыми сперматозоидами.
Таким образом, воздействие различных неблагоприятных факторов сопровождалось усилением процессов СРО в эякуляте, что коррелировало с ухудшением морфокинетических показателей сперматозоидов и достоверным снижением их концентрации. Наиболее токсичными в отношении оплодотворяющих свойств эякулята оказались природный и попутный нефтяной газы, вызвав резкое снижение концентрации сперматозоидов и их подвижности за счет значительного сокращения активно подвижных форм. В условиях недостаточного поступления питательных веществ усиление динамики СРО обусловлено снижением ресурсов антиоксидантной защиты. У работников творческих профессий при ведущей эмоциональной составляющей как фактора стресса угнетение сперматогенеза носит, очевидно, интегральный характер и обусловлено как усиленной динамикой процессов СРО, так и участием центральных регуляторных механизмов на уровне гипоталамо-гипофизарного комплекса. У работников радиолокационных и телерадиовещательных объектов существенные изменения коснулись морфологии сперматозоидов, обусловленные механическими повреждениями микроволнового излучения.
Проведенное исследование позволяет сформулировать два основных вывода:
1) между уровнем МДА в эякуляте и микроскопическими и количественными показателями сперматогенеза установлена чёткая зависимость: чем выше уровень МДА в эякуляте, тем ниже концентрация сперматозоидов, их подвижность и жизнеспособность на фоне прироста относительного количества патологических форм;
2) степень токсичности того или иного неблагоприятного фактора определяется не только и не столько силой его действия, но также его направленностью по отношению к различным звеньям и компонентам репродуктивной системы.
Рецензенты:
Великородов А.В., д.х.н., профессор, зав. кафедрой фармацевтической химии, Астраханский государственный университет, г. Астрахань;
Бойко О.В., д.м.н., профессор кафедры биохимии с курсом лабораторной диагностики, ГБОУ ВПО «Астраханский государственный медицинский университет» Минздрава России, г. Астрахань.



