Одной из актуальных проблем современной стоматологии является диагностика и лечение некариозных поражений твердых тканей зубов, поскольку эта патология представляет собой наиболее распространенную после кариеса группу заболеваний, которые зачастую приводят к прогрессирующей убыли эмали и дентина зуба, нарушению функции жевания и ведут к косметическому недостатку [5, 8, 16]. Достаточно часто встречаемой патологией некариозного происхождения является клиновидный или V-образный дефект, который имеет определенное сходство с пришеечным кариесом, эрозией, пришеечным некрозом эмали, а также учитывается в клинике при диагностике гипоплазии эмали и флюороза зубов. Следует помнить, что начальные проявления перечисленных выше заболеваний весьма сходны и выражаются в шероховатости и незначительной убыли тканей зуба. Сходные симптомы клинического течения, особенно в начальном периоде заболевания, затрудняют диагностику и как следствие этого, выбор лечебно-профилактических мероприятий.
Современная стоматология располагает небольшим набором методов и средств диагностики некариозных поражений твердых тканей зубов, при этом на первом месте по-прежнему остаются исторически сложившиеся традиционные клинические методы обследования: осмотр, сбор анамнеза, зондирование, термотест, витальное окрашивание зубов и т.д. Тем не менее использование данных методов не гарантирует точной диагностики клиновидных дефектов, особенно начальных стадий. Данная проблема диктует необходимость разработки новых методов ранней диагностики и дифференциации клиновидных дефектов.
Одним из наиболее перспективных методов решения данной проблемы является метод люминесцентной спектроскопии, который уже достаточно давно и успешно применяется в различных областях медицины, таких как гинекология, офтальмология, онкология и стоматология [6, 18, 20, 21, 25]. За последние сто лет было проведено множество исследований флуоресценции зубов, и в настоящее время полученные результаты воплощены в виде мощного диагностического инструмента для регистрации прежде всего кариозных заболеваний [9, 18, 20, 21, 25].
Последние достижения в области рентгеновской компьютерной томографии, связанные прежде всего с высоким пространственным и временным разрешением, позволяют считать данный метод также весьма перспективным для диагностики клиновидных заболеваний. В связи с этим цель данной работы заключалась в исследовании возможности диагностики и дифференциации различных стадий клиновидных дефектов методом ЛИФ и многослойной спиральной компьютерной томографии (МСКТ).
Материалы и методы исследования
Исследования проводились in vivo на 60 пациентах с клиновидным дефектом в пришеечной области, согласно предварительным клиническим исследованиям. Стадии некариозного процесса определяли в соответствии c топографической классификацией: начальная, поверхностная, средняя и глубокая стадии клиновидного дефекта [5].
Спектры флуоресценции регистрировали с помощью запатентованного устройства, созданного на базе волоконно-оптического спектрометра USB4000–VIS–NIR (Ocean Optics), сопряженного с компьютером [10]. Область зондирования зубов определялась площадью волновода и составляла величину, равную 0,28 мм2. В качестве источника возбуждения флуоресценции использовался лазерный диод, излучающий на длине волны 445 нм. Плотность мощности излучения не превышала 20 мВт/см2. Измерения проводились в затемненном помещении в отсутствие источников рассеянного света. Спектры флуоресценции эмали фиксировали в интактной и пораженной клиновидным дефектом пришеечной области зуба. От каждой области каждого зуба было снято не менее 10 спектров флуоресценции, после чего спектры были усреднены. В случае, если интактный участок у пораженного зуба отсутствовал, то опорный спектр снимался с интактной пришеечной области эквивалентного зуба. Это важно, поскольку выполненные нами исследования для интактных зубов свидетельствуют о зависимости спектра флуоресценции как от анатомической области зуба, так и от типа зуба верхней и нижней челюсти [11–15]. Спектр флуоресценции интактной области зуба использовался в качестве индикатора спектральных изменений, вызванных патологическими процессами. Перед проведением люминесцентных исследований пациентам была проведена процедура профессиональной гигиены полости рта и была рекомендована зубная паста, не вносящая существенного вклада в регистрируемый сигнал.
Для регистрации клиновидных дефектов in vivo применяли также метод МСКТ. Исследования были выполнены на аппарате Philips Brilliance ICT 64 с толщиной среза 0,55 мм в аксиальной плоскости. Плоскость сканирования была перпендикулярна окклюзионной плоскости. Уровень визуализации формировался от подбородочного выступа нижней челюсти до твердого неба с захватом альвеолярных бухт верхнечелюстных пазух. Для измерения толщины эмали применяли программу OSIRIX версии 5–1,6, позволяющую проводить постпроцессинговую обработку (многоплоскостные реформации) изображений, при которой плоскости выставлялись по оси зуба и перпендикулярно окклюзионной плоскости.
Результаты исследования и их обсуждение
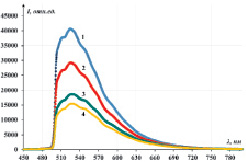
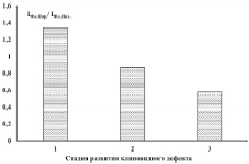
На рис. 1, а представлены усредненные по всем пациентам спектры флуоресценции интактной эмали в различных анатомических областях и эмали, пораженной поверхностным клиновидным дефектом. На рис. 1, б представлена зависимость отношения интегральной интенсивности флуоресценции эмали, пораженной клиновидными дефектами, к интенсивности интактной эмали в пришеечной области от различных стадий развития данной патологии.
 а
а
 б
б
Рис. 1. а – спектры флуоресценции эмали: 1 – в пришеечной области, пораженной поверхностным клиновидным дефектом; 2 – интактной пришеечной области; 3 – области экватора; 4 – режущего края; б – поведение интегральной интенсивности флуоресценции эмали в зависимости от стадии развития клиновидного дефекта. Столбцы представляют собой отношение усредненных по всем пациентам интенсивностей флуоресценции эмали зубов, пораженных клиновидными дефектами к интенсивности флуоресценции интактной эмали в пришеечной области в зависимости от стадии развития патологии: 1 – поверхностный клиновидный дефект; 2 – средний клиновидный дефект; 3 – глубокий клиновидный дефект
Из рис. 1, а и б видно, что при возбуждении излучением с длиной волны 445 нм спектры флуоресценции интактной и пораженной эмали зуба существенно отличаются по интенсивности, причем имеют разнонаправленную зависимость. Так, для поверхностной стадии развития клиновидного дефекта интенсивность свечения пораженной эмали выше, чем интактной, более чем на 30 %, а для средней и глубокой стадий интенсивность свечения пораженной эмали уже ниже, чем интактной. Для глубокой стадии развития клиновидного дефекта интенсивность свечения пораженной области ниже интактной более чем на 40 %.
Из рис. 1, а также видно, что спектр флуоресценции интактной эмали в различных анатомических областях и эмали, пораженной клиновидным дефектом поверхностной стадии представляет собой достаточно широкую многокомпонентную полосу с максимумом в области 526 нм. При этом форма спектра флуоресценции пораженной эмали совпадает с формами спектров флуоресценции интактной эмали для всех анатомических областей: пришеечной, экватора и режущего края. Аналогичная тенденция наблюдалась и для других стадий развития клиновидного дефекта.
На рис. 2 представлены фотографии клыков, один из которых является интактным (справа), другой (слева) подвержен клиновидному дефекту глубокой стадии. Фотографии сняты на аппарате Philips Brilliance ICT 64 методом МСКТ.
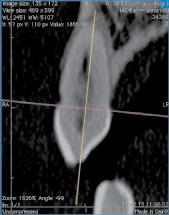
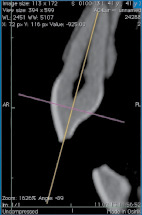
Рис. 2. Изображения зубов, полученные методом МСКТ: слева – зуб, пораженный в пришеечной области клиновидным дефектом глубокой стадии; справа – интактный зуб
Как видно из рис. 2, метод МСКТ позволяет визуализировать поражения зубов клиновидными дефектами. Используя программу обработки изображений аппарата Philips Brilliance ICT 64, можно оценить глубину поражения данным заболеванием. Например, для глубокой стадии развития клиновидного дефекта она составила величину, равную 0,47 мм.
Как известно, клиновидные дефекты являются одной из форм некариозных патологий, поражающих твердые ткани зубов и локализующиеся в области шеек зубов верхней и нижней челюсти. В зависимости от морфологии и симптоматики заболевания различают пришеечные, коронковые и корневые клиновидные дефекты. Отметим, что в данной работе в основном были исследованы коронковые клиновидные дефекты. Для клиновидных дефектов характерна локализация на эмалево-цементной границе, а распространение дефекта наблюдается преимущественно по поверхности зуба. Стенки дефекта представлены эмалью, дентином и цементом. В настоящее время можно выделить несколько наиболее вероятных теорий возникновения клиновидных дефектов: механическая, химическая, соматическая и генетическая. Тем не менее выделить одну из них как доминирующую нельзя. В российской литературе для клиновидных дефектов выделяют также несколько стадий развития клиновидного дефекта: начальная, поверхностная, средняя и глубокая стадии [8].
Как показывают исследования, в зоне клиновидного дефекта наблюдаются значительные нарушения структуры твердых тканей зуба [5, 8, 19, 24, 26, 27]. Для клиновидных дефектов, как и для других некариозных поражений, возникших после прорезывания зубов, на начальном этапе характерна деминерализация эмали. Деминерализация эмали вызвана действием кислот, способных растворять минеральные структуры зубов [19]. Основной причиной этого частичного растворения поверхности эмали является растворяемость кристаллов гидроксилапатитов кальция при низкой кислотности (pH) [26].
В работе [8] методом растровой электронной микроскопии исследован механизм образования клиновидных дефектов. Обнаружено, что на начальных стадиях развития патологии происходит образование щели между эмалью и цементом, после чего происходит постепенное увеличение области поражения, за счет убыли цемента и дентина. В результате образуется нависающий край эмали. В процессе развития клиновидного дефекта происходит нарушение связи между эмалью и дентином. Под действием различных внешних факторов нависающий край эмали постепенно теряет связь с дентином и откалывается, что приводит к формированию резкой границы между клинически здоровой эмалью и КД и обуславливает увеличение объема поражения с течением времени.
Для более глубоких стадий развития клиновидных дефектов характерна повышенная минерализация дентина, в результате чего наблюдается облитерация дентинных канальцев, которая прослеживается практически по всей площади оголенного дентина, за исключением пограничной области со стороны режущего края, где степень облитерации не полная [8]. Так, например, в работе [24] методом комбинационного рассеяния исследована молекулярная структура дентина при некариозных пришеечных дефектах в зависимости от глубины дефекта. Обнаружено, что для дентина характерно образование гиперминерализованного слоя толщиной около 10 мкм, в котором в отличие от интактной ткани присутствует более высокая концентрация фосфата, более низкая концентрация карбонатзамещенных кристаллов гидроксилапатита кальция, а также высокий уровень кристалличности и частичное разрушение коллагена, концентрация которого (поперечные звенья коллагена) также снижена [27].
Для диагностики клиновидных дефектов методом ЛИФ необходимо понимание механизма свечения не только пораженных, но и интактных участков твердых тканей зубов. В работах [11–15] показано, что флуоресценция твердых тканей зубов имеет различную природу и включает в себя влияние органической (прежде всего структурных элементов коллагена) и неорганической фазы (примесных кристаллов гидроксилапатита кальция). Показано также, что интенсивность свечения эмали зависит от анатомической области и от типа зуба. Данные результаты были связаны с влиянием на спектр флуоресценции эмали соседних тканей, прежде всего ДЭГ и дентина, а также зависимостью оптических свойств эмали от анатомической области. Причем наибольшей интенсивностью свечения обладает как раз многоуровневая по структуре ДЭГ, а наименьшей – эмаль. Как оказалось, сама ДЭГ обладает низким сигналом флуоресценции, в то время как прилегающие к ДЭГ раковистые слои дентина и эмали ‒ интенсивным свечением. Вклад в спектр флуоресценции эмали флуоресцирующих ДЭГ и дентина наибольший именно в пришеечной области, где толщина эмали самая маленькая. Поэтому свечением ДЭГ и дентина обусловлено то, что интенсивность флуоресценции интактной эмали в пришеечной области выше, чем в области экватора или режущего края (рис. 1, а).
Как известно, для поверхностной стадии развития клиновидных дефектов характерна не только убыль эмали в целом, но и появление щелевидных повреждений эмали глубиной до 0,2 мм вблизи эмалево-цементной границы. Убыль эмали, а также наличие трещин может быть причиной наблюдаемого повышения интенсивности свечения эмали в области клиновидного дефекта поверхностной стадии, по сравнению с интактной эмалью (рис. 1, а и б). Действительно, наличие трещин, а также уменьшение толщины эмали в области патологии увеличивает глубину проникновения для возбуждающего флуоресценцию излучения и тем самым удельный вклад свечения ДЭГ и дентина в общий спектр флуоресценции эмали возрастает.
Для средних клиновидных дефектов глубина поражения уже составляет величину от 0,2 до 0,3 мм. Для глубоких клиновидных дефектов характерно поражение глубоких слоев дентина. Как видно из рис. 1, б, для средних и глубоких стадий клиновидного дефекта в отличие от поверхностной стадии характерна уже обратная тенденция к снижению интенсивности свечения, причем для глубокой стадии снижение выше. Подобное спектральное поведение может быть связано с несколькими причинами.
Во-первых, для средних и глубоких стадий характерно исчезновение эмали, разрушение ДЭГ и изменение прилежащих к поверхности дефекта химических и минеральных свойств дентина [5, 8, 19, 24, 26, 27]. Причем для гиперминерализованного слоя дентина характерно снижение карбонатзамещенных кристаллов гидроксилапатита кальция, а также снижение и разрушение перекрестных звеньев коллагена. А поскольку в качестве эндогенных флуорофоров твердых тканей выступают как раз структурные элементы коллагена, а также примесные кристаллы гидроксилапатита кальция и прежде всего карбонатзамещенные кристаллы, то становится понятным наблюдаемое снижение интенсивности свечения участков, пораженных клиновидными дефектами средней и глубокой стадий.
Во-вторых, меняются оптические свойства стенки дефекта. Повышается ее плотность, следовательно, существенно уменьшается глубина проникновения возбуждающего излучения внутрь зуба, и, следовательно, снижается интенсивность свечения.
Начальная стадия клиновидного дефекта характеризуется практически невидимой убылью ткани, в связи с чем на практике очень трудно и редко диагностируется. Тем не менее поскольку для начальной стадии характерно снижение толщины эмали, то можно ожидать, что данная область будет также обладать большей интенсивностью свечения, по сравнению с интактной эмалью.
В заключение рассмотрим результаты по диагностике клиновидных дефектов методом многослойной спиральной компьютерной томографии. Как известно, одним из направлений практического использования рентгеновской компьютерной томографии в стоматологии является диагностика различных заболеваний полости рта, например периодонтитов, пародонтитов, некариозных и кариозных поражений зубов [4, 7]. В данной работе мы также продемонстрировали перспективность данной методики для регистрации клиновидных дефектов. Однако, как показали наши результаты, у данного метода есть ряд существенных ограничений. Во-первых, с помощью данного метода практически невозможно зафиксировать клиновидный дефект начальной и поверхностной стадий развития. А во-вторых, ограничена частота применения данного метода из-за лучевой нагрузки на человека. Тем не менее данный метод может быть также очень эффективен для диагностики клиновидных дефектов средней и глубокой стадий развития при профилактическом осмотре пациентов.
Заключение
Анализ полученных результатов свидетельствует о перспективности применения метода ЛИФ для диагностики и дифференциации различных стадий клиновидного дефекта. Тем не менее при разработке надежного диагностического прибора, способного фиксировать клиновидные дефекты, особенно на начальной стадии их развития, методом ЛИФ, необходимо учитывать ряд аспектов. Во-первых, необходимо учитывать механизм свечения не только пораженных зон, но и интактных участков твердых тканей зубов. Во-вторых, необходимо учитывать особенности морфологического строения, химического и минерального состава твердых тканей в области клиновидного дефекта в зависимости от стадии развития данной патологии. А в-третьих, необходимо привлечение современных математических методов для мультиспектральной обработки информации, например нейросетевые алгоритмы распознавания, алгоритмы, реализующие метод машин опорных векторов и др. [1–3]. Также несомненна перспективность диагностики клиновидных дефектов средней и глубокой стадий методом МСКТ.
Рецензенты:
Ипполитов Ю.A., д.м.н., доцент кафедры детской стоматологии с ортодонтией, ГБОУ ВПО «Воронежский государственный медицинский университет им. Н.Н. Бурденко» Министерства здравоохранения Российской Федерации, г. Воронеж;
Сущенко А.B., д.м.н., профессор кафедры госпитальной стоматологии, ГБОУ ВПО «Воронежский государственный медицинский университет им. Н.Н. Бурденко» Министерства здравоохранения Российской Федерации, г. Воронеж.



