В настоящее время большинством исследователей признан факт высокой распространенности воспалительных изменений миокарда. В некоторых группах больных на фоне тяжелого течения инфекций частота сердечно-сосудистых нарушений, по клиническим симптомам, данным электрокардиографии, эхокардиографии, повышению активности кардиоспецифичных ферментов и тропонина достигает 33–45 % [6]. На практике миокардит диагностируется редко. Патологоанатомически воспалительные признаки в миокарде регистрируют в 4–9 % случаев [1]. Основным этиологическим фактором считаются вирусы [7, 10]. Затруднения при диагностике на практике связаны в первую очередь с недостаточной изученностью возбудителя. Считается, что тяжелое течение Коксаки А вирусной инфекции с миокардитом характерно для лиц с ослабленным иммунитетом, особенно для новорожденных детей [9]. Эффективная этиотропная терапия в настоящее время отсутствует. Снизить степень вирусемии возможно с помощью энтеросорбентов, создающих барьер на поверхности эпителия кишечника. Среди них одно из первых мест занимает диоктаэдрический смектит, внесенный в стандарты терапии инфекционных диарей [3, 4, 5, 11]. Однако действие его на внекишечные проявления инфекции не изучено.
Цель исследования – определить влияние диоктаэдрического смектита на вероятность развития миокардита, его выраженность и летальность при Коксаки А вирусной инфекции в эксперименте.
Материалы и методы исследования
В исследование было включено 45 самцов мышей ВАLB/с в возрасте 2 недель, массой 6–7 грамм. Животные перед включением в исследование наблюдались 7 дней. При обнаружении каких-либо отклонений от нормы особей выбраковывали. В опытную группу вошло 40 мышей, которые были заражены перорально вирусом Коксаки А № 2046 из Государственной коллекции вирусов РГБУ НИИ вирусологии имени Д.И. Ивановского в дозе LD70. Методом случайного распределения они были распределены на 2 группы. Группу А составили 20 животных, которые спустя 3 часа после заражения начали получать перорально диоктаэдрический смектит в дозе 50 мкл/мышь в сутки в течение 3 дней. В группу В вошло 20 животных, которым лечения не назначали. Контрольную группу составили 5 здоровых особей.
Содержание, питание, уход за животными и выведение их из эксперимента проводили согласно требованиям «Правил проведения работ с использованием экспериментальных животных» (Приложение к приказу МЗ СССР от 12.08.1977 г. № 755).
Визуально ежедневно оценивали состояние особей. Исследовали срезы миокарда желудочков и предсердий 35 мышей на 3-и, 7-е, 14-е и 21-е сутки от момента заражения. Погибшие животные (7 из опытной группы В) не подвергались морфологическому исследованию по техническим причинам. После выведения животного из эксперимента препараты промывали, фиксировали с помощью забуференного нейтрального формалина (рН = 7,0) и заливали парафином. С помощью микротома проводили срезы толщиной 5 мкм, затем окрашивали гематоксилином и эозином. Полученные препараты исследовали при помощи оптической световой микроскопии с увеличением 280х, 400х и 630х (окуляры 7х или 10х; объективы 40х и 90х).
Оценку состояния миокарда и кардиомиоцитов проводили по гистологическим параметрам, отражающим состояние кардиомиоцитов, стромы и сосудов на основании имеющихся в литературе рекомендаций [2] с уточнением, по результатам собственных наблюдений. Определяли состояние мембраны, цитоплазмы и форму кардиомоцита; форму ядер клеток; исчерченность миофибрилл; наличие инфильтрации соединительнотканной пластинки; состояние кровеносных сосудов. Полуколичественную оценку изменений проводили по предложенной нами методике [8]. За 1 принимали картину, соответствующую контрольной группе. Умеренным изменениям присваивали 2 балла, выраженным – 3.
Результаты исследования и их обсуждение
У контрольных мышей в миокарде была выявлена картина, соответствующая адаптационной норме (1 балл по всем критериям).
На 3-и сутки после заражения вирусом Коксаки А у животных обеих опытных групп были отмечены сходные изменения, соответствующие умеренно выраженному или выраженному миокардиту, что представлено на рис. 1.
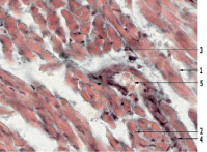
Рис. 1. Миокард мыши на 3-и сутки после заражения вирусом Коксаки А, окраска гематоксилином и эозином, 280х: 1 – нечеткость мембраны кардиомиоцита; 2 – вакуольная дистрофия цитоплазмы кардиомиоцита, отсутствие поперечно-полосатой исчерченности; 3 – гипохромное ядро кардиомиоцита; 4 – инфильтрация межмиокардиальной стромы лимфоцитами, фиброцитами, фибробластами; 5 – полнокровие сосуда
Клеточная мембрана контурировалась нечетко (2); цитоплазма была в состоянии зернисто-вакуольной дистрофии (2). Кардиомиоциты были вытянутой или округлой формы (1, 2), ядра нормохромны, округлы, у особей группы А расположены беспорядочно (1, 2), а в группе В смещены центрально (2). Поперечно-полосатая исчерченность четко не визуализировалась (2). Межмиокардиальная соединительно-тканная пластинка была умеренно отечна с инфильтрацией фиброцитами, фибробластами, лимфоцитами (2). Кровеносные сосуды в группе А были обычного диаметра, иногда не заполнены (1, 2), в группе В – полнокровны (2). Средняя оценка в группе А составила 1,79 ± 0,1 балла, а в группе В – 1,93 ± 0,07 балла, что не имело статистически достоверной разницы (р > 0,05).
На 7-е сутки после заражения у животных обеих групп выявляли нарастание изменений, что соответствовало картине выраженного миокардита. Однако на фоне лечения диоктаэдрическим смектитом отклонения были достоверно менее значительны. На срезах миокарда наблюдали нечеткость мембраны кардиомиоцитов (2); у животных, не получавших лечения, цитолемма местами отсутствовала (2, 3). Цитоплазма находилась в состоянии зернисто-вакуольной дистрофии (2). Большинство кардиомиоцитов имели овально-вытянутую форму (1, 2). Нормохромные ядра у особей группы А были чаще округлыми, располагались в центре или субламеллярно (1, 2), в группе В гиперхромные округлые ядра были смещены к центру цитоплазмы кардиомиоцитов (3). В цитоплазме животных, получавших лечение, поперечно-полосатая исчерченность была нечеткой (2), а у особей без лечения – отсутствовала (3). Соединительнотканная пластинка была отечной и инфильтрированной фиброцитами, фибробластами и единичными лимфоцитами (2). Сосуды были умеренно полнокровны и расширены (2). Средний балл в группе А составил 1,86 ± 0,09, а в группе В – 2,29 ± 0,21 (р < 0,05).
На 14-е сутки от момента заражения в группе А, получавшей диоктаэдрический смектит, в миокарде опытных животных выявляли картину умеренно выраженного миокардита (рис/ 2).
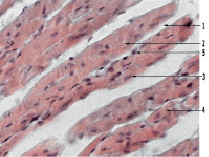
Рис. 2. Миокард мыши на 14-е сутки после заражения вирусом Коксаки А, на фоне лечения диоктаэдрическим смектитом, окраска гематоксилином и эозином, 280х: 1 – отсутствие мембраны кардиомиоцита; 2 – вакуольная дистрофия цитоплазмы кардиомиоцита; 3 – округлое, смещенное к центру ядро кардиомиоцита; 4 – отсутствие поперечно-полосатой исчерченности; 5 – инфильтрация межмиокардиальной стромы лимфоцитами, фиброцитами, фибробластами
Клеточная оболочка кардиомиоцитов была нечеткой (2), разрыхленной. Цитоплазма кардиомиоцитов находилась в состоянии зернисто-вакуольной и вакуольной дистрофии (2, 3); форма кардиомиоцитов была вытянутой (1) или округлой (2); нормохромные ядра были смещены периламеллярно (1). Цитоплазма кардиомиоцитов была с участками нечеткой поперечно-полосатой исчерченности (2) или её отсутствия (3). Соединительнотканная строма миокарда была умеренно отечной и инфильтрированной фибробластами, фиброцитами и единичными лимфоцитами (2). Сосуды умеренно расширены, полнокровны (2). Изменения, в среднем, составили 1,93 ± 0,20 балла.
На 14-е сутки Коксаки А вирусной инфекции в миокарде у животных опытной группы В были выявлены максимальные изменения, что соответствовало картине выраженного миокардита (рис. 3).

Рис. 3. Миокард мыши на 14-е сутки после заражения вирусом Коксаки А, без лечения, окраска гематоксилином и эозином, 280х: 1 – отсутствие мембраны кардиомиоцита; 2 – вакуольная дистрофия цитоплазмы кардиомиоцита; 3 – гипохромное, смещенное к центру ядро кардиомиоцита; 4 – отсутствие поперечно-полосатой исчерченности; 5 – инфильтрация межмиокардиальной стромы лимфоцитами, фиброцитами, фибробластами
Клеточная оболочка не имела четких границ (2). Цитоплазма находилась в состоянии вакуольной дистрофии (3). Форма кардиомиоцитов чаще была овальная (1, 2). Гипохромные ядра располагались в центре цитоплазмы (3). Поперечно-полосатая исчерченность отсутствовала (3). Соединительнотканная пластинка была отечной и инфильтрированной фиброцитами, фибробластами и лимфоцитами (2, 3). Сосуды были полнокровны или неравномерного наполнения (2, 3). Средний балл составил 2,50 ± 0,22 (р < 0,05).
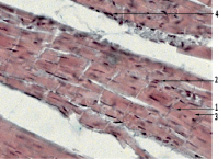
Рис. 4. Миокард мыши на 21-е сутки после заражения вирусом Коксаки А, на фоне лечения диоктаэдрическим смектитом, окраска гематоксилином и эозином, 280х: 1 – мембрана кардиомиоцита; 2 – вытянутое смещенное субламеллярно ядро; 3 – поперечно-полосатая исчерченность; 5 – инфильтрация стромы фиброцитами и фибробластами
На 21-е сутки после заражения в группе А, получавшей диоктаэдрический смектит (рис. 4), отмечали отечность стромы без лимфоцитарной инфильтрации, что можно отнести к остаточным проявлениям миокардита. Клеточная оболочка имела четкие контуры (1). Цитоплазма была в состоянии зернистой дистрофии (1). Большинство кардиомиоцитов имели вытянутую (1) форму. Нормохромные овальные ядра располагались субламеллярно (1). Цитоплазма имела четкую поперечно-полосатую исчерченность (1). Строма была слегка отечной, инфильтрирована фиброцитами и фибробластами (1). Сосуды не были расширены, умеренно полнокровны (2). Средняя оценка изменений составила 1,14 ± 0,14 балла.
В группе В на 21-е сутки лимфоцитарная инфильтрация сохранялась, но была менее выражена, чем на 14-е сутки. Мембрана контурирована (1). Цитоплазма была в состоянии зернистой дистрофии (1). Клетки имели овальную или вытянутую форму (1, 2). Нормохромные ядра располагались в центре цитоплазмы (2). Поперечно-полосатая исчерченность четко визуализировалась (1). Строма была умеренно отечна (1) и минимально инфильтрирована фиброцитами, фибробластами и единичными лимфоцитами (2). Сосуды были полнокровны (2). Средняя оценка составила 1,5 ± 0,19 балла (р < 0,05).
Динамика выраженности изменений схематично представлена на рисунке 5.
Во всех образцах миокарда животных, зараженных вирусом Коксаки А перорально, в дозе LD70, на сроках от 3-х до 14-х суток присутствовали признаки миокардита. Однако степень его выраженности на фоне лечения диоктаэдрическим смектитом была достоверно меньше начиная с 7-х суток. На 21-е сутки Коксаки А вирусной инфекции при применении диоктаэдрического смектита лимфоцитарная инфильтрация в миокарде отсутствовала, тогда как у животных, не получавших лечения, сохранялась. Это, наиболее вероятно, связано с барьерной функцией диоктаэдрического смектита, обеспечивающей снижение количества поступающих в кровоток вирусов.

Рис. 5. Динамика выраженности (в баллах) изменений миокарда у линейных мышей, зараженных вирусом Коксаки А
Выводы
1. При пероральном заражении Коксаки А вирусной инфекцией в дозе LD 70, несмотря на лечение, у всех опытных мышей в сердце выявляется картина миокардита.
2. Степень выраженности поражения миокарда при лечении диоктаэдрическим смектитом линейных мышей, зараженных Коксаки А вирусной инфекцией в эксперименте, достоверно меньше, чем в отсутствии терапии.
Рецензенты:
Макашова В.В., д.м.н., ведущий научный сотрудник клинического отдела инфекционной патологии, Центральный НИИ эпидемиологии, г. Москва;
Усенко Д.В., д.м.н., ведущий научный сотрудник клинического отдела инфекционной патологии, Центральный НИИ эпидемиологии, г. Москва.



