Одним из приоритетных направлений развития медицины в России является переход на собственные инновационные технологии электронной регистрации, хранения, обработки и анализа медицинских изображений органов и тканей пациентов. Это вызвано увеличением объемов информации, представленной в форме изображений, при диагностике социально значимых заболеваний, прежде всего онкологических, лечение которых в большинстве случаев имеет результат только на ранних стадиях.
При проведении диагностики изображений стандарта DICOM [6] определяется патологическая область, при подтверждении ее патологического характера решается задача классификации: отнесение к какому-либо из известных видов или выявление нового класса. Очевидная сложность – дефекты получаемого изображения, обусловленные как физическими ограничениями оборудования, так и допустимыми пределами нагрузки на организм человека. В результате именно на программные средства ложится задача дополнительной обработки изображений с целью повысить их диагностическую ценность для врача, представить в более удобном виде, выделить главное из больших объемов получаемых данных.
Цель исследования. Разрабатываются математические методы сегментации изображений стандарта Dicom для задач распознавания медицинских изображений. Диагностика заболеваний зависит от квалификации исследователя и требует от него визуально проводить сегментацию, а математические методы по обработке растровых изображений являются инструментом для данной диагностики. Обработка полученных аппаратным обеспечением медицинских изображений без предварительной обработки графических данных в большинстве случаев дает неверные результаты. Это связано с тем, что изначально изображения получены неудовлетворительного качества.
Материал и методы исследования
В качестве материала исследований используются компьютерные томограммы пациентов специализированного клинического учреждения. Прежде чем анализировать реальные графические данные, необходимо изображение подготовить или произвести предобработку. Этот этап решает задачу улучшения визуального качества медицинских изображений. Полезно разделить весь процесс обработки изображений на две большие категории: методы, в которых как входными данными, так и выходными являются изображения; методы, где входные данные – изображения, а в результате работы выходными данными выступают признаки и атрибуты, выявленные на базе входных данных. Этот алгоритм не предполагает, что к изображению используется каждый из вышеприведенных процессов. Регистрация данных – первый из процессов, отраженный на рис. 1.
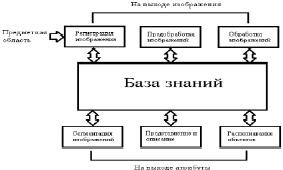
Рис. 1. Основные стадии цифровой обработки графических данных
Регистрация может быть достаточно простой, как в примере, когда исходное изображение является цифровым. Обычно этап регистрации изображения предполагает предварительную обработку данных, к примеру, увеличение масштаба изображения. Улучшение изображения входит в число наиболее простых и впечатляющих направлений предварительной обработки. Как правило, за методами улучшения информативности изображений определена задача поиска плохо различимых пикселей или увеличения контрастности на исходном изображении [3]. Одним из часто используемых методов улучшения информативности изображений является усиление контраста изображения, так как усиливаются границы объекта интереса. Нужно учесть, что улучшение качества изображения – это в определенной степени субъективная задача в обработке изображений. Восстановление изображений – это задача также относится к повышению визуального качества данных. Методы восстановления изображений опираются на математические и вероятностные модели деформации графических данных. Обработку изображений как этап следует отделять от понятия обработки изображения как всего процесса изменений изображения и получения некоторых данных. Сегментация или процесс выделения объектов интереса делит изображение на составляющие объекты или части. Автоматизированное выделение объектов интереса является в определенной степени сложной задачей цифровой обработки изображений. Слишком детализированная сегментация делает процесс обработки изображения затруднительным, если необходимо выделить объекты интереса. Но некорректная или недостаточно детализированная сегментация в большинстве задач приводит к ошибкам на заключительном этапе обработки изображений. Представление и описание графических данных, как правило, следуют за этапом выделения объектов интереса на изображении, на выходе которого в большинстве случаев имеются необработанные пиксели, образующие границы области или формируют все пиксели областей. При таких вариантах требуется преобразование данных в вид, доступный для компьютерного анализа. Распознавание образов является процессом, который определяет к какому-либо объекту идентификатор (например, «лучевая кость») на основании его описаний [4]. Определим взаимосвязь базы знаний с модулями обработки изображений. База знаний (то есть информация о проблемной области) некоторым образом зашифрована внутри самой системы обработки изображений. Это знание может быть достаточно простым, как, например, детальное указание объектов изображения, где должна находиться зона интереса. Такое знание дает возможность ограничения области поиска. База знаний управляет работой каждого модуля обработки и их взаимодействием, что отражено на рис. 1 стрелками, направленными в две стороны между модулями и базой знаний. Сохранение и печать результатов часто также требует использования специальных методов обработки изображений. Недостаток этих этапов обработки изображения в системе обработки медицинских изображений заключается в том, то, что ошибки, созданные на первых этапах обработки, к примеру при вводе или выделения объектов интереса на изображении, могут привести к невозможности корректной классификации. Обработка данных производится строго последовательно, и в большинстве случаев отсутствует возможность возвращения на предыдущие этапы обработки, даже если ранее были получены некорректные результаты [2]. Методы на этапе предварительной обработки достаточно разнообразны – выделение объектов интереса, их масштабирование, цветовая коррекция, корректировка пространственного разрешения, изменение контрастности и т.п. Одно из приоритетных действий на этапе предварительной обработки изображения – это корректировка контрастности и яркости. При использовании соответствующих масок возможно объединить два этапа (фильтрация и предварительная обработка) для увеличения скорости анализа данных. Заключительный результат анализа изображений в большинстве случаев определен уровнем качества сегментации, а степень детализации объектов интереса зависит от конкретной поставленной задачи [4]. По этой причине не разработан отдельный метод или алгоритм, подходящий для решения всех задач выделения объектов интереса. Оконтуривание областей предназначено для выделения на изображениях объектов с заданными свойствами. Данные объекты, как правило, соответствуют объектам или их частям, которые маркируют диагносты. Итогом оконтуривания является бинарное или иерархическое (мультифазное) изображение, где каждый уровень изображения соответствует определенному классу выделенных объектов. Сегментация – это сложный этап в обработке и анализе медицинских данных биологических тканей, поскольку необходимо оконтуривать области, которые соответствуют разным объектам или структурам на гистологических уровнях: клеткам, органоидам, артефактам и т.д. Это объясняется высокой вариабельностью их параметров, низким уровнем контрастности анализируемых изображений и сложной геометрической взаимосвязью объектов. В большинстве случаях для получения максимально эффективного результата необходимо последовательно использовать разные методы сегментации объектов интереса на изображении. К примеру, для определения границ объекта интереса применяется метод морфологического градиента, после которого для областей, которые подходят незначительным перепадам характеристик яркости, проводится пороговая сегментация [8]. Для обработки изображений, у которых несвязанные однородные участки различны по средней яркости, был выбран метод сегментации Canny, исследования проводятся на клиническом примере. При распознавании реальных клинических изображений моделирование плохо применимо. Большое значение имеет практический опыт и экспертные заключения об итоге анализа изображений. Для тестового изображения выбран снимок компьютерной томографии, где в явном виде присутствует объект интереса, представленный на рис. 2.
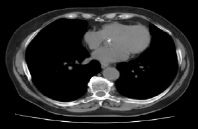
Рис. 2. Снимок компьютерной томографии с объектом интереса
Для реализации сегментирования используем метод Canny [1, 5]. Такой подход устойчив к шуму и демонстрирует в большинстве случаев лучшие результаты по отношению к другим методам. Метод Canny включает в себя четыре этапа:
1) предобработка – размытие изображения (производим уменьшение дисперсии аддитивного шума);
2) проведение дифференцирования размытого изображения и последующее вычисление значений градиента по направлениям x и y;
3) реализация не максимального подавления на изображении;
4) пороговая обработка изображения [5, 7].
На первом этапе алгоритма Canny происходит сглаживание изображения с помощью маски фильтром Гаусса. Уравнение распределения Гаусса в N измерениях имеет вид
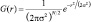 (1)
(1)
или в частном случае для двух измерений
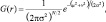 (2)
(2)
где r – это радиус размытия, r2 = u2 + v2; σ – стандартное отклонение распределения Гаусса.
Если используем 2 измерения, то эта формула задает поверхность концентрических окружностей, имеющих распределение Гаусса от центральной точки. Пиксели с распределением, отличным от нуля, используются для задания матрицы свертки, применяемого к исходному изображению. Значение каждого пикселя становится средневзвешенным для окрестности. Начальное значение пикселя принимает максимальный вес (имеет максимальное Гауссово значение), а соседние пиксели принимают минимальные веса, в зависимости от расстояния до них [1]. Теоретически распределение в каждой точке изображения должно быть ненулевым, что следует расчету весовых коэффициентов для каждого пикселя изображения. Но практически при расчёте дискретного приближения функции Гаусса не учитываются пиксели на расстоянии > 3σ, поскольку оно достаточно мало. Таким образом, программе, обрабатывающей изображение, необходимо рассчитать матрицу [6σ]×[6σ], чтобы дать гарантию достаточной точности приближения распределения Гаусса [8].
Результаты исследования и их обсуждение
Результат работы фильтра Гаусса при данных равных 5 для размера маски гаусса и 1,9 значении параметра σ – стандартного отклонения распределения Гаусса, представлен на рис. 3. Следующим шагом осуществляется поиск градиента области интереса при помощи свертки сглаженного изображения с производной от функции Гаусса в вертикальном и горизонтальном направлениях вектора.
Применим оператор Собеля для решения данной задачи [7]. Процесс базируется на простом перемещении маски фильтра от пикселя к пикселю изображения. В каждом пикселе (x, y) отклик фильтра вычисляется с предварительно определённых связей. В результате происходит первоначальное выделение краев. Следующим шагом происходит сравнение каждого пикселя с его соседями вдоль направления градиента и вычисляется локальный максимум. Информация о направлении градиента необходима для того, чтобы удалять пиксели рядом с границей, не разрывая саму границу вблизи локальных максимумов градиента, которое значит, что пикселями границ определяются точки, в которых достигается локальный максимум градиента в направлении вектора градиента. Такой подход позволяет существенно снизить обнаружение ложных краев и обеспечивает толщину границы объекта в один пиксель, что эмпирически подтверждается программной реализацией алгоритма сегментирования среза брюшной полости на снимке компьютерной томографии, представленного ниже на рис. 4.
Следующий шаг – использование порога, для определения нахождения границы в каждом заданном пикселе изображения. Чем меньше порог, тем больше границ будет находиться в объекте интереса, но тем более результат будет восприимчив к шуму, и оконтуривать лишние данные изображения. Высокий порог может проигнорировать слабые края области или получит границу несколькими областями. Оконтуривание границ применяет два порога фильтрации: если значение пикселя выше верхней границы – он принимает максимальное значение (граница считается достоверной), если ниже – пиксель подавляется, точки со значением, попадающим в диапазон между порогов, принимают фиксированное среднее значение. Пиксель присоединяется к группе, если он соприкасается с ней по одному из восьми направлений. Среди достоинств метода Canny можно считать то, что при обработке изображения осуществляется адаптация к особенностям сегментирования. Это достигается через ввод двухуровневого порога отсечения избыточных данных. Определяются два уровня порога, верхний – phigh и нижний – plow, где phigh > plow. Значения пикселей выше значения phigh обозначаются как соответствующие границе (рис. 5).
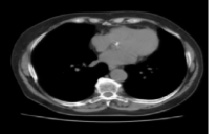
Рис. 3. Применение фильтра Гаусса на компьютерной томограмме с объектом интереса
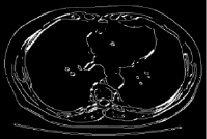
Рис. 4. Подавления не-максимумов на сегментируемом изображении
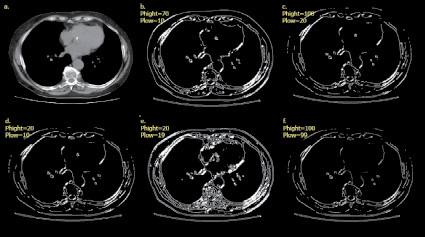
Рис. 5. Применение алгоритма сегментации Canny c разными значениями уровней порога
Практика показывает, что имеется некоторый интервал на шкале уровней порога чувствительности, при котором значение площади объекта интереса фактически неизменимое, но при этом существует определенный пороговый уровень, после которого отмечается «срыв» метода оконтуривания и итог выделения областей интереса становится неопределенным [8]. Этот недостаток алгоритма, который можно компенсировать объединением алгоритма Canny с преобразованием Хафа для поиска окружностей. Сочетание алгоритмов позволяет максимально четко выделять объекты исследования, а также устранять разрывы в контурах [7].
Выводы
Таким образом, решена задача формулирования типовых характеристик патологических объектов на медицинских изображениях, что даст возможность в дальнейшем проводить оперативный анализ данных по конкретным патологиям. Важными параметрами для определения оценки качества сегментации являются вероятности ложной тревоги и пропуска – отказа. Эти параметры определяют применение автоматизации метода анализа. Сегментация при решении задачи классификации и распознавания объектов на изображениях является одной из первостепенных. Достаточно хорошо исследованы и применяются методы оконтуривания, базирующиея на сегментировании границ областей – Sobel, Canny, Prewit, Laplassian. Такой подход определен тем, что концентрация внимания человека при анализе изображений фокусируется зачастую на границах между более или менее однородными по яркости зонами. Исходя из этого, контуры часто выполняют задачу основы определения различных характеристик для интерпретирования изображений и объектов на них. Основная задача алгоритмов сегментирования зон интересов – это построение бинарного изображения, которое содержит замкнутые структурные области данных на изображении. Относительно к медицинским изображениям данными областями выступают границы органов, вены, МКЦ, а также опухоли. Разработанные принципы компьютерного автоматизированного анализа медицинских изображений эффективно используются как для оперативных задач медицинской диагностики специализированного онкологического учреждения, так и в учебных целях.
Исследовано при поддержке программы «Дальний Восток», грант № 15-I-4-014o.
Рецензенты:
Косых Н.Э., д.м.н., профессор, главный научный сотрудник, ФГБУН «Вычислительный центр» ДВО РАН, г. Хабаровск;
Левкова Е.А., д.м.н., профессор, ГОУ ВПО «Дальневосточный государственный университет путей сообщения», г. Хабаровск.



