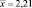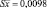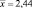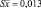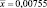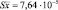Многие препараты, используемые для коррекции патологических состояний печени, не лишены побочных эффектов, что особенно опасно при длительном приёме. Предпочтение здесь следует отдавать комплексным препаратам растительного происхождения, способным нормализовать метаболизм, функции и структуру паренхимы печени, стимулирующим синтез нуклеиновых кислот и белка, а также обладающих холекинетическими и иммуномодулирующими свойствами [3]. В этом плане наше внимание привлекли препараты расторопши пятнистой, бессмертника песчаного и биомасса гриба Fusarium sambucinum (Милайф®).
Нами разработан состав и технология таблеток, покрытых пленочной оболочкой, включающих порошок биомассы Fusarium sambucinum, сухие экстракты расторопши пятнистой и бессмертника песчаного (условное название «Рабемил») [4].
Целью работы явилась разработка методик идентификации и количественного определения основных биологически активных веществ в таблетках, включающих порошок биомассы Fusarium sambucinum, сухие экстракты расторопши пятнистой и бессмертника песчаного, покрытых пленочной оболочкой.
Материалы и методы исследования
В работе использовались спектрофотометрические и хроматографические методы анализа, установленные требованиями Государственной фармакопеи ХI и ХII изданий, а также Европейской фармакопеи [1, 2, 5].
Результаты исследования и их обсуждение
Первым этапом работы явилось определение подлинности флавоноидов в экстракте цветков бессмертника песчаного сухом и экстракте расторопши сухом
Для определения флавоноидов в экстрактах были использованы химические и физико-химические методы.
Качественная реакция:
К 0,05 г экстракта прибавляли 1 мл спирта этилового 95 % в 0,1 г порошка магния, 1 мл кислоты хлористоводородной концентрированной. Наблюдали постепенное появление красного окрашивания.
Спектры поглощения
Изучение спектров поглощения спиртового раствора экстрактов бессмертника песчаного и расторопши пятнистой показало, что из-за перехода в экстракт суммы действующих веществ, извлекаемых из исходного сырья, УФ-спектр имеет полосы поглощения, которые трудно отнести к полосам конкретных действующих веществ. Для большей достоверности использовали дифференциальные спектры поглощения комплекса суммы флавоноидов бессмертника и расторопши с алюминия хлоридом. Оба спектра характеризуются полосой поглощения в области 410 ± 2 нм.
Для получения дифференциальных спектров 0,5 г экстракта вносили в мерную колбу вместимостью 25 мл, доводили до метки спиртом этиловым 95 %-ным, фильтровали. В две мерные колбы вместимостью 25 мл вносили по 1 мл фильтрата для экстракта бессмертника или 2 мл экстракта расторопши. В первую колбу прибавляли 10 мл спирта этилового 95 % и 2 мл 2 % спиртового раствора алюминия хлорида. Через 10 минут добавляли 0,1 мл кислоты уксусной разведенной, доводили до метки спиртом этиловым 95 % (раствор А). Во вторую колбу прибавляли 10 мл спирта этилового 95 % и 0,1 мл кислоты уксусной разведенной, доводили до метки спиртом этиловым 95 % (раствор Б).
Через 30 минут измеряли оптическую плотность раствора А на спектрофотометре СФ-56 в кювете с толщиной слоя 1 см. В качестве раствора сравнения использовали раствор Б.
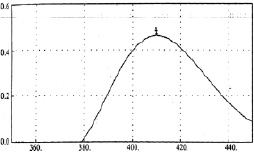
Рис. 1. Спектр поглощения 0,002 % раствора стандартного образца (СО) рутина
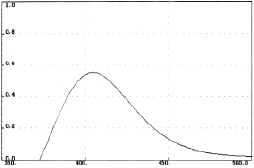
Рис. 2. Спектр поглощения флавоноидов продукта взаимодействия сухого экстракта бессмертника песчаного с алюминия хлоридом
Нами были измерены дифференциальные спектры поглощения комплекса суммы флавоноидов цветков бессмертника песчаного, расторопши и комплекса рутина с алюминием хлоридом. Все три спектра близки по положению максимумов (рис. 1, 2, 3).
Основными действующими веществами семян расторопши являются флавоноиды и флавонолигнаны (силибин, силикристин, силидианин и др.). Содержание флаволигнанов в смесях в пересчете на СО силибин осуществляется методом спектрофотометрии при длине волны 289 нм (рис. 3).
Однако на спектре поглощения имеется максимум в более длинноволновой области (рис. 4).
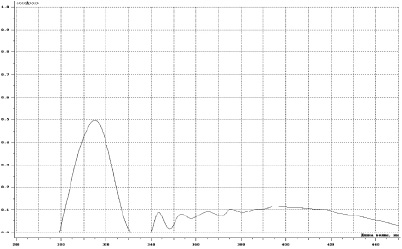
Рис. 3. Спектр поглощения флавоноидов продукта взаимодействия сухого экстракта расторопши с алюминия хлоридом
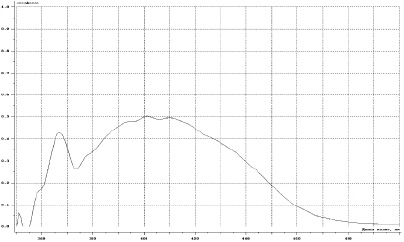
Рис. 4. Спектр поглощения флавоноидов продукта взаимодействия сухого экстракта расторопши с алюминия хлоридом в длинноволновой области спектра
Так как перед нами стояла задача определения суммы флавоноидов в таблетках, содержащих экстракты расторопши и бессмертника песчаного, то в качестве стандарта использовали рутин, который чаще других применяется при количественном определении суммы флавоноидов в растительном сырье.
Хроматографический анализ
Для идентификации флавоноидов в экстрактах использовали хроматографию в тонком слое сорбента. На линию старта наносили 1 мкл раствора экстракта, 0,002 % раствор СО рутина в спирте этиловом 95 %, раствор СО лютеолина в спирте этиловом 95 % и раствор СО изосалипурпозида в спирте этиловом 95 %. Хроматографировали восходящим способом в системе растворителей: бутанол-1 – кислота уксусная ледяная – вода (4:1:5), детектировали в УФ-свете (365 нм).
Экстракт цветков бессмертника песчаного
На хроматограмме раствора испытуемого образца на уровне СО изосалипурпозида обнаружили пятно желто-бурого цвета [Rf 0,80 ± 0,05]. На уровне СО лютеолина также обнаружили пятно желто-бурого цвета [Rf 0,95 ± 0,03]. Оба пятна после обработки раствором алюминия хлорида 2 % в спирте этиловом 95 % приобрели ярко-желтое окрашивание (рис. 5).
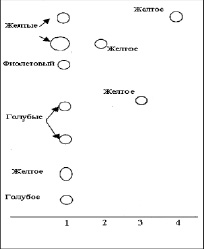
Рис. 5. Хроматограмма флавоноидов в экстракте бессмертника: 1 – 0,01 % раствор экстракта бессмертника песчаного; 2 – 0,002 % раствор СО изосалипурпозида; 3 – 0,002 % раствор СО рутина; 4 – 0,002 % раствор СО лютеолина
Таким образом, растворы СО изоалипурпозида и лютеолина могут быть использованы для идентификации флавоноидов цветков бессмертника песчаного.
Так как в настоящее время изосалипурпозид – стандарт на территории Российской Федерации не выпускается, дополнительно в качестве стандартного образца был использован один из наиболее доступных в настоящее время флавоноидов – рутин. Значение Rs пятна изосалипурпозид (извлечение), рассчитанное относительно рутина (Rf 0,56 ± 0,02), составило 1,47.
Экстракт расторопши
На хроматограмме раствора испытуемого образца на уровне СО лютеолина и СО рутина обнаружены пятна желто-бурого цвета. Оба пятна после обработки раствором алюминия хлорида 2 % в спирте этиловом 95 % приобрели ярко-желтое окрашивание (рис. 6).
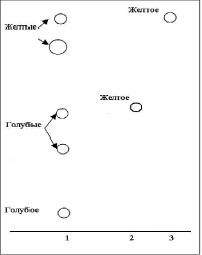
Рис. 6. Хроматограмма флавоноидов экстракта расторопши: 1 – 0,01 % раствор экстракта расторопши; 2 – 0,002 % раствор СО рутина; 3 – 0,002 % лютеолина
Определение содержания суммы флавоноидов в экстрактах цветков бессмертника песчаного сухого и расторопши
Для выполнения анализа 0,5 экстракта вносили в мерную колбу вместимостью 25 мл, доводили спиртом этиловым 95 %-ным до метки, фильтровали, отбрасывали первые порции фильтрата. В две мерные колбы вносили по 1 мл фильтрата и далее поступали, как описано в методике определения подлинности суммы флавоноидов спектрофотометрическим методом.
Параллельно с измерением исследуемых растворов измеряют оптическую плотность раствора СО рутина.
В мерные колбы вместимостью 25 мл помещают по 1 мл раствора СО рутина, далее поступают, как указано в методике выше.
Приготовление 0,002 % раствора СО рутина. Около 0,05 г (точная навеска) СО рутина растворяли в спирте этиловом 95 %, в мерной колбе вместимостью 100 мл; охлаждали, доводили объем раствора тем же растворителем до метки.
Содержание суммы флавоноидов в пересчете на рутин (Хг, га 100 г экстракта) рассчитывали по формуле
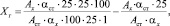
где Ах – оптическая плотность исследуемого раствора; Аст – оптическая плотность СО раствора рутина; αст – навеска СО рутина, г; αх – навеска сухого экстракта бессмертника или расторопши.
Результаты определения суммы флавоноидов в экстракте цветков бессмертника песчаного сухом в пересчете на рутин приведены в табл. 1.
Таким образом, содержание флавоноидов в 100 г экстракта цветков бессмертника песчаного в пересчете на рутин составляет 2,21 г ± 0,025 %. Относительная погрешность определения ± 1,15 %.
Результаты определения суммы флавоноидов в экстракте расторопши сухом в перечете на рутин приведены в табл. 2.
Таким образом, содержание флавоноидов в экстракте расторопши в пересчете на рутин составляет 2,44 ± 0,034. Относительная погрешность определения ± 1,38 %
Определение содержания суммы флавоноидов в таблетках
Для выяснения влияния на спектр поглощения порошка Милайфа и вспомогательных веществ, входящих в состав таблеток, готовили модельную смесь без экстрактов цветков бессмертника песчаного и расторопши, измеряли спектр поглощения после добавления раствора алюминия хлорида. Оказалось, что при данном разведении оптическая плотность практически равнялась нулю.
Таким образом, милайф и вспомогательные вещества не мешают определению суммы флавоноидов в таблетках.
Для выполнения анализа 0,5 г (точная навеска) порошка растертых таблеток вносили в мерную колбу вместимостью 25 мл, добавляли 15 мл спирта этилового 95 %, перемешивали, доводили тем же растворителем до метки, фильтровали, отбрасывали первые порции фильтрата. В две мерные колбы вносили по 2 мл фильтрата и далее поступали, как описано в методике определения подлинности суммы флавоноидов спектрофотометрическим методом.
Таблица 1
Результаты количественного определения суммы флавоноидов в экстракте цветков бессмертника песчаного сухом (Аст = 0,430)
|
Навеска (г) |
Ах |
Найдено флавоноидов, % |
Метрологические характеристики |
|
0,5040 |
0,385 |
2,224 |
|
|
0,4911 |
0,377 |
2,235 |
S = 0,241 |
|
0,4859 |
0,368 |
2,202 |
|
|
0,5062 |
0,386 |
2,217 |
Δх = 0,0252 |
|
0,5121 |
0,382 |
2,169 |
х ± Δх = 2,21 ± 0,025 |
|
0,4960 |
0,380 |
2,227 |
ε = ± 1,15 % |
Таблица 2
Результаты количественного определения суммы флавоноидов в экстракте расторопши сухом (Аст = 0,430)
|
Навеска (г) |
Ах |
Найдено флавоноидов г/100 г экстракта |
Метрологические характеристики |
|
0,5145 |
0,429 |
2,423 |
|
|
0,4958 |
0,423 |
2,480 |
S = 0,032 |
|
0,4983 |
0,413 |
2,412 |
|
|
0,4837 |
0,400 |
2,406 |
Δх = 0,082 |
|
0,5074 |
0,432 |
2,473 |
х ± Δх = 2,44 ± 0,034 |
|
0,5179 |
0,437 |
2,455 |
ε = ± 1,38 % |
Таблица 3
Результаты количественного определения суммы флавоноидов в таблетках (Аст = 0,430)
|
Навеска (г) |
Ах |
Найдено флавоноидов, г |
Метрологические характеристики |
|
0,5143 |
0,385 |
0,0075 |
|
|
0,5090 |
0,377 |
0,0078 |
S = 1,87∙10–4 |
|
0,4915 |
0,368 |
0,0074 |
|
|
0,5121 |
0,386 |
0,0077 |
Δх = 4,87∙10-4 |
|
0,4935 |
0,382 |
0,0073 |
х ± Δх = 0,0075 ± 1,76∙10–4 |
|
0,4991 |
0,380 |
0,0076 |
ε = ± 2,60 % |
Параллельно с измерением исследуемых растворов измеряют оптическую плотность 0,002 % раствора СО рутина.
В мерные колбы вместимостью 25 мл помещают по 1 мл раствора СО рутина, далее поступают, как указано в методике выше.
Содержание суммы флавоноидов в таблетке пересчете на рутин (Хг) рассчитывали по формуле

где Ах – оптическая плотность исследуемого раствора; Аст – оптическая плотность СО раствора рутина; αст – навеска СО рутина, г; αх – навеска порошка растертых таблеток, г; Р – средняя масса таблетки, г.
Результаты определения суммы флавоноидов в таблетках в пересчете на рутин приведены в табл. 3.
Таким образом, содержание флавоноидов в таблетках в пересчете на рутин составляет 0,0075 г ± 1,76∙10–4. Относительная погрешность определения ± 2,60 %.
Выводы
1. Разработаны методики качественного и количественного анализа основных биологически активных веществ таблеток, включающих порошок биомассы Fusarium sambucinum, сухие экстракты расторопши пятнистой и бессмертника песчаного.
2. Для определения флавоноидов в экстрактах использовали метод дифференциальной спектрофотометрии и хроматографию в тонком слое сорбента, где в качестве стандартных образцов использовали изосалипурпозид, лютеолин и рутин.
3. Для количественного определения содержания суммы флавоноидов в экстрактах цветков бессмертника песчаного сухого и расторопши использовали спектрофотометрию в видимой области (длина волны – 410 нм) по реакции с алюминия хлоридом (стандартный образец – рутин). Нормы качества разработанных таблеток установлены согласно требованиям Государственной фармакопеи РФ ГФ ХI и ХII изданий, а также Европейской фармакопеи.
Рецензенты:
Сампиев А.М., д.фарм.н., профессор, зав. кафедрой фармации, ГБОУ ВПО «Кубанский государственный медицинский университет» МЗ РФ, г. Краснодар;
Репс В.Ф., д.б.н., профессор, зав. отделом изучения механизмов действия физических факторов, ФГБУ «Пятигорский государственный НИИ курортологии» ФМБА России, г. Пятигорск.