Целлюлоза – это один из наиболее распространённых природных полисахаридов, который является составным компонентом большинства растительных материалов. Недостатком растительных целлюлоз (кроме хлопковой) является наличие значительных количеств примесей: лигнина, гемицеллюлоз, экстрактивных и минеральных веществ. В отличие от растительной целлюлозы бактериальная целлюлоза (БЦ) имеет ряд преимуществ: высокая чистота, более высокая механическая прочность, кристалличность и гидрофильность при наличии такой же структуры, как и у растительной целлюлозы [9]. В настоящее время ведутся исследования свойств и поиски применения БЦ [6, 10, 11].
Одним из перспективных продуцентов БЦ является Мedusomyces gisevii. Этот уникальный симбиоз, образованный разными видами дрожжей и уксуснокислых бактерий. Дрожжевые клетки преобразуют источники углерода и синтезируют этанол, стимулирующий уксуснокислые бактерии к синтезу БЦ, уксуснокислые бактерии синтезируют плавающую целлюлозную сетку, которая защищает клетки дрожжей от неблагоприятных условий окружающей среды. Симбиоз обладает огромным адаптивным потенциалом. Благодаря подвижным симбиотическим отношениям культура легко приспосабливается к изменению внешних условий, стрессам, способна утилизировать различные субстраты, устойчива к фагам [8]. С учетом вышеизложенного целесообразно использовать культуру Мedusomyces gisevii для биосинтеза БЦ.
Целью данной работы являлось культивирование БЦ на синтетической глюкозной среде с помощью Мedusomyces gisevii и исследование её физико-химических свойств, в том числе исследования структуры методом инфракрасной спектроскопии и распределения значений диаметра микрофибрилл в образцах БЦ.
Материалы и методы исследования
В экспериментах использовалась синтетическая питательная среда, приготовленная растворением глюкозы в экстракте черного чая (12 г чая на 1 л воды). В качестве инокулята использовалась семидневная симбиотическая культура, выращенная на глюкозной среде, доза внесения составляла 10 %. Начальная концентрация глюкозы составила 20 г/л, уровень активной кислотности саморегулировалcя симбиозом [5]. Выбор концентрации глюкозы и активной кислотности обоснован в статье [4]. Культивирование проводилось в статических условиях при (25 ± 2) °С в течение 13 суток в реакторе объёмом 16 л, коэффициент заполнения 50 %.
Структура бактериальной целлюлозы была исследована на инфракрасном спектрофотометре «Инфралюм ФТ-801» в таблетках KBr.
Определение физико-химических характеристик БЦ (массовой доли кислотонерастворимого лигнина, массовой доли золы, массовой доли альфа-целлюлозы, степени полимеризации целлюлозы) проводили согласно стандартным методикам [7]. Влажность была установлена на определителе влажности МВ 23.
Исследование структуры микрофибрилл бактериальной целлюлозы проводили при помощи электронного растрового микроскопа Zeiss SIGMA VP (ЦКП НО «Арктика», САФУ, г. Архангельск).
Результаты исследования и их обсуждение
Гель-плёнка, образующаяся в результате культивирования инокулята, загрязнена остатками компонентов питательной среды, метаболитами и клетками микроорганизмов. Очистка плёнок может быть проведена разными способами: растворами кислот и щелочей, энзимной обработкой, при этом может изменяться диаметр и распределение микрофибрилл БЦ [2].
В данной работе образцы пленок были очищены следующим способом: в течение двух суток пленка выдерживалась в 2 %-м растворе NaOH для удаления клеток, затем пленка промывалась в дистиллированной воде до нейтральной реакции, после этого пленку обрабатывали в течение суток в 2 %-м растворе HCl для удаления красящих веществ чая, затем пленка промывалась дистиллированной водой до нейтральной реакции среды. Плёнка высушивалась при комнатной температуре в расправленном состоянии.
Методом инфракрасной спектроскопии была установлена структура бактериальной целлюлозы. Сравнение полос поглощения функциональных групп в образцах бактериальной целлюлозы с литературными данными для бактериальной целлюлозы, выращенной с помощью продуцента Acetobacter [12], представлено в табл. 1.
Интенсивная полоса 3200–3600 см–1 обусловлена валентными колебаниями OH-групп. Менее интенсивная в области 2800–3000 см–1 обусловлена валентными колебаниями групп CH2, CH. В спектре целлюлозы интенсивная полоса с максимумом при 1641 см–1 принадлежит деформационным колебаниям OH-групп прочно связанной воды. Полоса при 1281 см–1 указывает на валентные колебания OH-групп в спиртах. Полосы поглощения в области 1000–1200 см–1 обусловлены в основном валентными колебаниями C–O–C и C–O в спиртах. Полоса при 899 см–1 подтверждает наличие β-1,4 связей. ИК-спектры показывают, что БЦ не содержит примесей, в частности лигнина, присутствующего в растительной целлюлозе, так как отсутствуют полосы поглощения, характерные для ароматических соединений (лигнина).
Таблица 1
Отнесение полос поглощения функциональных групп в образце бактериальной целлюлозы
|
Отнесение полос поглощения* |
Максимум полосы поглощения, см–1 |
|
|
БЦ |
БЦ [12] |
|
|
ν OH-групп, участвующих в межмолекулярных и внутримолекулярных H-связях |
3432 |
3408 |
|
ν связей в группах CH и CH2 |
2919 2852 |
2897 |
|
ν присутствия аминокислот |
2135 2234 |
– |
|
δ связей HOH обусловлено присутствием прочно связанной воды |
1641 |
1635 |
|
δ групп OH в CH2OH |
1281 |
1370 |
|
ν связей C-O (характерные для полисахаридов полосы, обусловленные наличием ацетильных связей C-O-C и связей С-О в спиртах) |
1059 |
1163 1060 |
|
β-1,4 связи |
899 |
899 |
Примечания: * ν – валентные колебания, δ – деформационные колебания, БЦ – бактериальная целлюлоза.
В отличие от литературных данных [12], в спектре присутствуют слабые полосы при 2135 и 2234 см–1, указывающие на наличие аминокислот, которые могут принадлежать остаткам клеток дрожжей и бактерий [1].
Полученный образец БЦ был проанализирован по стандартным методикам [7] для определения физико-химических показателей, представленных в табл. 2, в сравнении с данными хлопковой целлюлозы [3].
Таблица 2
Физико-химические показатели бактериальной целлюлозы в сравнении с хлопковой
|
Показатели* |
БЦ |
Хлопковая целлюлоза [3] |
|
Степень полимеризации целлюлозы |
2000 |
2000 |
|
Массовая доля золы, % |
0,14 |
0,10 |
|
Массовая доля кислотонерастворимого лигнина, % |
0,80 |
0,50 |
Примечание. * – в пересчете на а.с.в.
Воздушно-сухая БЦ содержит 4,7 масс. % влаги. Степень полимеризации микробиологической БЦ соответствует степени полимеризации растительной хлопковой целлюлозы, пригодной для химической модификации.
Согласно данным [9] в компонентном составе БЦ отсутствуют примеси лигнина и других сопутствующих компонентов. С целью подтверждения этого факта в образце БЦ была определена массовая доля кислотонерастворимого лигнина по стандартной методике [7], значение – 0,80 %. Данный показатель превышает массовую долю кислотонерастворимого лигнина в хлопковой целлюлозе. Однако можно предположить, что кислотонерастворимый осадок в данном случае представляет собой не истинный лигнин, а кислотонерастворимые лигниноподобные вещества, например фенольные и красящие вещества чая, которые присутствуют в питательной среде. Массовая доля золы в образцах БЦ сравнима с зольностью хлопковой целлюлозы. При попытке определить массовую долю альфа-целлюлозы по стандартной методике для хлопковой целлюлозы было обнаружено, что измельченный образец, помещенный в 17,5 %-ный раствор гидроксида натрия, не набухает и не растворяется. Содержание альфа-целлюлозы в образце составило 101,6 %, – это свидетельствует о недостаточной промывке образца от гидроксида натрия, а также о высоком содержании высокополимерной целлюлозы.
На рис. 1 приведена сетчатая структура бактериальной целлюлозы, сформированная микрофибриллами.
Для анализа структуры микрофибрилл БЦ проводили статистическую обработку значений их диаметра. В расчете использовали выборку данных, включающую 1000 измерений. На рис. 2 представлено распределение значений диаметров микрофибрилл БЦ от частоты их встречаемости в образце, средний диаметр которой составляет 30,6 нм.
Среднее квадратичное отклонение равно 164,7. Это означает, что диаметры 12,4 % единиц выборочной совокупности отклоняются от среднего арифметического диаметра не более чем на ±5,2 % для БЦ. Основная ошибка среднего значения является величиной, на которую может отличаться среднее значение выборочной совокупности при том условии, что распределение изучаемого признака приближается к нормальному. Таким образом, среднее значение диаметра фибрилл равно (30,6 ± 5,0) нм.
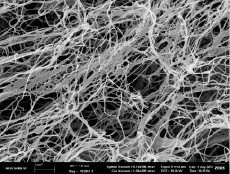
Рис. 1. Структура микрофибрилл БЦ
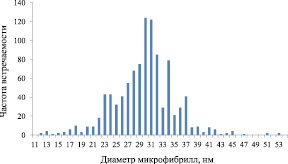
Рис. 2. Распределение значений диаметра микрофибрилл БЦ
Выводы
Исследовано культивирование бактериальной целлюлозы на синтетической глюкозной среде с использованием симбиотической культуры Мedusomyces gisevii. Определены физико-химические свойства очищенного химическими методами образца: массовая доля кислотонерастворимого лигнина, зольность, степень полимеризации целлюлозы и влажность. Установлено, что степень полимеризации бактериальной целлюлозы близка к степени полимеризации хлопковой целлюлозы. Методом инфракрасной спектроскопии выявлено, что полученный ИК-спектр не содержит полос поглощения, характерных для ароматических соединений (лигнина), что подтверждает чистоту полученного образца и соответствует основным полосам поглощения функциональных групп бактериальной целлюлозы, выращенной с помощью продуцента Acetobacter. Методом электронной микроскопии изучено распределение значений диаметра микрофибрилл в образце бактериальной целлюлозы, в результате установлена упорядоченная структура и рассчитан средний диаметр микрофибрилл 30,6 нм.
Исследование структуры микрофибрилл выполнено с использованием оборудования ЦКП НО «Арктика» (САФУ, г. Архангельск) при финансовой поддержке Минобрнауки РФ (уникальный идентификатор работ RFMEFI59414X0004). Автор выражает признательность администрации ЦКП НО «Арктика» и Чухчину Дмитрию Германовичу, к.т.н., доценту.
Рецензенты:
Канарский А.В., д.т.н., профессор кафедры пищевой биотехнологии, ФГБОУ ВПО «Казанский национальный исследовательский технологический университет», г. Казань;
Меледина Т.В., д.т.н., профессор, заведующая кафедрой пищевой биотехнологии продуктов из растительного сырья Института холода и биотехнологий, ФГАОУ ВО «Санкт-Петербургский национальный исследовательский университет информационных технологий, механики и оптики», г. Санкт-Петербург.



