Формирование первичных и вторичных гиперлипидемий сопровождается изменениями показателей, характеризующих состояние липидного обмена, в основе которых лежат различные механизмы – стимуляция выхода липидов из депо в кровь, нарушение экскрекции и утилизации холестерина печенью, снижение активности постгепариновой липопротеинлипазы крови и другие [2].
Стимуляция липолиза и выброс продуктов гидролиза тканевых липидов зависит от состояния механизмов регуляции активности липолитических гидролаз. Различают несколько типов липаз, активность которых регулируется различными факторами: липаза, активируемая адреналином; липаза, действующая в нестимулированной ткани; липаза липопротеидная, активность которой повышается при инкубации с гепарином. Жиромобилизующая липаза осуществляет гидролиз триглицеридов, обеспечивает поступление в кровь неэтерефицированных жирных кислот с последующим их использованием в качестве энергетического материала. Липазу жировой ткани кроме адреналина активируют норадреналин, соматотропный гормон, адренокортикотропный гормон. Липопротеидная липаза обладает как липолитическим, так и липосинтетическим действием в отношении триглицеридов жировой ткани. Кроме гепарина активность липопротеидлипазы повышает добавление в инкубационную среду инсулина и глюкозы. У человека с нормальным обменом веществ, не страдающего ожирением, и та и другая липаза, будучи достаточно активными, в известной мере уравновешивают процессы липогенеза и липосинтеза. На первой стадии внутриклеточного липолиза происходит гидролиз триглицеридов до диглицеридов, и эта медленная стадия лимитирует скорость всего процесса. Стимулирует его цАМФ, образующийся аденилатциклазой в ответ на гормональную стимуляцию. Мембрана жировой клетки обладает двумя типами рецепторов гормонов. С первыми взаимодействуют катехоламины (адреналин или норадреналин), усиливающие образование цАМФ, а значит и липолиз, со вторыми взаимодействует инсулин, который снижает концентрацию цАМФ, противодействуя активации аденилатциклазы стимулирующими гормонами, и угнетает таким образом липолиз.
Соединения, обладающие гиполипидемическим действием, способны восстанавливать нарушенные механизмы регуляции липидного обмена [1]. Среди растительных веществ с обнаруженной гиполипидемической активностью особенно интересным представляется исследование возможного влияния на активность тканевых липолитических ферментов соединений близких по строению к некоторым эндогенным гуморальным регуляторам. Так, исследуемые нами объекты предположительно могут реализовывать свой гиполипидемический эффект благодаря гормоноподобному действию, обусловленному родством структуры урсоловой и олеаноловой кислот со стероидными регуляторами, активно участвующими в регуляции липидного обмена (рисунок).
Целью данной работы явилось изучение влияния курсового введения тритерпеноидов облепихи (ТО) и тритерпеноидов клюквы (ТК) на интенсивность катехолстимулированного липолиза в жировой ткани.
Материалы и методы исследования
Сумма тритерпеновых кислот облепихи (ТО) и сумма тритерпеновых кислот клюквы (ТК) (предоставлены ООО «СиНаМ») – аморфный порошок от белого до желто-кремового цвета. Содержание суммы урсоловой и олеаноловой кислот не менее 75 %.
Исследования выполнены на 32 крысах-самцах линии Wistar массой 230–250 г. Источник получения животных – ФГУП «Питомник лабораторных животных «Рапполово» РАМН. Животные содержались на стандартном пищевом рационе со свободным доступом к корму (Полнорационный комбикорм рецепт ПК-120 для содержания лабораторных животных, ГОСТ Р 50258-92, производитель ООО «Лабораторкорм») и воде. После 14-дневного карантина животные распределялись по группам по 8 животных в каждой. ТО и ТК вводили перорально раз в сутки в виде водной суспензии (стабилизатор твин-80) в дозе 100 мг/кг в течение 30 суток. Контрольной группе животных вводили растворитель в эквиобъемном количестве. В качестве референтного средства использовали трайкор (фенофибрат – современный гиполипидемический препарат) в дозе 12,5 мг/кг по схеме введения сходной с ТО и ТК. Через 1 час после последнего введения исследуемых соединений вводили внутрибрюшинно раствор адреналина в дозе 1,5 мг/кг [4]. Перед введением адреналина и через 30 минут после осуществляли забор крови из подъязычной вены. В крови определяли содержание свободного глицерина и глюкозы. Определение биохимических показателей сыворотки крови выполняли на автоматическом биохимическом анализаторе BS-380 (Mindray) с использованием стандартных наборов реактивов фирмы Diasis (Германия).
Уровень глюкозы в сыворотке животных определяли ферментативным фотометрическим тестом «GOD-PAP» с использованием глюкозооксидазы. Принцип определения: определение глюкозы ферментативным окислением в присутствии глюкозооксидазы. Окрашенный индикатор хинонимин образуется из фенола и 4-аминоантипирина под действием пероксида водорода при каталитическом воздействии пероксидазы (реакция Триндера).
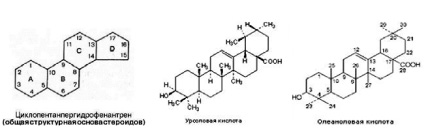
Структурные формулы: циклопентанпергидрофенантрен (общая структурная основа стероидов), урсоловая кислота, олеаноловая кислота
Уровень свободного глицерина в сыворотке животных определяли колориметрическим ферментативным тестом с использованием глицерол-3-фосфатоксидазы. Принцип определения: индикатором является хинонимин, который образуется из 4-аминоантипирина и 4-хлорфенола под действием перекиси водорода при каталитическом участии пероксидазы.
Увеличение оптической плотности при 546 нм прямо пропорционально концентрации свободного глицерина и глюкозы в образце.
Статистическая обработка проводилась с использованием t-критерия Стьюдента и U-критерия Манна – Уитни с предварительным анализом выборки на нормальность распределения. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимали равным 0,05.
Результаты исследования и их обсуждение
При исследовании интенсивности липолиза в жировой ткани, индуцированного введением адреналина, выполняли определение концентрации в крови одного из конечных продуктов гидролиза триглицеридов – глицерина. О влиянии соединений на липолитические процессы в клетках жирового депо животных судили по степени прироста концентрации данного метаболита. Кроме того, дополнительно регистрировали уровень глюкозы, в регуляции которого катехоламины принимают активное участие. Парентеральное введение адреналина привело к пятикратному росту концентрации свободного глицерина в крови во всех экспериментальных группах. Данные изменения достоверно не отличались между всеми опытными группами и контрольной группой животных (табл. 1).
Как видно из данных (табл. 2), введение адреналина сопровождалось прогнозируемым ростом концентрации глюкозы в крови в большей части групп (контроль – 45 %, ТК – 28 %, ТО – 16 %), за исключением животных, получавших трайкор. В группе животных, которым вводили референтное средство, напротив, отмечено развитие гипогликемии.
Таблица 1
Изменение уровня свободного глицерина в сыворотке крови после адреналиновой стимуляции на фоне курсового введения ТО и ТК
|
Показатели Группы |
Свободный глицерин, ммоль/л |
||
|
до |
после |
Δ |
|
|
Контроль, n = 8 |
0,124 ± 0,036 |
0,516 ± 0,106▼ |
0,418 ± 0,101 |
|
ТК, 100 мг/кг, n = 8 |
0,086 ± 0,016 |
0,591 ± 0,109▼ |
0,505 ± 0,111 |
|
ТО, 100 мг/кг, n = 8 |
0,143 ± 0,028 |
0,66 ± 0,077▼ |
0,518 ± 0,072 |
|
Трайкор, 12,5 мг/кг, n = 8 |
0,139 ± 0,043 |
0,624 ± 0,065▼ |
0,485 ± 0,203 |
Примечания:
ТО – тритерпеноиды облепихи, ТК – тритерпеноиды клюквы;
* – достоверная разница по отношению к контролю, р ≤ 0,05;
▼ – достоверная разница по отношению к исходным значениям, р ≤ 0,05;
Δ – разница между значениями показателя после введения адреналина и до введения адреналина.
Таблица 2
Изменение уровня глюкозы в сыворотке крови после адреналиновой стимуляции на фоне курсового введения ТО и ТК
|
Показатели Группы |
Глюкоза, ммоль/л |
||
|
до |
после |
Δ |
|
|
Контроль, n = 8 |
4,57 ± 0,50 |
6,64 ± 1,47 |
2,07 ± 1,19 |
|
ТК, 100 мг/кг, n = 8 |
4,29 ± 0,49 |
5,48 ± 1,08 |
1,19 ± 0,42 |
|
ТО, 100 мг/кг, n = 8 |
4,77 ± 0,10 |
5,69 ± 0,83 |
0,93 ± 0,29 |
|
Трайкор, 12,5 мг/кг, n = 8 |
4,33 ± 0,03 |
3,15 ± 0,90*▼ |
–1,18 ± 0,32*▼ |
Примечания:
ТО – тритерпеноиды облепихи, ТК – тритерпеноиды клюквы;
* – достоверная разница по отношению к контролю, р ≤ 0,05;
▼ – достоверная разница по отношению к исходным значениям, р ≤ 0,05;
Δ – разница между значениями показателя после введения адреналина и до введения адреналина.
В механизмах поддержания пула липидов в крови большое значение имеет мобилизация липидов из жировых депо организма в результате активации липолитических механизмов [5], и некоторые гиполипидемические препараты (никотиновая кислота) способны подавлять выброс липидов путем подавления внутриклеточного липолиза [3]. Полученные нами результаты свидетельствуют, что на фоне приема ТО, ТК и трайкора не происходит нарушений в механизме аденилатциклазной активации липолиза, вызванной введением адреналина. В данных исследованиях установлено, что введение исследуемых субстанций и препарата сравнения сопровождается естественной активацией липолиза, причем ее уровень достоверно не отличается от изменений в контрольной группе животных. Таким образом, в данных экспериментальных условиях ТК, ТО и трайкор не оказали влияния на тканевой липолиз. Регистрация характера изменений уровня глюкозы, которые представляли интерес с позиции оценки влияния соединений на известные механизмы гуморальной регуляции уровня глюкозы в крови, которая через ряд ключевых метаболитов имеет тесную связь с обменом липидов. Было установлено, что введение ТК и ТО не оказало влияния на изменение концентрации глюкозы в крови после адреналиновой инициации гипергликемии, а на фоне введения трайкора отмечена четкая картина нарушения физиологического механизма стимуляции выхода глюкозы в кровяное русло, так как вопреки ожидаемому стандартному сдвигу концентрации глюкозы в крови в сторону увеличения после инъекции адреналина, отмечали обратную картину – достоверное по отношению к контролю снижение ее концентрации.
Выводы
1. Курсовое введение ТО и ТК не оказывает влияния на гормонально зависимый липолиз в жировых депо животных.
2. Курсовое введение ТО и ТК не оказывает влияния на механизмы поддержания уровня глюкозы в крови.
3. Курсовое введение трайкора (фенофибрата) в дозе 12,5 мг/кг вызывает нарушение физиологических механизмов регуляции уровня глюкозы в крови.
Рецензенты:
Василенко Ю.К., д.м.н., профессор кафедры биохимии и микробиологии ПМФИ филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Калашникова С.А., д.м.н., профессор кафедры морфологии и патологии ПМФИ филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.



