Воздействие неблагоприятных факторов вызывает серьёзные эндокринные сдвиги в живом организме, в том числе на разных уровнях репродуктивного аппарата [1, 7]. К числу таких факторов можно отнести выбросы химических предприятий, многие физические факторы, эмоциональные стрессы, неполноценное питание и, конечно же, постоянно действующее на нас электромагнитное излучение различных диапазонов [3]. Сегодня низкоинтенсивное электромагнитное (микроволновое) излучение используется в активно развиваемых телекоммуникационных системах: сотовых телефонах, устройствах Bluetooth, WiFi и WiMAX, поэтому изучение его влияния на биосистемы различного уровня организации является актуальной задачей [11]. Передача, распределение и использование электроэнергии сопровождается воздействием на организм низкочастотных электромагнитных полей. Изучению влияния электромагнитных полей как высоких, так и низких частотных диапазонов на живые организмы посвящено достаточно работ [14]. Постоянное воздействие электромагнитного излучения на организм отрицательно сказывается на мужской репродуктивной функции [4]. Вместе с тем в литературе приводится мало сведений, касающихся профилактики нарушений репродуктивной функции в условиях стресса, вызванного электромагнитным излучением. В исследованиях последних лет говорится о протекторных свойствах антиоксидантов в условиях развития окислительного стресса. Это касается, прежде всего, функциональных возможностей такого классического антиоксиданта, как витамин E [15]. Однако об альтернативных корректорах репродуктивной функции в условиях интенсификации процессов свободнорадикального окисления (СРО) говорится мало.
Целью настоящей работы является изучение корректирующих эффектов селенсодержащего биокомплекса, состоящего из селексена и аскорбиновой кислоты, на морфофункциональное состояние семенников экспериментальных животных в условиях воздействия низкоинтенсивного микроволнового излучения.
Материалы и методы исследования
Для исследования взяли 40 половозрелых самцов белых крыс массой 210 ± 10 г. Эксперименты на животных осуществлялись в соответствии с требованиями Женевской конвенции (1985). Животные были разделены на 4 группы: одна контрольная (К) и три опытные. В первую опытную группу (О-1) вошли животные, получавшие перорально селексен в сочетании с аскорбиновой кислотой в дозах соответственно 1,5 и 500 мг/кг массы тела животного в сутки в течение 50 дней. Группу О-2 составили животные, подвергавшиеся воздействию микроволнового излучения (МВИ) с частотой 42 ГГц («Явь-1-7,1»; λ = 7,1 мм) в течение 30 дней по 30 минут ежедневно. В группу О-3 вошли животные, получавшие селексен в сочетании с аскорбиновой кислотой в указанных дозах в течение 50 дней, а параллельно с третьей недели введения указанных препаратов подвергавшиеся воздействию МВИ указанного частотного диапазона в течение 30 дней по 30 минут ежедневно. По окончании экспериментальных воздействий в крови определяли уровень перекисного гемолиза эритроцитов [8]. В ткани семенников определяли исходный уровень малонового диальдегида (МДА) и кинетические показатели ПОЛ [12]. Состояние сперматогенеза у животных оценивали по методу, предложенному В.П. Маминой и Д.И. Семеновым [5]. Эпидидимальные сперматозоиды извлекали из хвостовой части эпидидимисов, разрезая их вдоль, семенную жидкость вымывали дозированным количеством физиологического раствора (эмпирически для крыс это количество 2–4 мл) и получали суспензию [10]. Подсчёт общего числа эпидидимальных сперматозоидов в суспензии производили в камере Горяева под окуляром светового микроскопа при увеличении 600х. Число спермиев подсчитывали в 5 больших квадратах камеры Горяева по диагонали. Кроме того, определяли процентное соотношение между различными морфологическими формами сперматозоидов (дефективные, подвижные и мёртвые). Для общей оценки морфофункционального состояния тестикулярной ткани изготовляли срезы семенников толщиной 7 мкм, которые окрашивали гематоксилин-эозином. Статистическую обработку полученных данных выполняли с использованием критерия Стьюдента (t), различия считали достоверными при p < 0,05 [2].
Результаты исследования и их обсуждение
Под действием электромагнитного излучения указанной частоты зафиксировано достоверное усиление перекисного гемолиза эритроцитов, в сравнении с контролем (50,2 ± 2,21 и 42,2 ± 3,49 % соответственно), что свидетельствует об усилении свободнорадикальных окислительных процессов в крови и развитии оксидативного стресса. Развитие окислительного стресса, сопряжённого с радикальным окислением ненасыщенного фосфолипида RH, можно выразить следующей схемой [6]:
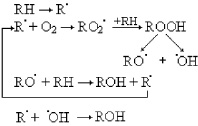
В условиях воздействия МВИ в ткани семенников отмечалось усиление динамики процессов СРО. Исходный уровень МДА возрос почти на 38,5 %, по сравнению с контрольными значениями (табл. 1). Кинетические показатели ПОЛ в условиях стресса также возрастали, однако достоверное усиление липопероксидации наблюдалось в случае асПОЛ. Вместе с тем селенсодержащий биокомплекс (селексен + аскорбиновая кислота) способствовал снижению исходного уровня МДА при воздействии МВИ, что указывает на проявление указанным биокомплексом антиоксидантных свойств (рис. 1).
В условиях воздействия микроволнового излучения наблюдалось полнокровие сосудов семенников и общее снижение половых клеток. Наблюдалось хаотичное расположение клеток сперматогенного эпителия на фоне в ряде случаев отслоения базальной мембраны. В отдельных случаях наблюдались множественные разрывы базальной мембраны, запустевание семенных канальцев, либо неравномерная высота сперматогенного эпителия (рис. 2). Под влиянием ЭМИ указанной частоты отмечался прирост общего количества клеток Лейдига на 42 %, в сравнении с контролем (P < 0,001), причем пролиферация происходила за счет главным образом средних клеток. Предварительное введение биокомплекса способствовало заметному снижению деструктивных эффектов, вызываемых одним только микроволновым излучением. Семенные канальцы были заполнены разными типами сперматогенных клеток. Ближе к просвету семенных канальцев можно видеть сперматозоиды. Высота сперматогенного эпителия оказалась визуально заметно выше (рис. 3).
Таблица 1
Изменение показателей ПОЛ в ткани семенников в условиях воздействия микроволнового излучения
|
Условия опыта |
n |
МДАисх, нмоль/0,05 г |
Кинетические показатели, нмоль МДА/ч |
|
|
спПОЛ |
асПОЛ |
|||
|
Контроль |
10 |
4,89 ± 0,151 |
45,97 ± 0,840 |
48,74 ± 0,702 |
|
МВИ |
10 |
6,77 ± 0,272 |
48,32 ± 2,003 |
55,21 ± 0,894 |
|
P |
P < 0,001 |
P > 0,05 |
P < 0,001 |
|
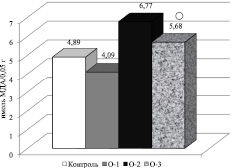
Рис. 1. Исходный уровень МДА под действием МВИ, селенсодержащего биокомплекса и их сочетания. ○ P = 0,01 – в сравнении с группой животных, подвергнутых воздействию МВИ
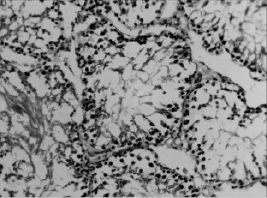
Рис. 2. Структура извитых канальцев семенников животных, подвергнутых воздействию микроволнового излучения. Окраска гематоксилин-эозином. Увеличение 200х
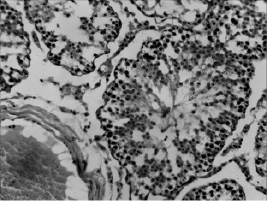
Рис. 3. Структура извитых канальцев семенников крыс, подвергавшихся воздействию микроволнового излучения и получавших селенсодержащий биокомплекс. Окраска гематоксилин-эозином. Увел. 200х
Под влиянием микроволнового излучения (опытная группа О-2) отмечалось уменьшение общего количества сперматогенных клеток. Наблюдалась пролиферация незрелых форм (сперматогонии и сперматоциты), в то время как относительное и абсолютное количество зрелых форм (сперматозоиды) резко сократилось. Предварительное введение селенсодержащего биокомплекса с последующим воздействием микроволнового излучения вызывает улучшение сперматогенеза на стадии превращения сперматид в сперматозоиды, в сравнении с группой животных, подвергавшихся воздействию только микроволнового излучения. При этом следует отметить выраженный прирост исходных клеток сперматогенного цикла – сперматогоний, по сравнению с контрольной группой. Кроме того, абсолютное количество сперматозоидов в группе животных, подвергавшихся воздействию микроволнового излучения на фоне потребляемого селенсодержащего биокомплекса, оказалось даже выше по сравнению с контрольной группой (табл. 2).
Из полученных данных видно, что селенсодержащий биокомплекс в сочетании с микроволновым излучением крайне высоких частот (КВЧ) способствует нормализации сперматогенеза на начальных и конечных этапах сперматогенного цикла, что должно положительно сказаться на дальнейших этапах созревания спермы в эпидидимальной области семенника. Количество и морфофункциональное состояние эпидидимальных сперматозоидов у белых крыс в норме и в условиях экспериментальных воздействий отражено в табл. 3.
Таблица 2
Состояние сперматогенеза у крыс после воздействия микроволнового излучения
|
Тестикулярные показатели сперматогенеза |
Контроль (n = 10) |
Опытная группа О-2 (n = 10) |
Опытная группа О-3 (n = 10) |
|
Общее количество сперматогенных клеток, млн |
5236 ± 270,0 |
4353 ± 154,0 |
5695 ± 304,0 |
|
Сперматогонии, % |
22,5 ± 1,52 |
26,1 ± 1,22 |
27,0 ± 1,35 |
|
Сперматоциты, % |
20,7 ± 1,67 |
27,2 ± 1,43 |
22,5 ± 1,09 |
|
Сперматиды, % |
21,6 ± 1,76 |
20,8 ± 1,11 |
14,8 ± 0,72 |
|
Сперматозоиды, % |
35,2 ± 2,66 |
25,9 ± 1,74 |
35,7 ± 1,77 |
Таблица 3
Состояние эпидидимальных сперматозоидов у крыс под действием микроволнового излучения, селенсодержащего биокомплекса и их сочетания
|
Показатели эпидидимальных сперматозоидов |
Контроль (n = 10) |
О-1 (n = 10) |
О-2 (n = 10) |
О-3 (n = 10) |
|
Общее количество, млн |
50,0 ± 6,51 |
54,3 ± 6,00 |
* 34,1 ± 1,38 |
ΔΔ 53,2 ± 4,83 |
|
Дефективные, % |
18,2 ± 2,22 |
** 13,1 ± 0,62 |
** 30,5 ± 2,45 |
ΔΔ 21,2 ± 1,23 |
|
Подвижные, % |
81,0 ± 6,20 |
88,0 ± 6,11 |
** 60,1 ± 2,65 |
66,4 ± 2,77 |
|
Мёртвые, % |
9,8 ± 0,82 |
*** 4,7 ± 0,72 |
*** 30,2 ± 1,21 |
ΔΔΔ 17,4 ± 0,98 |
Примечания: * P < 0,05; ** P < 0,01; *** P < 0,001 – в сравнении с контролем; ΔΔ P < 0,01; ΔΔΔ P < 0,001 – в сравнении с группой животных, подвергавшихся воздействию микроволнового излучения.
Под влиянием МВИ количество дефективных сперматозоидов (30,5 %) возросло в 1,7 раз, в сравнении с контролем (18,2 %). Количество мёртвых сперматозоидов возросло в 3 раза (30,2 %) по сравнению с контролем (9,8 %) (P < 0,001). Отсутствие подвижности сперматозоидов в основном связано с таким дефектом, как облом хвоста, что можно объяснить усилением процесса липопероксидации в условиях воздействия микроволнового излучения. Предварительное потребление животными селенсодержащего биокомплекса способствовало снижению деструктивных последствий микроволнового излучения. Отмечалась тенденция к увеличению общего количества эпидидимальных сперматозоидов. Количество дефективных сперматозоидов в группе животных, подвергавшихся воздействию микроволнового излучения на фоне приёма селенсодержащего биокомплекса, не отличалось достоверно от такового контрольной группы. Селенсодержащий биокомплекс способствовал некоторому улучшению подвижности сперматозоидов в условиях воздействия микроволнового излучения, по сравнению с группой животных, подвергавшихся только воздействию излучения.
В дополнительном исследовании оценивали по разработанной нами методике средний коэффициент качества сперматозоидов (СККС) в %. Данный коэффициент учитывал морфологические и двигательные характеристики эпидидимальных сперматозоидов. Контроль принимали за 100 %. В группе О-1 относительно контроля этот коэффициент составил 110 %; в группе О-2 – 65 %, а в группе О-3 – 85 %. Таким образом, селенсодержащий биокомплекс способствует улучшению морфокинетических показателей эпидидимальных сперматозоидов в условиях воздействия микроволнового излучения. Учитывая тот факт, что в сборке хвоста сперматозоидов участвует селенопептид, можно заключить, что морфофункциональное состояние сперматозоидов определяется возможностью поступления селена в организм [9].
Таким образом, селенсодержащий биокомплекс, включающий в себя аскорбиновую кислоту и селексен, оказывает корректирующий эффект в отношении сперматогенной функции в условиях воздействия МВИ. Коррекция сперматогенеза достигается двумя путями:
1) за счет снижения интенсивности процессов СРО в ткани семенников;
2) за счет внедрения атомов селена в структуру пептидов, образующих хвостовую часть сперматозоидов.
Аскорбиновая кислота, будучи звеном неферментативной цепи антиоксидантной системы, способствует снижению уровня липопероксидации в тестикулярной ткани, что в целом благотворно сказывается на общем функциональном состоянии. Вместе с тем аскорбиновая кислота способна регулировать уровень селена в организме и выводить его избыток из организма [13]. Кроме того, селен является необходимым компонентом селенсодержащей глутатионпероксидазы, выступающей в качестве звена ферментативной цепи антиоксидантной системы.
Рецензенты:
Великородов А.В., д.х.н., профессор, зав. кафедрой фармацевтической химии Астраханского государственного университета, г. Астрахань;
Бойко О.В., д.м.н., профессор кафедры биохимии с курсом лабораторной диагностики, ГБОУ ВПО «Астраханский государственный медицинский университет» Минздрава России, г. Астрахань.
Работа поступила в редакцию 10.04.2015.



