Изменения миокарда, как показано во многих исследованиях, могут сопровождать различные инфекционные заболевания. Признаки миокардита, по данным патологоанатомов, обнаруживают у 10 % больных, умерших от инфекций [8]. Среди всех аутопсий воспалительные признаки в миокарде регистрируют в 4–9 % случаев [1]. Клиницистами миокардит в настоящее время диагностируется очень редко: примерно 1 на 100000 населения в год [2]. Наиболее частой причиной становятся вирусы [3].
Патологические процессы в кардиомиоцитах универсальны, вне зависимости от вида возбудителя. При крайней степени выраженности повреждения может наступить разрушение клетки с последующим замещением соединительной тканью, что возможно при любой патологии миокарда: ишемической болезни сердца, воспалительной кардиомиопатии или миокардите, что приводит к нарушению в той или иной степени функции миокарда [4].
Убедительно подтвердить характер изменений в миокарде можно только при гистологическом исследовании биоптата. Однако, по многочисленным данным, вероятность обнаружения лейкоцитарной инфильтрации, являющейся основным критерием воспалительного процесса, возрастает с увеличением числа исследованных образцов. С другой стороны, есть данные о случаях прогрессирования классической картины миокардита после проведения эндомиокардиальной биопсии с полученным отрицательным результатом [9, 10]. В связи с этим очевидно, что необходима оценка изменений на лабораторных моделях [6].
Коксаки инфекцию можно рассматривать как основную модель острой кишечной вирусной инфекции. Считается, что наиболее выраженной кардиотропностью обладают вирусы Коксаки В1-4, являющиеся причиной миокардита и энцефаломиокардита новорожденных [5]. У пациентов любого возраста при аутопсии обнаруживают картину очагового интерстициального миокардита и вальвулита. Данные о частоте развития их противоречивы. Коксаки А – вирусная инфекция, по литературным данным, чаще протекает легко, миокардиты развиваются редко, имеют доброкачественное течение [7].
Цель исследования: определить распространенность и характер поражения миокарда на лабораторной модели острой кишечной вирусной инфекции.
Материалы и методы исследования
В исследование было включено 65 самцов линейных мышей ВАLB/с в возрасте 2 недель, массой тела 6–7 граммов. Лабораторные животные до начала исследования содержались в течение 7 дней для адаптации. В течение этого срока у животных каждый день контролировали клиническое состояние путем визуального осмотра. Животные с обнаруженными в ходе осмотра отклонениями в экспериментальные группы включены не были. В опытную группу вошло 60 животных, которые были заражены вирусом Коксаки А № 2046 из Государственной коллекции вирусов РГБУ НИИ вирусологии имени Д.И. Ивановского Минздрава России перорально в дозе LD70. Контрольную группу составили 5 условно здоровых особей. Распределение по группам проводили методом случайной выборки.
Содержание, питание, уход за животными и выведение их из эксперимента осуществляли в соответствии с требованиями «Правил проведения работ с использованием экспериментальных животных» (Приложение к приказу МЗ СССР от 12.08.1977 г. № 755). Для кормления использовали корма для лабораторных животных по ГОСТу 3 502.58-92 производства ООО «МСТ». Основные правила по уходу за животными выполнены в соответствии с «Санитарными правилами по содержанию экспериментально-биологических клиник (вивариев), утвержденных приказом МЗ СССР № 755 от 12.08.1977 г.
Морфологическому исследованию был подвергнут миокард 53 мышей: на 3-и, 7-е, 14-е и 21-е сутки от момента заражения с помощью оптической микроскопии препаратов, окрашенных гематоксилин-эозином с увеличением 240х. Использовался окуляр 10х и объектив 40х. Погибшие особи (7 животных) были исключены из исследования по техническим причинам.
Оценку состояния миокарда и кардиомиоцитов, согласно впервые разработанной в ходе данного эксперимента схеме, проводили по 7 гистологическим параметрам, отражающим состояние миокарда и кардиомиоцитов, позволяющим сделать соответствующее гистологическое заключение. Учитывались:
1) состояние мембраны кардиомиоцита;
2) состояние цитоплазмы кардиомиоцита;
3) форма кардиомиоцитов;
4) форма ядер кардиомиоцитов;
5) исчерченность миофибрилл в цитоплазме кардиомиоцита;
6) состояние соединительно-тканной стромы миокарда;
7) состояние кровеносных сосудов миокарда.
Оценка выраженности изменений была проведена в баллах, что показано в таблице.
Результаты исследования и их обсуждение
У контрольных мышей ВALВ/с в миокарде была выявлена картина, соответствующая адаптационной норме, что представлено на рис. 1.
Клеточная мембрана четкая (1). Цитоплазма кардиомиоцитов в состоянии слабо выраженной зернистой дистрофии (1). Кардиомиоциты имели вытянутую форму (1). Нормохромные ядра кардиомиоцитов овальной формы (1) были смещены субламеллярно. В цитоплазме кардиомиоцитов прослеживается четкая поперечно-полосатая исчерченность его цитоплазмы (1). Соединительно-тканная строма между кардиомиоцитами слегка отечная (1). В ней выявляются единичные фиброциты (1) и фибробласты (1). Просвет кровеносных сосудов не расширен (1). Во всех образцах миокарда животных опытной группы были обнаружены признаки одновременно дистрофических и воспалительных изменений. У наблюдавшихся особей, которым за 3 суток до выведения из опыта было осуществлено пероральное заражение вирусами Коксаки А, в миокарде выявлена картина умеренно выраженного миокардита, что представлено на рис. 2. При этом клеточная мембрана кардиомиоцитов имела нечеткие контуры (2). Цитоплазма кардиомиоцитов была в состоянии зернистой и зернисто-вакуольной дистрофии (1, 2). Форма кардиомиоцитов была вытянутая и округлая (1, 2). Нормохромные ядра кардиомиоцитов были смещены в них почти центрально и чаще имели округлую форму (2).
В цитоплазме кардиомиоцитов нечетко прослеживалась её поперечно-полосатая исчерченность (1, 2). Соединительно-тканная строма между кардиомиоцитами была отечной (2) с умеренным количеством фибробластов (2), фиброцитов (2) и с единичными лимфоцитами (2). Кровеносные сосуды микроциркуляторного русла, выявляемые в соединительно-тканной пластине, были полнокровными (2).
Степени выраженности морфологических изменений, оцененные в баллах, в миокарде лабораторных животных
|
Параметры оценки |
Адаптационная норма |
Умеренно выраженные изменения |
Выраженные изменения |
|
1 |
2 |
3 |
|
|
Состояние мембраны кардиомиоцита |
Четкие контуры |
Нечеткие контуры |
Оболочка кардиомиоцитов не визуализируется |
|
Состояние цитоплазмы кардиомиоцита |
Слабо выраженная зернистая дистрофия |
Зернистая и зернисто-вакуольная дистрофия |
Вакуольная дистрофия |
|
Форма кардиомиоцитов |
Вытянутая |
Вытянутая и округлая |
Округлая |
|
Ядра кардиомиоцитов |
Нормохромные, овальной формы, расположены субламеллярно |
Нормохромные, округлой формы, расположены центрально |
Гипохромные или гиперхромные округлой формы, расположены центрально |
|
Исчерченность миофибрилл в цитоплазме кардиомиоцита |
Четкая поперечно-полосатая исчерченность |
Нечеткая поперечно-полосатая исчерченность |
Поперечно-полосатая исчерченность отсутствует |
|
Состояние соединительно-тканной стромы миокарда |
Небольшая отечность, единичные фиброциты и фибробласты |
Умеренная отечность, многочисленные фибробласты и фиброциты, единичные лимфоциты |
Значительная отечность, многочисленные фибробласты и фиброциты, лимфоциты. |
|
Состояние кровеносных сосудов миокарда |
Просвет не расширен |
Полнокровие сосудов |
Ишемия сосудов |
Примечание. За 1 было принято состояние миокарда особей контрольной группы. Умеренно выраженные изменения оценивались в 2 балла. Интенсивным нарушениям присваивалось 3 балла.
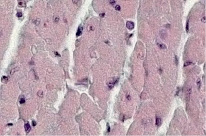
Рис. 1. Миокард мыши контрольной группы, окраска гематоксилин-эозином, 240х
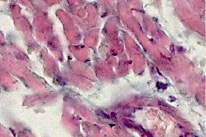
Рис. 2. Миокард мыши на 3-и сутки после заражения вирусом Коксаки А, окраска гематоксилин-эозином, 240х
На 7-е сутки Коксаки-вирусной инфекции у животных опытной группы в сердечной мышце определялись несколько более выраженные изменения, которые также соответствовали картине умеренно выраженного миокардита, что представлено на рис. 3. При этом клеточная оболочка кардиомиоцитов не имела четких контуров (2). Цитоплазма кардиомиоцитов находилась в состоянии зернисто-вакуольной дистрофии (1, 2). Форма кардиомиоцитов вытянутая или округлая (1, 2). Большинство кардиомиоцитов на этом сроке заболевания уже имели гипохромные овальные ядра, которые были смещены в центр цитоплазмы (1, 2, 3). Цитоплазма кардиомиоцитов не имела четкой поперечно-полосатой исчерченности (1, 2). Соединительно-тканная пластинка между кардиомиоцитами была отечной (2, 3), с многочисленными фибробластами, фиброцитами и единичными лимфоцитами (2). Кровеносные сосуды микроциркуляторного русла оставались полнокровными (2). На 14-е сутки Коксаки-вирусной инфекции в миокарде у животных опытной группы были выявлены максимальные изменения, что соответствовало картине выраженного миокардита. Как представлено на рис. 4, клеточная оболочка кардиомиоцитов не имела четких границ (2). Цитоплазма кардиомиоцитов находилась в состоянии вакуольной дистрофии (2). Форма кардиомиоцитов чаще была овальная (1, 2). Гипохромные ядра кардиомиоцитов располагались в центре цитоплазмы этих клеток (2, 3). Цитоплазма кардиомиоцитов была лишена поперечно-полосатой исчерченности (3).
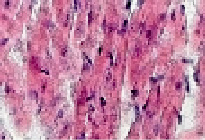
Рис. 3. Миокард мыши на 7-е сутки после заражения вирусом Коксаки А, окраска гематоксилин-зозином, 240х

Рис. 4. Миокард мыши на 14-е сутки после заражения вирусом Коксаки А, окраска гематоксилин-эозином, 240х
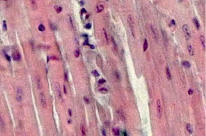
Рис. 5. Миокард мыши на 21-е сутки после заражения вирусом Коксаки А, окраска гематоксилин-эозином, 240х
Соединительно-тканная пластинка между кардиомиоцитами была отечной и инфильтрированной фиброцитами, фибробластами и лимфоцитами (2, 3). Кровеносные сосуды микроциркуляторного русла были ишемичные или слегка полнокровные (3, 2).
На 21-е сутки Коксаки-вирусной инфекции у животных опытной группы гистологически в миокарде была выявлена картина минимально выраженного миокардита, что представлено на рис. 5. Мембрана кардиомиоцитов контурирована (1). Цитоплазма кардиомиоцитов находилась в состоянии зернистой дистрофии (1). Клетки имели овальную или вытянутую форму (1, 2). Нормохромные ядра располагались в центре цитоплазмы кардиомиоцитов (1, 2). Поперечно-полосатая исчерченность четко визуализировалась (1). Собственная пластинка между кардиомиоцитами была умеренно отечна (1) и минимально инфильтрирована фиброцитами (2), фибробластами (2) и единичными лимфоцитами (2). Сосуды микроциркуляторного русла были полнокровными (2).
Обсуждение. Во всех образцах миокарда животных, зараженных вирусом Коксаки А перорально, в дозе LD70, на сроках от 3 до 21 суток присутствовали признаки воспалительного процесса: лимфоцитарная инфильтрация и отечность стромы.
Одновременно были зарегистрированы и типичные дистрофические изменения: зернистая или вакуольная дистрофия цитоплазмы, изменения формы клеток и расположения ядер. Визуализировались изменения сосудов микроциркуляторного русла с их полнокровием и ишемией при максимуме воспалительных и дистрофических изменений на 14-е сутки от момента заражения. Все указанные проявления были на соответствующих сроках, в целом, однотипны у всех особей. В результате действия воспалительных, дистрофических и гипоксических механизмов повреждения миокарда в образцах видны структурные нарушения с признаками распада внутриклеточных структур: нечеткость поперечно-полосатой исчерченности при развитии миокардита на 3-и и 7-е сутки с её отсутствием на 14-е сутки. Отмечены и проявления разрушения самих кардиомиоцитов: клеточная мембрана без четких контуров на 3-и, 7-е и 14-е сутки.
На 21-е сутки в миокарде опытных животных была отмечена картина самостоятельного восстановления после перенесенного миокардита.
Выводы
При пероральном заражении Коксаки А – вирусной инфекцией в дозе LD 70 у опытных мышей в сердце выявляется картина острого вирусного миокардита умеренной и выраженной степени. Максимальная выраженность гистологических проявлений миокардита регистрируется на 14 сутки от момента инфицирования. Воспалительные изменения в миокарде при Коксаки А – вирусной инфекции определяются одновременно с дистрофическими. У выживших особей после перенесенного миокардита отмечается постепенное восстановление структуры миокарда.
Рецензенты:
Макашова В.В., д.м.н., ведущий научный сотрудник клинического отдела инфекционной патологии ФБУН Центрального НИИ эпидемиологии Роспотребнадзора, г. Москва;
Понежева Ж.Б., д.м.н., ведущий научный сотрудник клинического отдела инфекционной патологии ФБУН Центрального НИИ эпидемиологии Роспотребнадзора, г. Москва.



